铜系材料的制备及其催化丁二酸二甲酯加氢的性能探究
2023-10-19赵山山卢雁飞李世松王春雷张东升
王 鹏,赵山山,卢雁飞,李世松,王春雷,舒 畅,张东升
(1.河北工业大学化工学院,天津 300130;2.中海油天津化工研究设计院有限公司,天津 300131)
1,4-丁二醇(简称BDO),分子式为C4H10O2,是一种饱和直链二元醇,具有吸湿性,易溶于水、甲醇、乙醇、丙酮,微溶于乙醚,是一种重要的有机化工和精细化工原料。其下游衍生物种类繁多,可用于制造四氢呋喃、γ-丁内酯、聚丁烯对苯二甲酯、聚丁二酸丁二醇酯等化工产品[1-4]。目前,工业上生产BDO的方法主要有炔醛法、顺酐法、丁二烯法和环氧丙烷法,但4种工艺均基于不可再生的石油原料,生产过程能耗高且会造成环境污染[5-6]。因此,人们开发出更加绿色和可持续发展的BDO生产工艺,即生物法生产BDO,该工艺为BDO的生产开辟了一条崭新的路径[7-9]。
丁二酸二甲酯(DMS)可由生物质平台化合物丁二酸酯化获得,其在高氢酯体积比(简称氢酯比)条件下加氢可制备BDO[10-11]。铜基催化剂因具有较强的C=O键活化能力而对C—C键的氢解能力较弱,且价格低廉、来源广泛,在酯的加氢反应中得到了广泛应用[12-13]。但对于铜系催化剂催化加氢制备BDO反应的研究较少。因此,本文对铜锌铝催化剂催化DMS制BDO反应进行研究,比较不同催化剂的催化加氢性能,并根据催化剂的表征结果,分析了催化剂在DMS加氢反应中的构效关系。
1 实验部分
1.1 原料与仪器
实验原料:丁二酸二甲酯、硝酸铜、硝酸锌、硝酸铝、碳酸钠,均为AR。
仪器:CH-PJ-B044 型固定床;安捷伦7890B 型气相色谱仪;D/max-2500 型X 射线衍射仪;ASAP 2020 型物理吸附仪;ZSX PrimusⅡ型全自动扫描型X射线荧光光谱仪;ASAP 2420 型全自动静态化学吸附仪;Optima5300DV型电感耦合等离子体发射光谱仪。
1.2 催化剂的制备
采用共沉淀法制备Cu-Zn-Al 催化剂。制备过程简述如下:将一定量的硝酸铜、硝酸锌和硝酸铝溶于去离子水中配制成金属离子液体,再配制浓度为1.6 mol/L的碳酸钠溶液作为沉淀剂,在65 ℃水浴中并流滴加上述两种溶液并搅拌,滴加过程中要控制溶液pH为7~8;滴加完毕后继续搅拌2 h老化,然后进行过滤,再用65 ℃的去离子水洗涤至pH 为7,之后在110 ℃烘干12 h、300 ℃焙烧4 h,得到Cu的质量分数为20%、Zn和Al的物质的量比分别为0.05、0.15、0.3、0.6 的Cu-Zn-Al 催化剂,分别标记为0.05CuZnAl、0.15CuZnAl、0.3CuZnAl和0.6CuZnAl。
1.3 催化剂的评价
在固定床反应器上对催化剂反应性能进行评价。具体操作过程如下:将30 mL 20~40 目(375~850 μm)的催化剂装入固定床反应器恒温区,其余部分用相同目数的瓷球装填;通入氮气试漏,确保气密性良好后依次通入氮气和氢气置换;置换后开启加热,程序升温还原催化剂;还原完成后,待催化剂床层升至预设温度和压力后,泵入丁二酸二甲酯溶液进行加氢反应,反应过程中每隔1 h 进行取样分析。
1.4 产物的计算及分析
采用安捷伦7890B 型气相色谱仪对丁二酸二甲酯及1,4-丁二醇进行定量分析,FFAP 色谱柱(60 m×0.32 mm×0.25 μm)、氢火焰(FID)检测器。色谱仪操作条件:载气为氮气,检测器温度为350 ℃,气化室温度为250 ℃;柱温采用程序升温,起始温度为50 ℃,以15 ℃/min 的升温速率升温至240 ℃,保持3 min;采用内标法进行定量分析。反应相关计算公式如下。
式中:mDMS为原料中DMS 的质量,g;m'DMS为反应后溶液中DMS 的质量,g;m1为反应后溶液的总质量,g;w1为反应后溶液中DMS的质量分数,%;mBDO为反应前原料中BDO 的总质量,g;wBDO为反应后溶液中BDO的质量分数,%;X为DMS的转化率,%;Y为BDO的收率,%;S为BDO的选择性,%。
2 催化剂的表征
2.1 XRF
通过XRF 对所制备的铜系催化剂的元素组成及含量进行测定,结果如表1 所示。将测试结果与理论结果进行对比可知,4 种CuZnAl 催化剂实测CuO质量分数在20%左右,Al2O3含量和ZnO含量与理论含量基本保持一致。
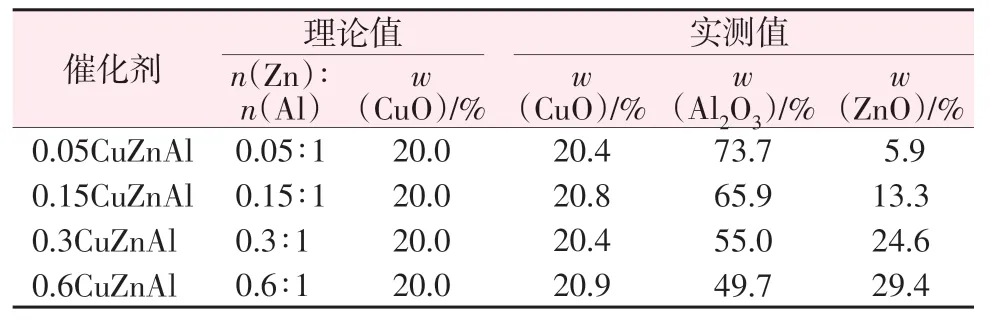
表1 不同催化剂的XRF结果Table 1 XRF results of different catalysts
2.2 BET
为探究不同锌铝物质的量比(简称锌铝比)的铜系催化剂比表面积及孔结构的差别及其对DMS 加氢性能的影响,对4种催化剂进行BET测试,测试结果如表2所示。由表2可知,当锌铝比从0.05增大到0.3 时,催化剂的比表面积有所增加,这可能是由于少量Zn助剂的添加改善了金属颗粒的稳定性,从而减少了催化剂在高温还原处理时的表面积损失。催化剂的孔容随着Zn添加量的增加逐渐降低,这可能是由于添加的金属物种阻塞了载体的孔隙。
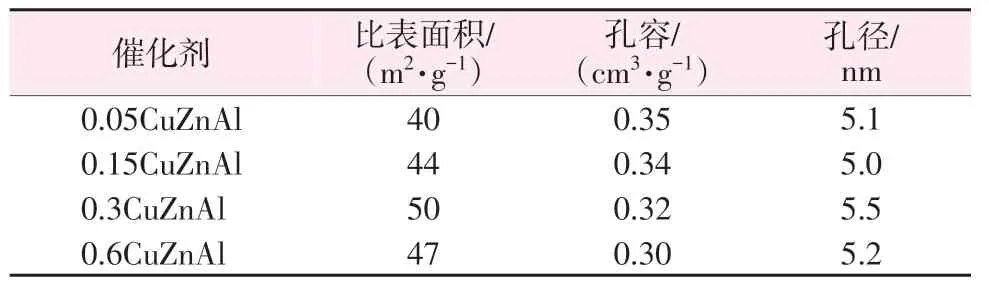
表2 不同催化剂的比表面积、孔径及孔容Table 2 Specific surface area,pore size and pore volume of different catalysts
2.3 XRD
图1 为4 种催化剂的XRD 测试结果。由图1 可知,所制得的催化剂显示出相同混合氧化物的组成,即CuO(PDF#89-5898)、ZnO(PDF#99-0111)和Al2O3(PDF#47-1770),与XRF 测得结果相符。其中0.05CuZnAl、0.15CuZnAl、0.6CuZnAl 催化剂均在2θ为35.5°和38.7°处有明显的特征峰,分别对应CuO的(-111)和(111)晶面;2θ为48.7°及68.1°处为Al2O3的衍射峰;2θ为34.5°、62.9°处的衍射峰为ZnO 的特征衍射峰[14-17]。0.3CuZnAl 催化剂的XRD 峰较为平缓,表明催化剂活性组分在载体表面分散均匀。
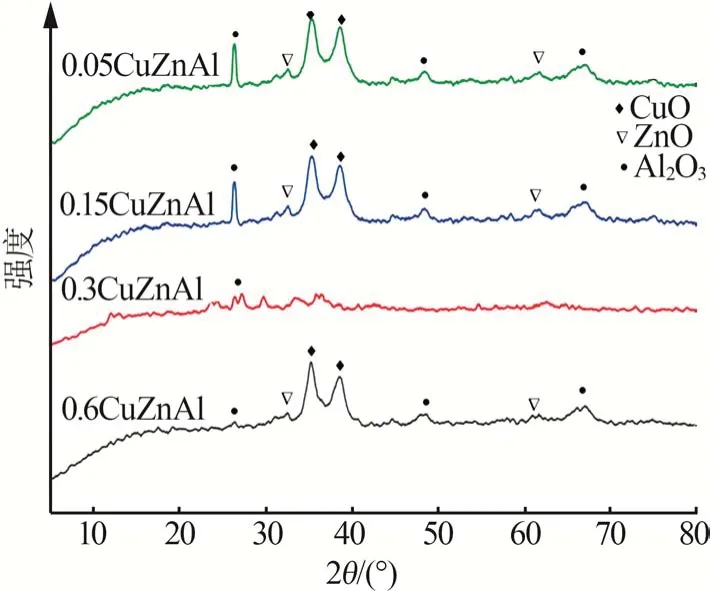
图1 不同催化剂的XRD谱图Fig.1 XRD patterns of different catalysts
2.4 H2-TPR
对不同催化剂进行H2-TPR测试[18-19],结果如图2 所示。图2 还原峰的变化显示了不同锌铝比对催化剂还原性能的影响。其中190 ℃时的特征峰为CuO 的还原峰,图中宽泛的峰可能归因于不同类型的CuO,例如分散在ZnO 之间的Cu2+或者由固溶体形成的Cu2+;另一个原因可能是CuO 颗粒大小分布不同。对比4 种催化剂的还原峰,催化剂0.05CuZnAl、0.3CuZnAl 和0.6CuZnAl 的还原峰面积大于催化剂0.15CuZnAl。相对其他3 个样品,0.3CuZnAl催化剂还原峰向低温移动,表明该催化剂还原温度较低,具有较高的物种分散度,相对较易被还原。
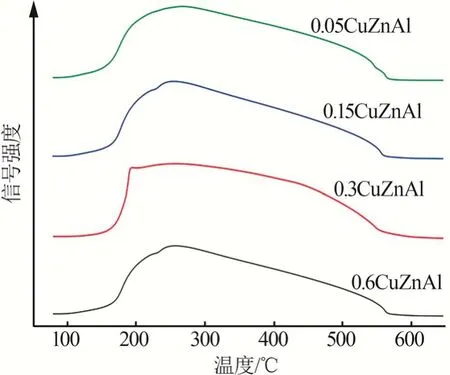
图2 不同催化剂的H2-TPR图Fig.2 H2-TPR diagrams of different catalysts
2.5 NH3-TPD
图3 为所制备的不同CuZnAl 催化剂的NH3-TPD(NH3程序升温脱附)测试结果。文献显示,酯分子与催化剂的相互作用方式可能受到催化剂表面酸碱性质的很大影响[20]。4个样品中,100~<250 ℃处NH3脱附峰归属为表面不同的弱酸性位吸附NH3的峰,400 ℃以上的NH3脱附峰可归属为表面强Lewis酸性位(SLA)吸附NH3的峰[21-22]。对催化剂的酸量进行积分,积分结果如表3所示。由表3可知,所制得的4 种催化剂中,0.15CuZnAl 总酸量最高,0.3CuZnAl 总酸量最低。结果显示适量的锌铝掺杂可以降低Cu-Zn-Al 催化剂样品表面酸性位强度与数量。结合性能测试反应结果可知,催化剂总酸量越少,相同反应条件下丁二酸二甲酯的转化率越高,越有利于反应进行。
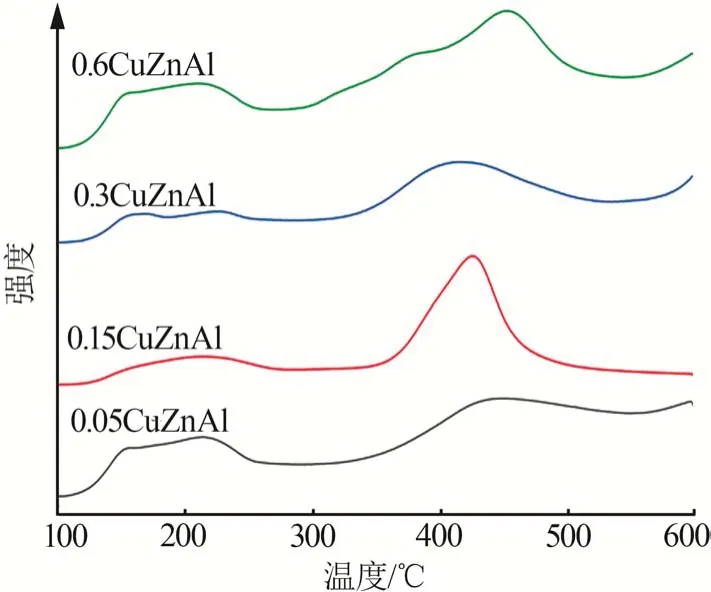
图3 不同催化剂的NH3-TPD图Fig.3 NH3-TPD diagrams of different catalysts
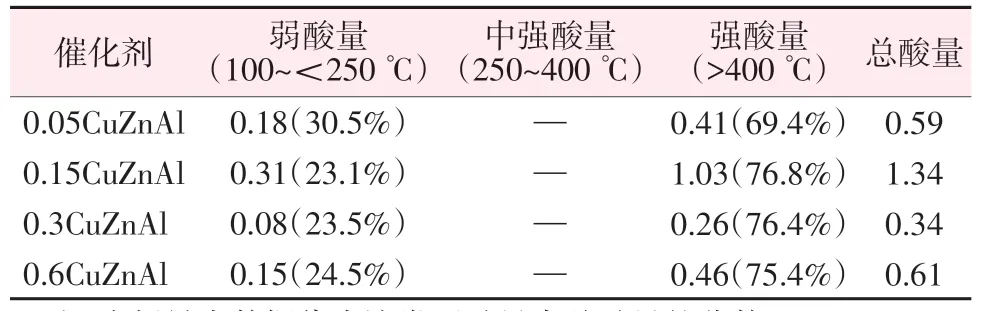
表3 不同催化剂的酸性数据Table 3 Acidity data of different catalysts
2.6 XPS
为确定所制备催化剂表面的元素组成及各元素的化学状态,对所制得的样品进行了XPS 测试。因自旋轨道相互作用,Cu 2p 会分裂成Cu 2p1/2和Cu 2p3/2。不同催化剂的XPS 图见图4。图4 表现出了很明显的CuO谱图特征,在960 eV和940 eV处分别有Cu 2p1/2和Cu 2p3/2的两处强卫星峰。所制备催化剂的Cu2+和Cu0物种的XPS 峰所对应的电子结合能没有明显的差异,表明催化剂表面Cu物种的价态和化学环境相似。与其他样品相比,0.05CuZnAl 和0.6CuZnAl表面的Cu2+比例较高,说明其较其余两样品更易被氧化。XRD表征结果显示,制备的样品物相为结晶度较高的金属氧化物,不易被氧化。因此,推测可能是由于双金属或三金属间的协同作用导致的。另外,由图4a~c 可知,随锌铝比的增大,Cu2+峰值逐渐降低、Cu0峰值急剧增加,当锌铝比为0.3 时,还原态Cu0的比例最高,说明其相较于其他样品更易被还原,与H2-TPR 测试结果一致。文献显示,在DMS催化加氢反应中,铜基催化剂上与铜物种相连的氧空位可促进的加氢[23],催化剂表面高分散的Cu0物种可解离吸附的H2生成活性氢[24-27],是催化过程中的重要步骤,可有效提高催化加氢效率。综合催化反应性能评价测试结果来看,催化剂中Cu0物种所占比例越多,催化性能越优。
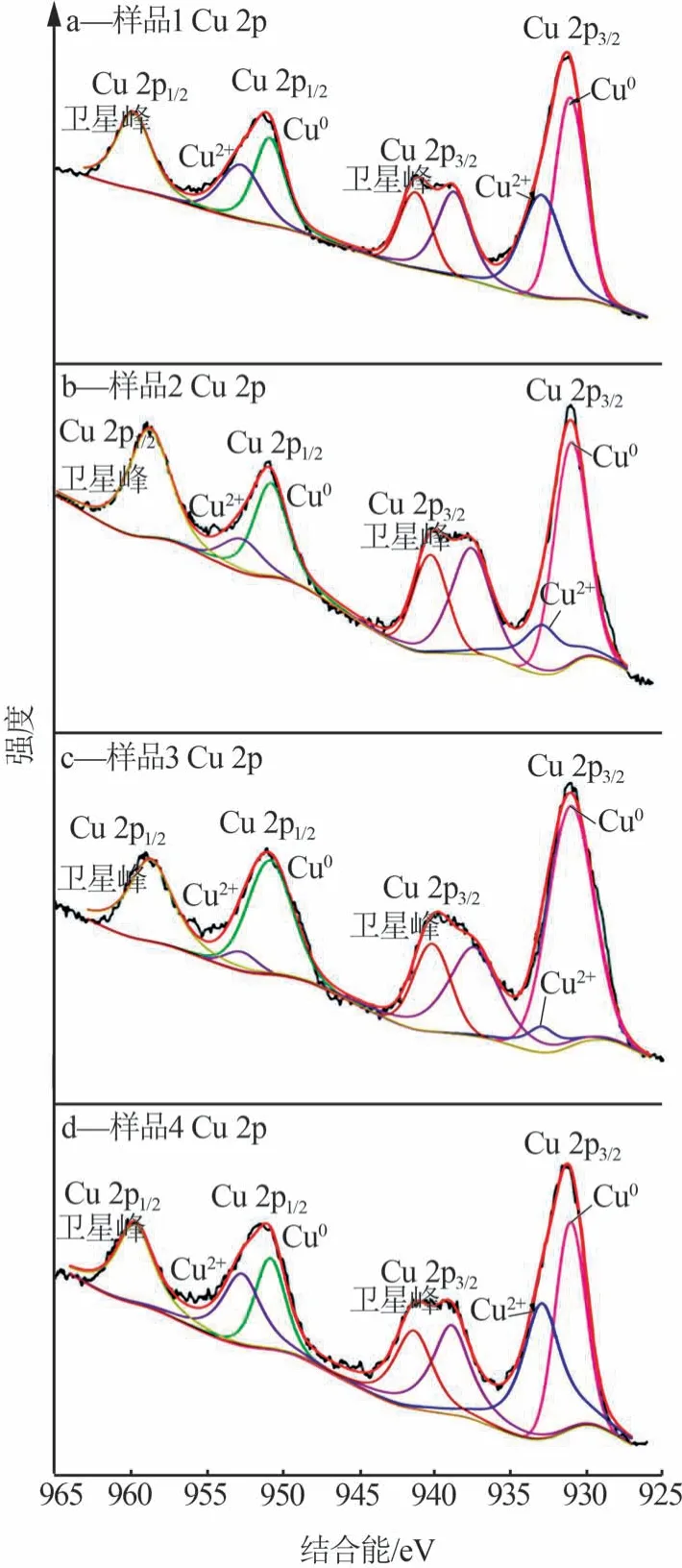
图4 不同催化剂的XPS图Fig.4 XPS spectra of different catalysts
3 催化剂评价结果及讨论
3.1 反应温度的影响
在反应压力为5 MPa、氢酯比为150、液时空速为1 h-1条件下,不同反应温度[28]对丁二酸二甲酯加氢的影响结果如图5 所示。由图5 可以看出,当反应温度低于185 ℃时,丁二酸二甲酯的转化率随温度的升高逐渐增加,BDO 的选择性也随之增加;当温度高于185 ℃时,丁二酸二甲酯的转化率波动较小,而BDO 的选择性大幅度降低。这是由于DMS加氢过程为放热反应,较高的温度对反应不利,而低温可以抑制过度加氢产物如四氢呋喃(THF)的生成,提高BDO 的选择性。同时,反应温度升高,导致表面铜晶粒长大,发生烧结现象,催化剂比表面积会急剧下降,导致催化效果降低。因此,该催化剂催化DMS加氢制备BDO适宜的反应温度为185 ℃。
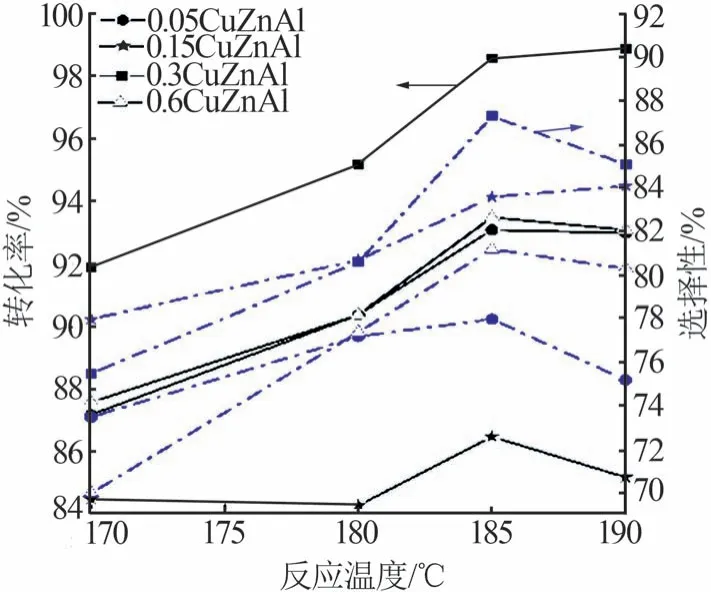
图5 不同反应温度对DMS加氢反应的影响Fig.5 Effect of different reaction temperatures on DMS hydrogenation reaction
3.2 反应压力的影响
在反应温度为185 ℃、氢酯比为150、液时空速为1 h-1条件下,不同反应压力[29]对丁二酸二甲酯加氢的影响结果如图6所示。由图6可知,当反应压力小于5 MPa 时,丁二酸二甲酯转化率随反应压力的增加而增加,反应压力由3 MPa 增加到5 MPa 时,0.05CuZnAl 与0.3CuZnAl 的转化率均增加了6%;同时BDO 选择性也随之增加,0.3CuZnAl 的选择性由77.6%增至87.3%。可见高压有利于BDO 的生成。当反应压力大于5 MPa 时,各催化剂的催化效果提高不明显,丁二酸二甲酯的转化率及BDO选择性波动较小。综合考虑,该催化剂催化DMS 加氢制备BDO适宜的反应压力为5 MPa。
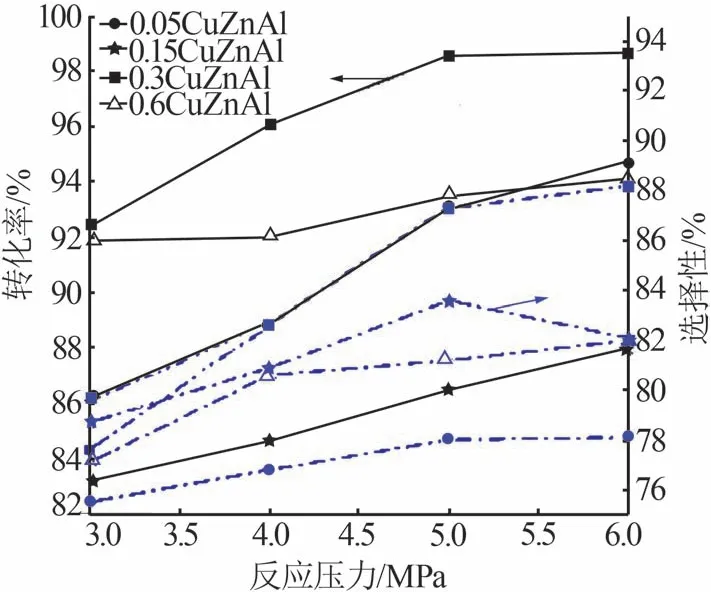
图6 不同反应压力对DMS加氢反应的影响Fig.6 Effect of different reaction pressures on DMS hydrogenation reaction
3.3 氢酯比的影响
在反应温度为185 ℃、反应压力为5 MPa、液时空速为1 h-1的条件下,不同氢酯比对丁二酸二甲酯加氢的影响结果如图7 所示。在工业中,当反应氢酯比合适时,可有效防止聚酯的沉积对催化剂层和管线的污染和堵塞,增加运行周期、降低生产成本。由图7可知,随着氢酯比由50增大至150,DMS转化率及BDO的选择性均迅速增大,尤其是0.3CuZnAl,DMS转化率由75.1%提高至98.2%,提高了23.1%,且BDO选择性提高约5%。但随着氢酯比由150 增至200,DMS转化率及BDO选择性无较大变化,趋于稳定。这是由于DMS 加氢反应存在气-液-固三相间的动态平衡,首先气液混合反应物需扩散到催化剂活性中心[30],然后进一步反应。因此,增加氢气流量,有利于加氢反应进行,反应效果更好;但氢气量过大时,会增加能耗。综合考虑,DMS 加氢制备BDO适宜的氢酯比为150。
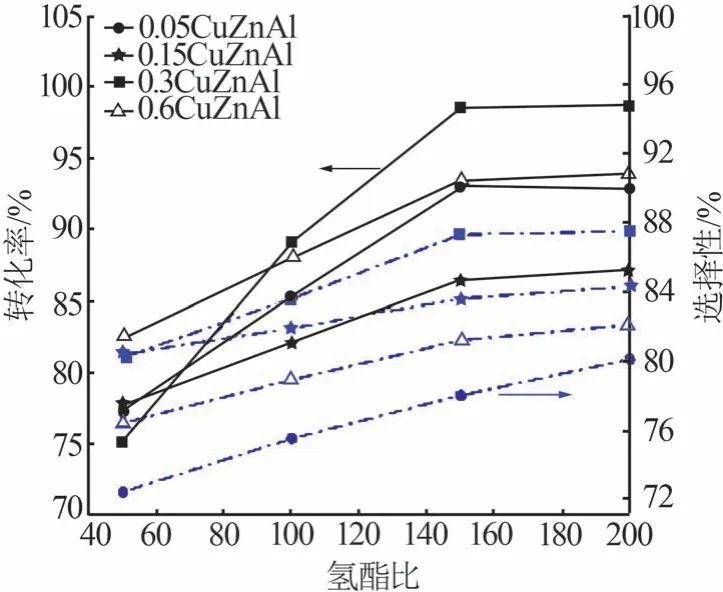
图7 不同氢酯比对DMS加氢反应的影响Fig.7 Effects of different hydrogen-ester ratios on DMS hydrogenation reaction
3.4 液时空速的影响
在反应温度为185 ℃、反应压力为5 MPa、氢酯比为150 条件下,不同液时空速对丁二酸二甲酯加氢的影响结果如图8所示。由图8可知,当液时空速由0.5 h-1增大到1 h-1时,4种催化剂的选择性和转化率变化较小;而当液时空速由1 h-1增大到3 h-1时,DMS 转化率急剧降低,BDO 选择性也有一定下降,其中,0.3CuZnAl催化剂的转化率由98.6%迅速降至91.0%左右。这可能是由于液时空速过大会直接减少丁二酸二甲酯和氢气与催化剂的接触时间,部分原料还未来得及反应就已经离开床层,从而导致转化率和选择性均下降;但空速过小会造成较大的经济损失。因此,该催化剂催化DMS加氢制备BDO适宜的液时空速为1 h-1。
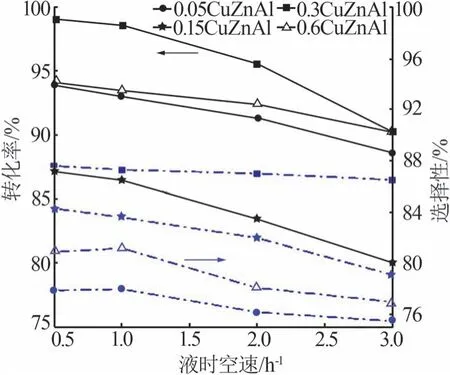
图8 不同液时空速对DMS加氢反应的影响Fig.8 Effect of different liquid space-time velocities on DMS hydrogenation reaction
通过对DMS加氢工艺的优化,可得到DMS加氢制备BDO较优的工艺条件为:反应温度为185 ℃、反应压力为5 MPa、氢酯比为150、液时空速为1 h-1;此时,Cu质量分数为20%、锌铝比为0.3的加氢催化剂表现出最佳的催化性能,丁二酸二甲酯转化率为98.6%、BDO选择性为87.3%。
3.5 催化剂的稳定性考察
通过对催化剂的筛选及工艺条件的优化,选取0.3CuZnAl 催化剂为丁二酸二甲酯加氢反应的最优催化剂,并在最优工艺条件下进行稳定性考察,结果如图9 所示。由图9 可知,该催化剂在反应温度为185 ℃、反应压力为5 MPa、氢酯比为150、液时空速为1 h-1的条件下,连续运转1 000 h,DMS 转化率(>97.5%)和BDO选择性(>87.2%)波动较小。
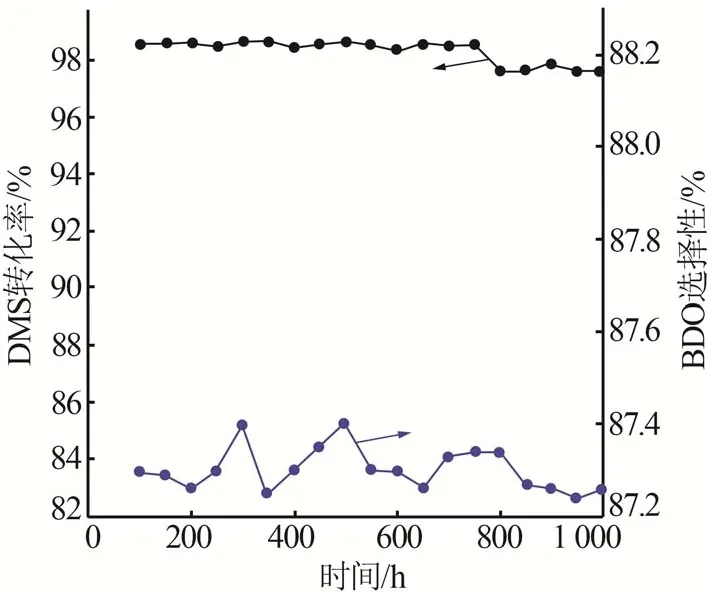
图9 0.3CuZnAl催化剂稳定性考察Fig.9 Stability of 0.3CuZnAl catalyst
3.6 与其他催化剂催化效果对比
由于目前对DMS催化加氢制BDO的研究较少,因此,另选取了研究较多且与研究反应物结构相似的丁二酸(SA)和丁二酸二乙酯(DES)催化加氢反应催化剂作参考进行对比,结果见表4。由表4可以看出,本文中催化剂催化加氢稳定性强,且转化率(>97.5%)和选择性(>87.2%)较高,具有优良的工业价值。
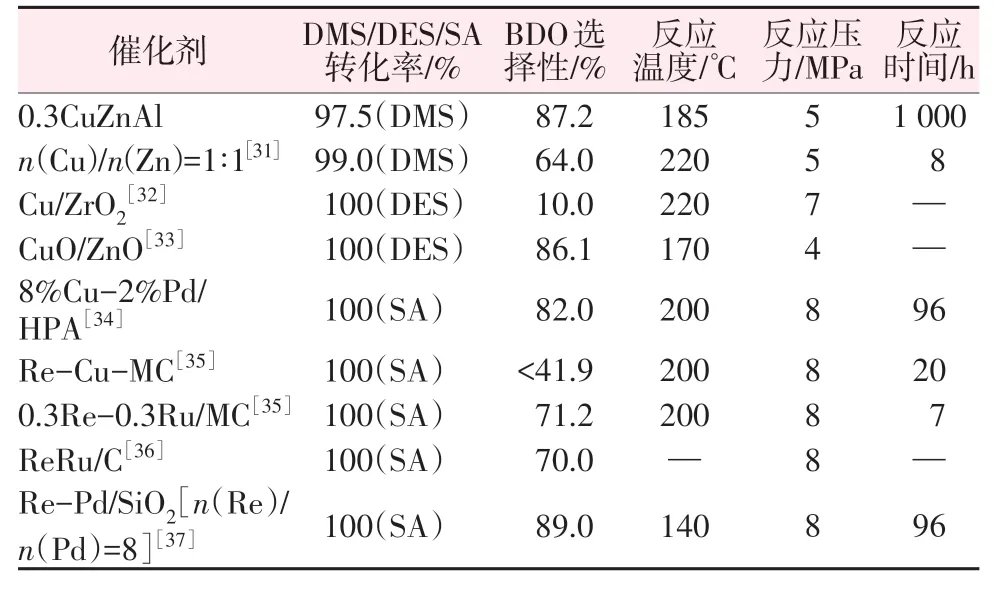
表4 DMS/DES/SA催化加氢反应制BDO所用催化剂Table 4 Catalysts used in catalytic hydrogenation of DMS/DES/SA to produce BDO
4 结论
通过共沉淀法制备了系列Cu-Zn-Al催化剂,对催化剂进行表征,研究了铜锌铝金属负载量对丁二酸二甲酯加氢催化剂的比表面积、表面酸性位和表面元素的影响,并在固定床反应器上进行工艺条件及稳定性考察。
表征结果证明所制得催化剂中,铜的质量分数为20%、锌铝比为0.3 时,催化剂比表面积较大,较易被还原且表面酸性位强度及数量较低,可有效提高DMS 转化率。另外,经XPS 分析,该催化剂活性组分在载体表面分散均匀,还原态Cu0的比例高、Cu2+比例最低,表明其易被还原,这在H2-TPR结果中得到印证。载体表面的还原态物种能与反应物在活性位点充分接触,提高反应活性和催化加氢效率。
将制得的系列铜基催化剂在固定床反应器上进行催化DMS 加氢工艺评价,结果表明0.3CuZnAl 催化剂催化效果较好,与表征结果一致。经对工艺条件的考察可知,该催化剂在反应温度为185 ℃、反应压力为5 MPa、氢酯比为150、液时空速为1 h-1条件下,丁二酸二甲酯转化率为98.6%、BDO 选择性为87.3%。对0.3CuZnAl 催化剂进行稳定性测试结果可知,在固定床反应器上连续运行1 000 h,丁二酸二甲酯转化率(>97.5%)和选择性(>87.2%)波动较小,具有良好的工业化前景。
