石灰石干法制备高性能氢氧化钙的工艺及应用研究
2023-10-19邢佳斌马亚丽贾松岩
刘 越,郑 强,邢佳斌,邢 润,马亚丽,贾松岩,李 雪
(1.沈阳化工大学化学工程学院,辽宁沈阳 110142;2.辽宁省镁钙无机功能材料工程研究中心,辽宁沈阳 110142;3.辽宁省化工应用技术重点实验室,辽宁沈阳 110142)
氢氧化钙是非常重要的化工原料,由于自身的碱性、抗菌作用及对CO2、SO2的吸附作用等特性可广泛用于建筑、食品、医药、塑料、造纸、石油添加剂等行业,是当前常用的吸附剂与烟气处理材料[1-2]。干法和半干法脱硫技术在现代化工行业中的应用逐渐成熟,氢氧化钙作为脱硫吸附剂,其性能直接决定脱硫效果。工业上制备氢氧化钙常以生石灰(CaO)为原料,通过干法或湿法工艺获得不同性能的Ca(OH)2产品。干法消化工艺是将生石灰投放到消化器中与定量的水相互作用而进行消化反应,此反应为放热反应,随着反应的进行温度逐渐升高,对制备得到的Ca(OH)2产品可以起到烘干作用,又因为干法消化时加入的水量较少,所以最后制得的Ca(OH)2产品无需脱水烘干处理就可以直接封装销售。干法消化反应过程中组织结构发生变化使Ca(OH)2形成质地疏松的粉末,体积增大为原体积的1.5~2.0 倍,产物和原料流动性较好,所以干法消化工艺可以在水灰比(水与石灰质量比)较低的条件下实现生石灰的高转化率反应。近年来针对干法的研究越来越多,在闫东杰等[3]的研究中,通过加入醇类混合溶液,在50~70 ℃条件下制备出高比表面积氢氧化钙(41.56 m2/g);严雯莉等[4]在研究中指出干法消化制备氢氧化钙转化率更高,且比表面积大、性能稳定;王海名[5]通过改变添加助剂种类和水灰比生产出高性能氢氧化钙。虽然目前国内较少采用干法消化工艺,但该工艺投资少、改造周期短、工艺操作简单、处理效果好,且制得的高活性氢氧化钙具有高比表面积、高孔容、高有效钙含量的物性特点及高效的酸性污染物捕捉能力,因此选择高活性氢氧化钙干法脱硫作为烟气脱硫工艺是近年来研究和生产利用的重点[6]。此外,研究表明:干法消化制备的氢氧化钙,相比湿法消化产品具备丰富的孔隙结构和高脱硫活性,能有效避免湿法消化工艺造成的水和热量的损失,工艺简单环保[7]。目前,中国氢氧化钙行业发展较快,但相比于国外发达国家和地区,中国氢氧化钙产业的发展仍有较大差距[8]。目前,国内干法制备氢氧化钙的原料水化率较低,且产品比表面积不高,为了提高石灰石干法制备氢氧化钙产品的原料水化率和比表面积,增大其吸附效率,从而生产出高活性氢氧化钙,研究人员针对氢氧化钙做了大量研究工作[9-11]。本文提出通过控制水灰比、反应时间、反应温度及加入添加剂和改变消化方式来制备高性能氢氧化钙,旨在为综合利用石灰石制备高性能氢氧化钙提供理论与技术支持。
1 实验部分
1.1 实验试剂与仪器
实验试剂:石灰石,成分分析见表1;聚乙二醇400(PEG400)、氢氧化钠、无水乙醇、盐酸、蔗糖,均为分析纯(AR)。
实验仪器:QE-200 型粉碎机;DF-101S 型集热式恒温加热磁力搅拌器;YP10002型电子天平;SXL型程控箱式马弗炉;DELSA440SX 型粒度分析仪;WSB-2 型白度计;SU8010 型扫描电子显微镜;D8-Focus 型X 射线衍射仪;Vertex 70v 型傅里叶变换红外光谱仪;ASAP-2460 型全自动比表面积分析仪;TG-DTA8122 型热重差热分析仪;722N 型紫外可见分光光度计。
1.2 实验制备流程
实验流程:将石灰石用粉碎机破碎后送入电阻炉中在一定温度下煅烧,取煅烧后的生石灰放入反应釜中,加入一定量的水和添加剂,在一定条件下搅拌反应得到氢氧化钙产品。
反应方程式如下:
1.3 样品的表征
TG-DTG:采用热重差热分析仪测定原料热性能。
XRD:采用X射线衍射仪检测产物的物相组成,检测条件为Cu靶、扫描范围为5°~90°。
FT-IR:采用傅里叶变换红外光谱仪将成品氢氧化钙用KBr压片法压片,波数为500~4 000 cm-1。
扫描电镜(SEM):采用扫描电子显微镜检测样品的形貌及分散程度。
比表面积(BET)、气孔容量:采用全自动比表面积分析仪检测样品比表面积及气孔容量。
氧化钙水化率:将干燥后的氢氧化钙在700 ℃煅烧3 h,使氢氧化钙完全分解,水化率的计算公式见式(3)。
式中:ω1为水化率,%;m1为水化产物干燥后煅烧前质量,g;m2为水化产物煅烧后质量,g。
Ca(OH)2纯度:根据HG/T 4120—2009《工业氢氧化钙》规定的工业氢氧化钙含量测定方法表征产物氢氧化钙含量,采用蔗糖与Ca(OH)2反应生成蔗糖钙,以酚酞为指示剂,利用盐酸溶液滴定至无色后计算Ca(OH)2含量(ω2)。
式中:c为盐酸标准滴定溶液浓度,mol/L;V为实验溶液所消耗的盐酸体积,mL;V0为空白溶液消耗盐酸体积,mL;m为试样的质量,g;M为氢氧化钙摩尔质量,74.1 g/mol。
2 结果与讨论
2.1 石灰石的热重分析
为了研究石灰石煅烧分解情况,将原料石灰石进行热重(TG-DTG)测试,结果如图1所示。
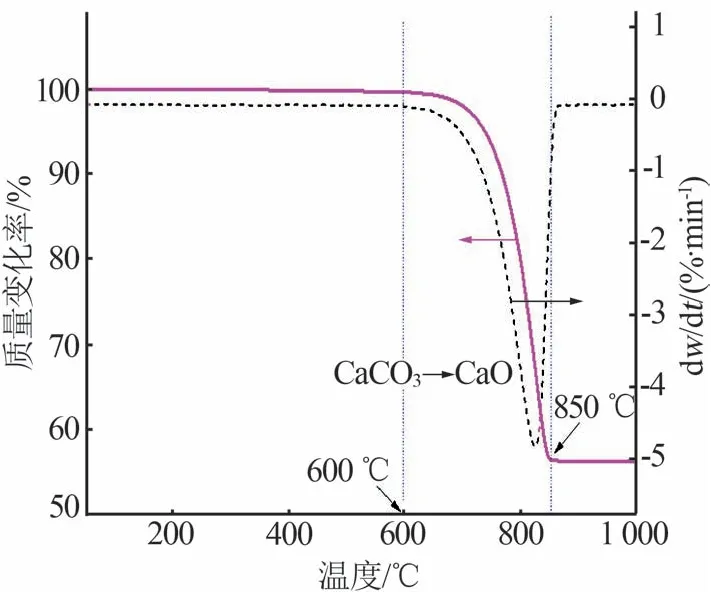
图1 石灰石的热重曲线Fig.1 Thermogravimetric curve of limestone
石灰石受热分解时的煅烧温度、煅烧时间会影响产物氧化钙的含量及活性[12]。根据图1的热重分析可知,石灰石的热分解温度段为600~850 ℃,在850 ℃分解完全,因此实验选择在850 ℃煅烧。在一定的煅烧温度下随着煅烧时间的延长石灰石逐渐分解,为了探究石灰石充分分解的时间,实验选取了30、40、50、60、70、80、90、100、110、120 min 10 个煅烧时间进行石灰石煅烧实验,实验结果如表2所示。由表2 可以看出,随着煅烧时间的延长石灰石的质量损失率逐渐增加,当煅烧时间为80 min 时质量损失率为42.84%,之后质量损失率趋于平稳,说明此时石灰石接近完全分解。在石灰石煅烧分解过程中,二氧化碳气体不断释放出来,生成的CaO颗粒呈疏散多孔状,过长的煅烧时间容易造成CaO过烧,因此实验选择煅烧时间为80 min。
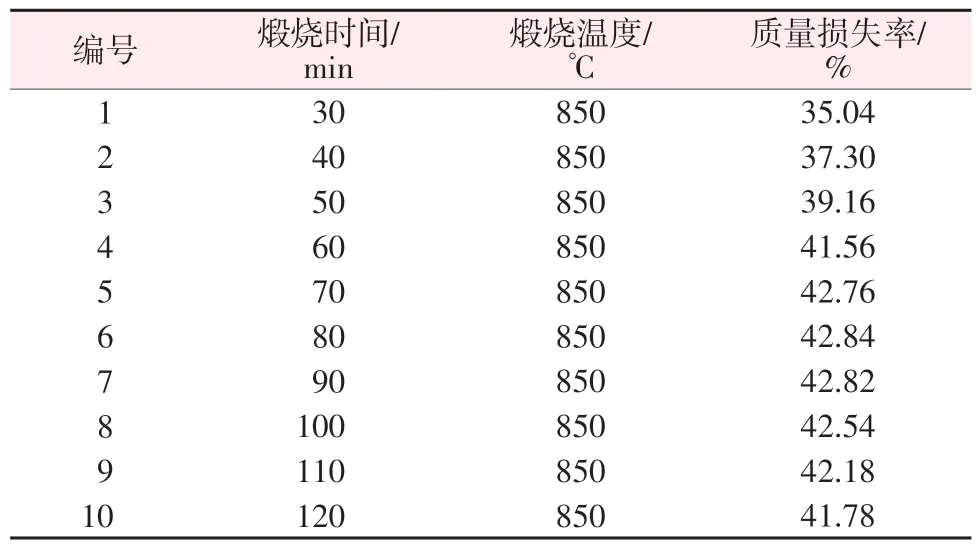
表2 不同煅烧时间下石灰石质量损失率的变化Table 2 Changes in limestone weight loss rate at different calcination times
2.2 生石灰的活性分析
高活性的生石灰才能制备出高性能的氢氧化钙。根据YB/T 105—2014《冶金石灰物理检验方法》,测定850 ℃条件下不同煅烧时间制备的生石灰的活性。称取粒度为1~5 mm的生石灰50 g,将生石灰倒入2 L、40 ℃水中消化,用4 mol/L 盐酸滴定,以10 min内盐酸的消耗量表示生石灰的活性度,测试结果如图2所示。由图2可知,随着煅烧时间的延长生石灰的活性也逐渐升高,但是当煅烧时间延长至90 min 时CaO 的活性度出现了降低,这是因为石灰石的煅烧是内部晶格发生变化的过程,石灰石在850 ℃下煅烧,CaCO3微粒被破坏分解,同时产生二氧化碳气体,因此得到的CaO晶体会形成疏散结构,此时的晶体发育不完全,存在着大量缺陷,使得生石灰活性最大,但随着煅烧时间的延长,晶体会逐渐发育完全,使活性氧化钙转向非活性氧化钙,导致生石灰活性降低,因此为保证生石灰的活性,实验选择的煅烧温度为850 ℃、煅烧时间为80 min,此时的生石灰活性度最高可达到404 mL。

图2 生石灰活性变化Fig.2 Change of quicklime activity
2.3 氢氧化钙的XRD分析
分别选取在水灰比为0.5、温度为40 ℃、反应时间为40 min条件下制得的无添加剂氢氧化钙和添加PEG400 氢氧化钙样品进行XRD 测试,并与氢氧化钙标准谱图(PDF#76-0571)对比,结果如图3所示。
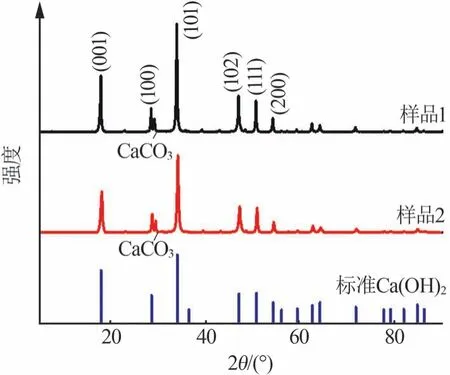
图3 不同氢氧化钙样品的XRD谱图Fig.3 XRD patterns of different calcium hydroxide samples
由图3可知,2个样品的X射线衍射峰与标准谱图相符,说明样品均是氢氧化钙,对应的晶型特征衍射峰分别是(001)(100)(101)(102)(111)(200),其中在29.4°处出现了碳酸钙(PDF#47-1743)特征衍射峰[13],此处的少量碳酸钙是因为在反应过程中有部分氢氧化钙与空气中的CO2反应所致[14]。
2.4 氢氧化钙产品表征分析
2.4.1 水灰比对氢氧化钙指标的影响
为了研究水灰比对氢氧化钙产品指标的影响,控制变量为水灰比(0.3、0.4、0.5、0.6、0.7),在25 ℃下反应20 min,结果如表3 所示。由表3 可见,随着水灰比升高,水化率及纯度先增大后小幅度回落。在水灰比为0.3时,反应生成的氢氧化钙纯度较低,仅能达到67.31%,此时比表面积也较小仅为16.54 m²/g;随着水灰比的增大,水化率及纯度随之增大,在水灰比为0.5 时,水化率达到81.13%,说明此时有较多的氧化钙水化转化为氢氧化钙,此时制得的氢氧化钙比表面积达到33.48 m²/g、气孔容量为0.117 cm3/g;继续增大水灰比到0.6 时,氢氧化钙纯度并没有继续升高,相反纯度较水灰比为0.5时有所回落,这是因为在反应过程中,水灰比过大会出现结块现象,导致生石灰内部无法均匀反应,部分生石灰未转化成氢氧化钙;当水灰比超过0.6后在反应过程中出现大量结块现象,生石灰团聚在一起,形成不同大小的球状颗粒,不利于生石灰消化制备氢氧化钙。因此,干法制备氢氧化钙水灰比不宜过高,保证生石灰与水能充分接触反应即可[15]。
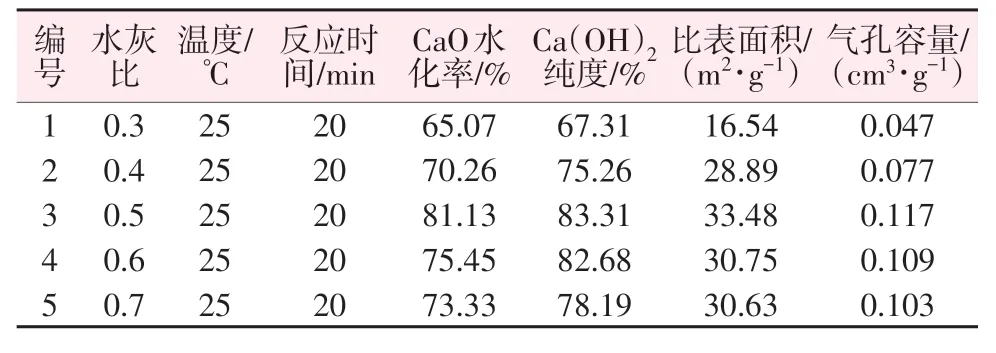
表3 水灰比对氢氧化钙指标的影响Table 3 Effect of water-cement ratio on calcium hydroxide indexes
图4 为不同水灰比制得的氢氧化钙的SEM 图。由图4 可看出,增大水灰比对氢氧化钙的均匀性和分散性起到一定促进作用。当水灰比为0.3 时(图4a)氢氧化钙颗粒由细小的微粒团聚在一起,平均粒径为10 μm 左右,因为氧化钙与水反应在瞬间放出大量的热,当水灰比较小时,反应体系内产生的热量无法均匀分散,导致反应生成的氢氧化钙包裹在氧化钙表面,使得部分氧化钙无法继续消化,从而得到的氢氧化钙颗粒较大且比表面积偏小;当水灰比增大后,满足了生石灰完全消化所需要的水量,当水灰比为0.4时(图4b),形成的细小颗粒明显多于图4a,说明水量的增加有助于更多的氧化钙能充分反应;当水灰比为0.5 时(图4c)形成更多的小颗粒,平均粒径约为4 μm,说明此时氧化钙和水反应得更加充分,团聚现象减少;当水灰比继续增大至0.6时,氢氧化钙颗粒开始出现团聚现象,部分小颗粒堆叠形成大颗粒(图4d);当水灰比增加到0.7时(图4e),更多的氢氧化钙颗粒团聚在一起。综上分析,在水灰比为0.5时,形成的氢氧化钙分散性最好,且结合前面的结论,此时的纯度和水化率最高且比表面积较大。综合考虑,为生成高质量且疏松、分布均匀的氢氧化钙,实验选择水灰比为0.5。

图4 不同水灰比制得的氢氧化钙样品的SEM图Fig.4 SEM images of calcium hydroxide samples prepared by different water-cement ratios
2.4.2 反应时间对氢氧化钙指标的影响
为了研究反应时间对氢氧化钙指标的影响,设定反应时间为20~90 min,每次间隔10 min,在水灰比为0.5、反应温度为25 ℃下反应制备氢氧化钙,实验结果如表4所示。由表4可以看出,随着反应时间的延长,水化率和纯度增大趋势较为平缓,当反应时间从20 min 延长至90 min 时,水化率维持在82%左右、纯度约为84%、比表面积为33.06~35.35 m2/g,从以上几个参数可看出氢氧化钙各项指标变化并不明显,说明反应时间对氢氧化钙的指标影响并不明显。在40 min时水化率为82.69%,此时的石灰和水充分混合已反应完全,40 min 后氢氧化钙各项指标趋于平稳,因此选取最优的反应时间为40 min。

表4 反应时间对氢氧化钙指标的影响Table 4 Effect of reaction time on calcium hydroxide index
图5 为不同反应时间制备的氢氧化钙的SEM图。由图5 可看出,延长反应时间后制得的氢氧化钙表面会有细小的颗粒生成,但生成的颗粒较少,因为在反应过程中水灰比固定,反应的水量相同,当反应时间延长时对氢氧化钙的影响较小,因此氢氧化钙形貌并未发生显著变化。
2.4.3 反应温度对氢氧化钙指标的影响
为了研究反应温度对氢氧化钙指标的影响,控制变量为反应温度(25、30、40、50、60、70 ℃),在水灰比为0.5、反应时间为40 min条件下进行氧化钙的水化,考察水化率、纯度及比表面积和气孔容量的变化,结果如表5所示。由表5可以看出,随着反应温度的升高氢氧化钙各项指标均显著提升。当反应温度从25 ℃升高到40 ℃时,水化率从82.69%增大至92.81%;此时制得的氢氧化钙纯度也最高为92.21%;氢氧化钙的比表面积也增加到最大值为41.91 m2/g。温度继续升高后氢氧化钙的纯度有所降低,比表面积也同时减小,这是因为当温度过高时会导致氢氧化钙晶体生长速度过快并产生结块,形成颗粒较大、比表面积较小、消化不完全的氢氧化钙,且不利于消化装置的运行。因此,结合实际考虑,选取较优的反应温度为40 ℃。
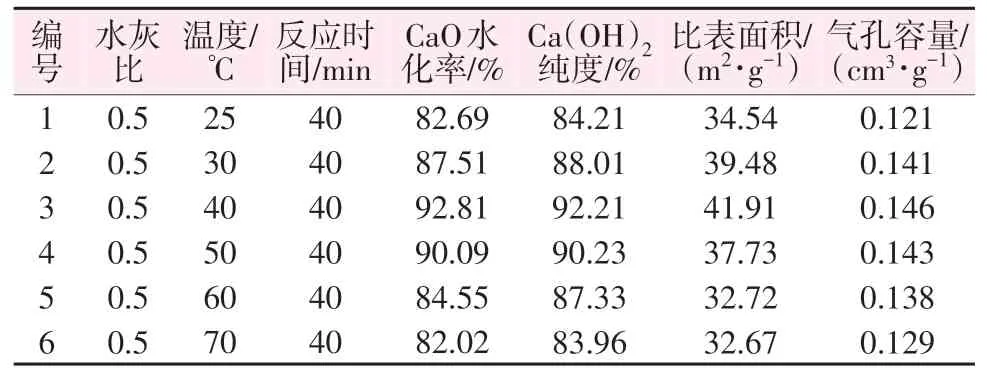
表5 反应温度对氢氧化钙指标的影响Table 5 Effect of reaction temperature on calcium hydroxide index
图6为不同反应温度下制备的氢氧化钙的SEM图。由图6可看出,在反应温度为25 ℃时(图6a)氢氧化钙颗粒处于团聚状态,此时温度较低,即使反应会放出大量的热也不足以提供水化反应所需的热量,导致反应缓慢,颗粒生长不完全,使氢氧化钙颗粒更多地团聚在一起;随着反应温度的升高,放出的热量也随之增加,在30 ℃和40 ℃时(图6b 和6c)氧化钙的消化速率加快,反应也更为彻底,产物的颗粒粒度逐渐减小,且生成的小尺寸颗粒增多;在后续温度升高至60 ℃时(图6e)得到的氢氧化钙团聚较为明显,说明此时氢氧化钙在高温下快速生长形成团聚。因此,为了既能给反应提供足够的热量,又能得到最高性能的氢氧化钙,选取在40 ℃下进行反应。

图6 不同温度制得的氢氧化钙晶体的SEM图Fig.6 SEM images of calcium hydroxide crystals prepared at different temperatures
2.4.4 添加剂及消化方式对氢氧化钙指标的影响
氢氧化钙是一种极性化合物,因此不易溶于有机化合物。利用这种性质在反应过程中添加一定量的有机化合物,有机化合物附着在氢氧化钙表面,使制备的氢氧化钙更稳定、更有利于分散成粒径较小、比表面积较大的产品。为了研究添加剂对氢氧化钙指标的影响,在水灰比为0.5、反应温度为40 ℃、反应时间为40 min 条件下加入PEG400 进行水化实验,实验结果如表6所示。由表6看出,未加入添加剂时的氢氧化钙(1#)水化率为92.81%、比表面积为41.91 m²/g、气孔容量为0.146 cm³/g;在相同反应条件下加入5%(质量分数,下同)PEG400 后(5#)比表面积增加至47.72 m²/g、水化率增加至94.97%,说明PEG400 的加入对优化氢氧化钙指标起到了显著作用,且能促进氧化钙的水化,这是因为PEG400的加入作为一种分散剂能使分子内部存在的大量羟基(—OH)附着在氢氧化钙表面,同时产生足够大的静电斥力,防止生成产物间的相互聚集,PEG400 与氢氧化钙形成牢固的氢键结合[16-17],从而形成颗粒较小、比表面积大、分散均匀的氢氧化钙。由表6还可以看出,未加入添加剂时1次消化后的氢氧化钙(1#)比表面积为41.91 m²/g,当进行2次消化后(6#)比表面积增大到43.69 m²/g;1次消化时加入5%PEG400的氢氧化钙(5#)比表面积为47.72 m²/g,当加入5%PEG400 时进行2 次消化后(10#)比表面积增大至50.81 m²/g。由此可看出改变消化方式对提升氢氧化钙的性能指标有着显著的影响,这是因为在1 次消化后仍有部分氧化钙未反应,再次进行消化时可使未反应的氧化钙再次进行反应,在不断反应过程中水和添加剂作为一种分散物质,会使氢氧化钙变成更小的颗粒,且分散均匀有利于多孔道的形成,比表面积在此作用下增大。在此基础上,为了使添加剂能够更加充分地与氧化钙进行反应,本实验设计3次消化实验。添加2%PEG400、3次消化制备的氢氧化钙(11#)比表面积能达到48.42 m²/g,此时与9#样品的性能接近,说明改变消化方式可以减少添加剂的用量,节约成本;在3次消化时添加4%PEG400制备的氢氧化钙(12#)比表面积可增大至52.62 m²/g、水化率为95.28%、纯度为93.91%、气孔容量为0.163 cm³/g。
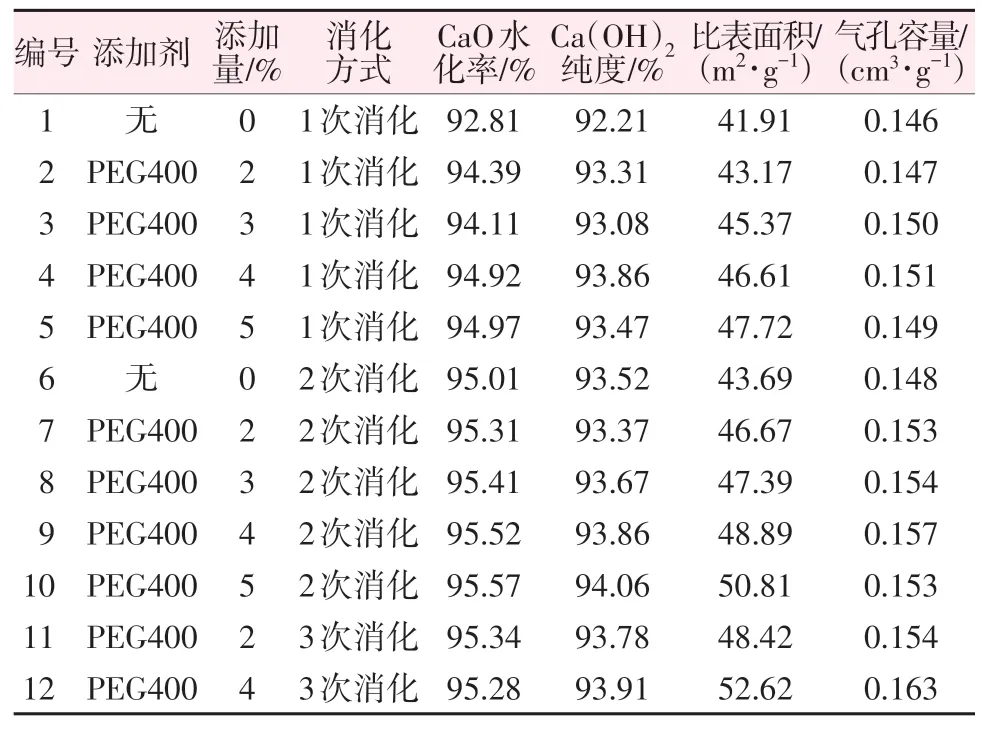
表6 添加剂及消化方式对氢氧化钙指标的影响Table 6 Effects of additive and digestion method on indexes of calcium hydroxide
2.5 氢氧化钙的FT-IR分析
图7 分别是在水灰比为0.5、温度为40 ℃、反应时间为40 min 时无添加剂和添加PEG400生成的氢氧化钙的FT-IR 谱图。从图7 可看出,两个样品均在872、1 475 cm-1处出现明显吸收峰,此处为氢氧化钙特征峰。两个样品在1 643 cm-1处出现碳酸钙特征峰,这是因为在消化过程中少量氢氧化钙与CO2反应生成碳酸钙所致,与图3氢氧化钙的XRD 谱图中有碳酸钙衍射峰相符。对比无添加剂和添加PEG400 制得的氢氧化钙红外谱图可以看出,添加PEG400 后在1 086 cm-1处出现圆而钝的吸收峰,此处是因为PEG400 的加入产生醇类化合物C—O 的特征吸收峰,该特征峰能说明在添加PEG400 制备Ca(OH)2的实验中,PEG400已经附着在Ca(OH)2颗粒上。
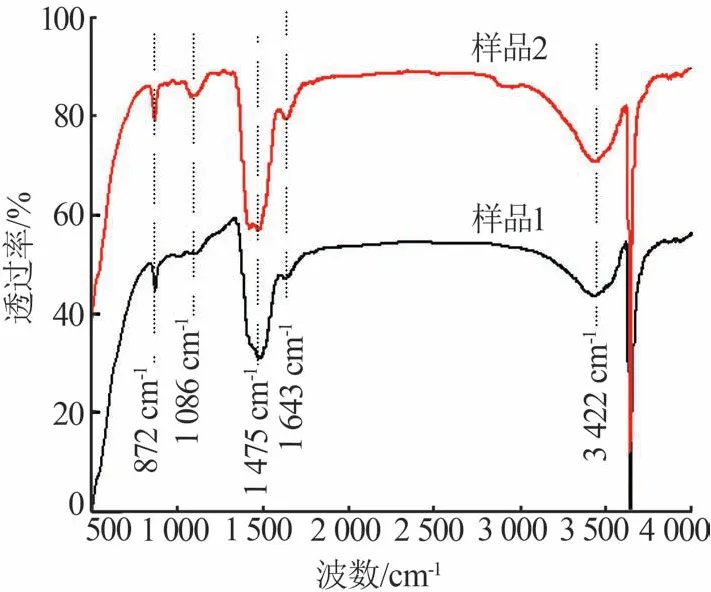
图7 无添加剂与添加PEG400氢氧化钙FT-IR谱图Fig.7 FT-IR spectra of calcium hydroxides without additive and with PEG400
2.6 产品的应用模拟
氢氧化钙溶液的腐蚀性较小且为碱性,因此能够很好地中和酸性废水,也可以在调和酸碱度的同时让其中金属离子析出。某些行业的工业废水酸性较强直接排放会引起环境污染,氢氧化钙作为化学吸附剂可以中和废水,对废水中的有害物质进行吸附。为了模拟氢氧化钙对污水的处理情况,本实验设计用甲基橙溶液模拟废水,检测相同条件下不同氢氧化钙样品对甲基橙的吸收量,用紫外分光光度计检测吸收甲基橙前后溶液吸光度的变化,结果如图8所示。由图8可看出,在加入氢氧化钙后甲基橙溶液的吸光度发生明显变化,说明氢氧化钙的加入对甲基橙产生了吸收作用。通过计算得到不同氢氧化钙吸收率,如图9所示。由图9可看出,加入添加剂PEG400 后制备的氢氧化钙吸收率达到50.54%,市售样品的吸收率为28.52%,说明实验室制备的氢氧化钙具备更好的吸附性,这是因为加入添加剂后制备的氢氧化钙具备多孔道、颗粒小、粒度均匀、吸收性能更好的特性,因此更有利于其吸收有害杂质。

图8 不同氢氧化钙的紫外吸收光谱Fig.8 UV-Vis absorption spectra of different calcium hydroxides

图9 不同氢氧化钙吸收率Fig.9 Absorption rates of different calcium hydroxides
2.7 产品质量
按企业标准Q/Q/YZKJ1 0204—2022《环境除尘烟气粒状脱硫剂GS-LDR-01》对实验制得的样品进行各项指标测定,结果如表7所示。

表7 氢氧化钙样品技术指标Table 7 Technical indicators of calcium hydroxide samples
理论研究中王海名等[5]在80~90 ℃高温条件下制备出高活性氢氧化钙;闫东杰等[3]报道的制备工艺是添加多种醇类混合物对氢氧化钙进行性能提升,使氢氧化钙的比表面积可以达到41.56 m2/g,但是高温消化在生产中会增加生产能耗,混合多元醇会导致成本增加。本研究在更改消化方式和仅使用少量添加剂的条件下使得石灰消化可以在40 ℃下生产出高活性的氢氧化钙,不仅能够减少能源消耗而且在性能上能够优于其他研究产品。由表7可以看出,本研究制得的氢氧化钙产品各项指标均达到或优于企业标准,有望替代市场同类产品,且为企业高值利用石灰石提供一定的理论基础。
3 结论
本文利用石灰石矿为原料制备高性能氢氧化钙,研究了石灰石煅烧条件及消化反应水灰比、反应时间、反应温度、添加助剂、消化方式等因素对水化率、比表面积、纯度及气孔容量的影响,得到以下结论:1)石灰石煅烧优化工艺条件为煅烧温度为850 ℃、煅烧时间为80 min,此时煅烧后的生石灰活性度可达404 mL;消化反应优化工艺条件为水灰比为0.5、反应时间为40 min、反应温度为40 ℃、添加4%(质量分数)PEG400、3 次消化,在此条件下制备的氢氧化钙性能最优。2)在优化的煅烧和消化工艺条件下制备得到的产品氢氧化钙性能最优,其中水化率为95.28%、纯度为93.91%、比表面积为52.62 m²/g、气孔容量为0.163 cm³/g。3)优化工艺条件下制备的氢氧化钙对甲基橙吸收率达到50.54%,远高于市售氢氧化钙的吸收率(28.52%);制备的氢氧化钙产品指标均达到或超过市场优质产品,有望替代市场同类产品,为石灰石通过多段消化制备氢氧化钙提供了新思路。
