铝酸钙飞灰中钾的回收利用工艺研究
2023-10-19杨红军戈海文乔友民乔子洋
杨红军,王 敏,戈海文,乔友民,乔子洋
(1.中国科学院青海盐湖研究所,青海西宁 810008;2.中国科学院盐湖资源综合高效利用重点实验室,青海西宁 810008;3.青海省盐湖资源化学重点实验室,青海西宁 810008;4.河南亿水源净水材料科技有限公司,河南焦作 454450)
钾是植物三大营养元素之一,可提高作物产量和品质。中国是农业大国,同时又是极度缺钾的国家,中国钾资源储量只有全球储量的2%左右[1]。中国已探明的钾资源以卤水型液体资源为主,钾肥产品主要是氯化钾和硫酸钾,目前,中国钾肥自给率为50%左右[2-3],每年仍需进口大量钾肥。在有色金属冶炼[4-6]、水泥生产[7-8]、城市垃圾焚烧发电[9-14]及其他生产[15]等过程中产生大量的飞灰,飞灰中含有Na+、K+、Cl-等可溶性组分,根据飞灰来源不同,其中K+质量分数为5%~25%[4-11,14]。由于每年产生飞灰总量巨大,因此飞灰可视为潜在的钾资源加以利用,生产钾盐产品满足工农业生产需要。文献[4-8,14]分别对炼钢烧结灰、水泥窑灰等飞灰制备氯化钾或硫酸钾等钾盐的工艺进行了研究,获得了较优的工艺参数。由于各种飞灰矿物组成及特点不同,目前,利用飞灰一般可直接生产氯化钾,如需生产硫酸钾则需添加化学试剂经化学反应转化氯化钾得到。
铝酸钙是一种净水剂的前驱体,由铝土矿与石灰石经高温煅烧得到,在生产铝酸钙过程中副产飞灰,通常这种飞灰被作为固体废弃物处理。据估算每生产100 t 铝酸钙可得到约1 t 飞灰,铝酸钙飞灰中含有一定量的钾、硫、氯等水溶性组分且钾的含量较高,目前已有的文献尚缺乏对回收飞灰中钾联产氯化钾和硫酸钾的报道。本文以铝酸钙飞灰为原料,对综合回收飞灰中的钾、硫、氯等资源联产硫酸钾和氯化钾的工艺进行探究,较系统地研究了加水量、时间、蒸发水量等因素的优化工艺条件,获得了完整的工艺流程及优化参数。回收铝酸钙飞灰中的钾联产硫酸钾和氯化钾,使固体废弃物得到资源化利用,且不需添加其他化学试剂,具有绿色、环保优势,可为飞灰中钾、硫、氯等资源的综合利用提供指导。
1 材料与方法
1.1 材料
飞灰取自河南某铝酸钙生产企业,飞灰样品为灰白色、无明显气味、粉末状固体,将取回的飞灰混合均匀备用。本实验使用的化学试剂有四苯硼钠(C24H20BNa)、十六烷基三甲基溴化铵(C19H42BrN)、硝酸汞[Hg(NO3)2·H2O]、氯化钡(BaCl2·H2O)、乙酸(CH3COOH)、乙酸钠(CH3COONa)、硝酸银(AgNO3)、盐酸(6 mol/L HCl)、溴酚蓝(C19H10O5SBr4)、二苯偶氮碳酰肼(C13H12ON4)、乙醇(C2H5OH),均为分析纯;溶浸实验用水为自来水;实验用水为双重去离子水,电导率为0.055 μS/cm。
1.2 飞灰溶浸
理论分析:根据飞灰主要水溶性组成,分别以Na+,K+∥Cl-,SO42--H2O四元水盐体系100 ℃和25 ℃相图数据[16-17]为依据,对飞灰溶浸和蒸发过程的最小需水量、最大蒸发水量、蒸发析盐顺序及钾盐析出种类和数量进行理论分析;依据理论分析结果并结合实际条件,选择较优工艺路径。
热溶-蒸发-冷结晶工艺参数及优化:在溶浸工段以飞灰中钾的溶出率为指标,分别把溶浸工艺的液固质量比(简称液固比)、溶浸时间、溶浸次数等因素作为考察对象,通过单因素实验选取较优工艺参数;蒸发-冷结晶工段以结晶得到的钾产品的数量及品质为指标,以理论分析结果为依据,把蒸发水量因素作为考察对象,通过蒸发-冷结晶实验确定较优工艺参数。
可溶性实验:在90 ℃条件下,取一定量飞灰与淡水按比例混合并搅拌4 h后进行抽滤,固液分离后收集滤液并分析钾含量。
溶浸实验:在90 ℃条件下,取一定量飞灰与淡水按一定比例混合并搅拌一定时间后进行抽滤,固液分离后收集固渣和滤液,分析滤液中的钾含量,固渣和滤液分别进行下一次溶浸。
蒸发-冷结晶实验:取一定量滤液在90 ℃条件下进行蒸发,当蒸发失水量与理论计算值接近时停止蒸发,降温至25 ℃后固液分离,分别收集滤液和固相并进行分析。
1.3 化学分析方法[18]
K+分析采用四苯硼钠-季铵盐容量法;Cl-分析采用汞量法;SO42-分析采用重量法;Na+分析采用差减法。
1.4 物相分析
采用D8 Discover 型X 射线粉末衍射仪(XRD)对固相样品进行分析,仪器工作条件:Cu靶Kα辐射(λ=0.154 06 nm)、电压为40 kV、电流为40 mA、扫描角度(2θ)为5°~80°、扫描速率为5(°)/min。
2 结果与讨论
2.1 飞灰的可溶性组分和矿物组成分析
飞灰的主要化学组成分析和物相分析结果见表1和图1。由表1可知,该飞灰水溶性组分主要为K+、Cl-和SO42-等,另有少量Ca2+和Na+等,其中K+质量分数为23.52%,水可溶物与水不溶物的质量比接近1∶1。由图1可知,2θ为28.347 6°、40.509°、50.173 3°、58.624 2°、73.309 2°处的衍射峰对应KCl(PDF 卡号98-002-8938)的特征衍射峰;2θ为30.394 2°、31.460 9°、44.308 1°处的衍射峰对应钾芒硝(PDF卡号98-002-6018)的特征衍射峰;2θ为25.443 6°、31.460 9°、38.577 3°处的衍射峰对应CaSO4(PDF 卡号98-001-6382)的特征衍射峰;2θ为9.324°、19.186 1°、28.347 6°、31.460 9°、32.644 8°处的衍射峰对应钾石膏(PDF 卡号98-015-7072)的特征衍射峰。因此飞灰的主要矿物组成为氯化钾(KCl)、钾芒硝(Na2SO4·3K2SO4)、硬石膏(CaSO4)和钾石膏[K2Ca(SO4)2·H2O]等,其中氯化钾和钾芒硝均为水溶性,钾石膏微溶于水。
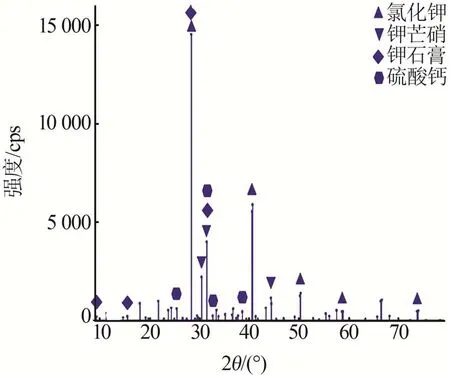
图1 飞灰样品的XRD谱图Fig.1 XRD pattern of fly ash sample

表1 飞灰样品主要化学组分Table 1 Main chemical compositions of fly ash sample %
2.2 理论分析
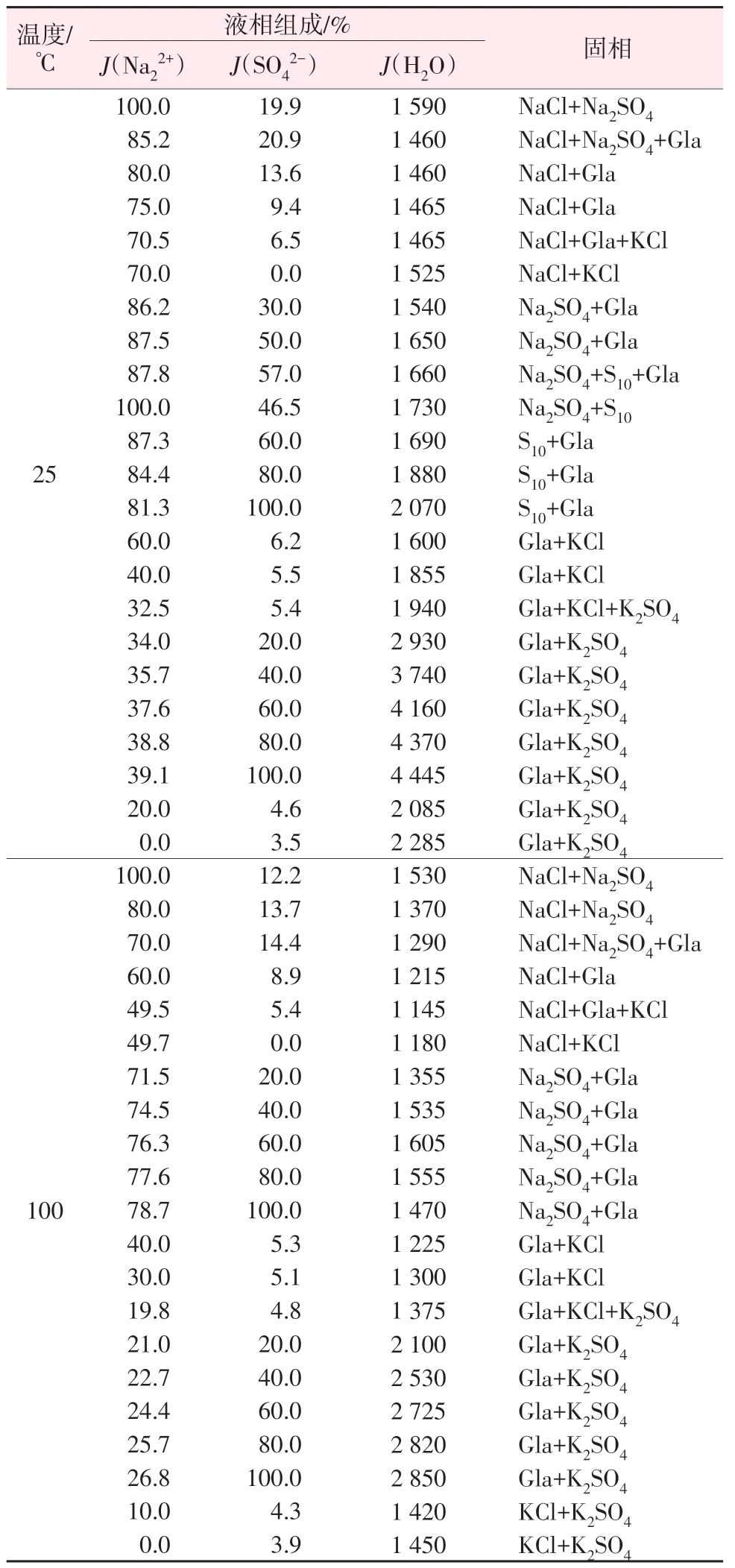
根据表1 可知,飞灰水溶性部分可简化为Na+,K+∥Cl-,SO42--H2O 四元水盐体系,根据该四元水盐体系100 ℃和25 ℃溶解度数据(见表2),把水溶性组成系统点在该体系100 ℃和25 ℃相图(干基)上进行标注,结果见图2(M点)。依据图2对铝酸钙飞灰中钾回收可能采用的工艺进行分析。
2--H2O四元水盐体系溶解度数据Table 2 Solubility data of Na+,K+∥Cl-,SO4表2 Na+,K+∥Cl-,SO42--H2O quaternary system
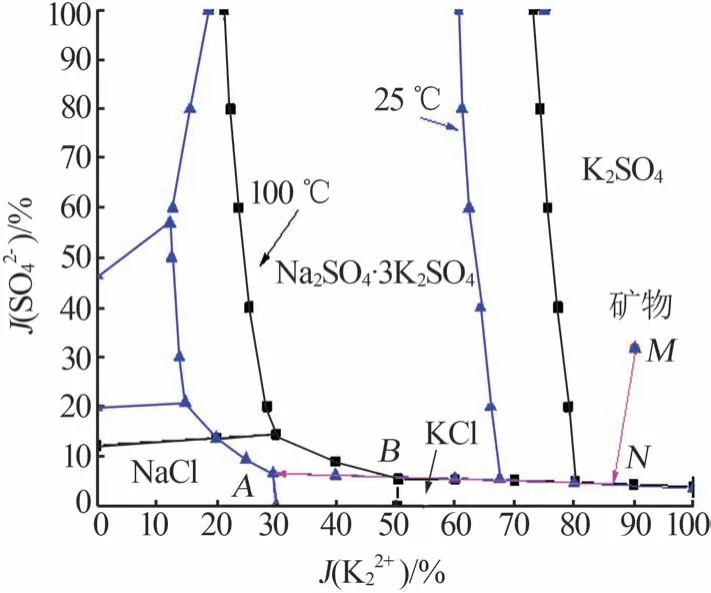
图2 矿物组成在相图(干基)上位置Fig.2 Site of composition on phase diagram(dry basis)
由图2可知,Na+,K+//Cl-,SO42--H2O四元水盐体系25 ℃相图(干基)包括硫酸钾(K2SO4)、氯化钾(KCl)、氯化钠(NaCl)、硫酸钠(Na2SO4)、芒硝(Na2SO4·10H2O)、钾芒硝(Na2SO4·3K2SO4)6 个结晶区;100 ℃相图(干基)包括硫酸钾、氯化钾、氯化钠、硫酸钠、钾芒硝5个结晶区;25 ℃条件下硫酸钾和氯化钾两种钾盐的结晶区比100 ℃时相应的结晶区大;飞灰水溶性部分组成系统点M均位于这两个温度下硫酸钾的结晶区,飞灰溶浸后的溶液经蒸发可依次析出硫酸钾、氯化钾和钾芒硝;与100 ℃相比,结晶温度为25 ℃可提高钾盐产量和钾的结晶收率。因此,可以设计钾的回收工艺路线为:飞灰与水混合以使钾从固相转移到液相中,对浸取得到的含钾溶液蒸发使硫酸钾饱和析出,控制蒸发节点,固液分离后得到纯净的硫酸钾;在25 ℃条件下母液继续蒸发,当液相组成达到A点时固液分离即可得到含大量氯化钾和少量钾芒硝的混合钾盐,如图2所示,在工艺流程中液相组成变化路径为M→N→A。根据温度条件不同,可分别采用热溶-蒸发-冷结晶工艺和常温溶浸-蒸发-结晶工艺。
2.2.1 热溶-蒸发-冷结晶工艺过程理论分析
根据图2,设定溶浸和第一阶段蒸发温度均为100 ℃、冷结晶及母液第二阶段蒸发温度均为25 ℃,以100.0 g 飞灰为原料对热溶-蒸发-冷结晶工艺过程中体系水量与析盐量等进行理论分析,结果如下。
1)溶浸加水量。把100.0 g 飞灰中的可溶物溶浸完全需水120.5 g(理论最小量),得到溶出液168.6 g,其中K+质量分数为13.95%。
2)第一阶段蒸发失水量及析盐量。把168.6 g溶出液蒸发失水38.4 g(理论最大量)后降温结晶,可得硫酸钾8.1 g,母液122.1 g,此阶段K+结晶收率为15.5%。
3)第二阶段蒸发失水量及析盐量。第一阶段得到的122.1 g 母液蒸发失水71.5 g 后固液分离,可得钾盐27.8 g[其中KCl为26.6 g、K3Na(SO4)2为1.2 g],此阶段K+结晶收率为61.2%、余母液为22.8 g、K+总结晶收率为76.7%。
2.2.2 常温溶浸-蒸发-结晶工艺过程理论分析
根据图2,设定操作温度均为25 ℃,以100.0 g飞灰为原料对常温溶浸-蒸发-结晶工艺过程中体系水量与析盐量等进行分析,结果如下。
1)溶浸加水量。把100.0 g 飞灰中的可溶物溶浸完全需水218.7 g(理论最小量),得到浸出液267.3 g,其中K+质量分数为8.8%。
2)第一阶段蒸发失水量及析盐量。把267.3 g浸出液蒸发失水137.1 g(理论最大量)可得硫酸钾8.1 g,得到母液122.1 g,此阶段K+结晶收率为15.5%。
3)第二阶段蒸发失水量及析盐量。将母液122.1 g蒸发失水71.5 g 后固液分离,可得固相27.8 g[其中KCl为26.6 g、K3Na(SO4)2为1.2 g],此阶段K+结晶收率为61.2%、余母液为22.8 g、K+总结晶收率为76.7%。
根据上述理论分析,热溶-蒸发-冷结晶和常温溶浸-蒸发-结晶两种工艺得到的硫酸钾和氯化钾的质量及钾的结晶总收率均相同,表明两种工艺对于飞灰中钾的回收可达到相同的效果,差别在于溶浸相同质量的飞灰25 ℃时所需水量约是100 ℃条件下的1.8倍,相应地在后续蒸发过程中需要蒸发的水量也多;但100 ℃溶浸需要在较高温度下操作。两种工艺各有优缺点,相比较而言,热溶-蒸发-冷结晶工艺流程中溶解和蒸发所需时间较短,从而工艺效率相对较高;同时煅烧法生产铝酸钙过程中有余热可以补充热溶工艺所需热量。因此,采用热溶-蒸发-冷结晶工艺作为优选工艺,热溶和冷结晶温度分别设置为90 ℃和25 ℃。
2.3 可溶性实验
为考察飞灰的溶浸效果及共存矿物对其影响,用500.0 g 飞灰与665.0 g(按理论计算最小水量的1.1 倍)水进行混合,过滤后得到796.0 g 固相与255.3 g溶液,滤液冷却后有白色晶体析出,经分析,滤液中K+质量分数为10.13%,白色晶体经XRD 表征结果表明,2θ为21.256 4°、29.774 2°、30.763 1°、30.963 1°、37.099 0°、43.417 9°处的衍射峰对应硫酸钾(PDF 卡号98-001-9777)的特征衍射峰,因此析出物为硫酸钾(见图3)。飞灰溶浸实验结果与理论分析结果之间偏差较大,飞灰用水溶浸可把水溶性组分转入液相,但由于飞灰矿物的复杂性,在溶浸过程中大部分水与矿物结合,致使实际用于溶解可溶性组分的水量大幅减少,从而得到的溶液量较少,同时湿固渣质量显著增加;高温条件下的溶浸液中硫酸钾含量较高,降温后硫酸钾达到饱和即从溶液中析出。经分析溶浸过程中与飞灰结合的水量大致与飞灰质量相同,因此在飞灰溶浸时应补加与飞灰相同质量的水量。
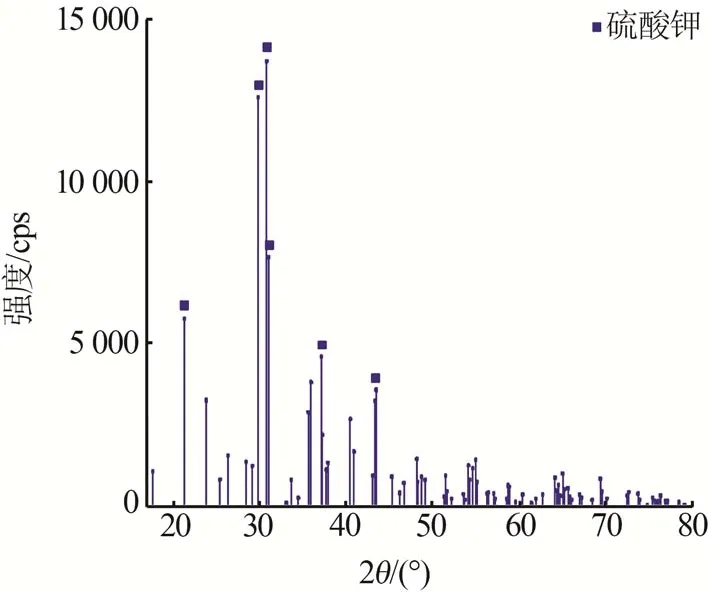
图3 析出物的XRD谱图Fig.3 XRD pattern of precipitation
2.4 水量因素实验
分别用200.0 g 飞灰与不同质量的水混合并搅拌4 h 后进行固液分离,分析浸取液中K+含量并计算飞灰中K+溶出率,实验结果见表3。由表3结果可知,随淡水量增加,飞灰中K+溶出率逐步增加,而浸取液中K+含量逐步降低。整体来看,飞灰中钾的溶出率较低,当淡水量为理论值的3倍时,溶出率仅为78.7%,这可能是飞灰矿物特性决定的。综合考虑钾溶出率和溶液中K+含量,选取淡水量为680.0 g,即3.4∶1作为优选的液固比因素值。
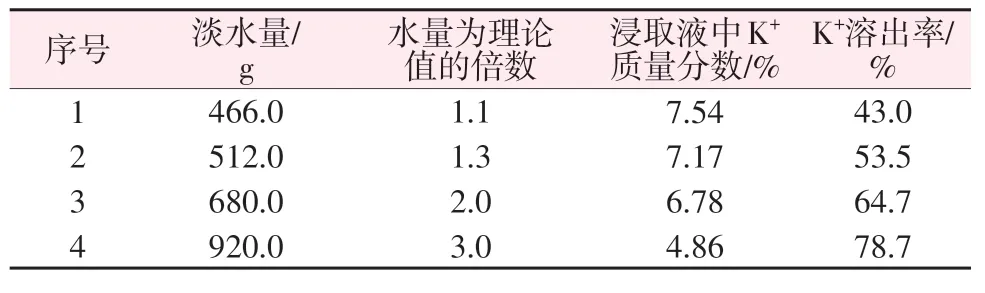
表3 水量因素实验结果Table 3 Result of water factor experiment
2.5 时间因素实验
分别用200.0 g 飞灰与680.0 g 水混合不同时间后进行固液分离,分析浸取液中钾的含量并计算飞灰中钾的溶出率,实验结果见表4。由表4 可知,随着浸取时间增加,所得浸取液中K+含量逐渐升高但钾的溶出率逐渐降低。相比较而言,浸取时间较短时所得的溶液相对较多,固渣与溶液较易分离,这也可能是飞灰矿物的特性之一。较短的浸取时间条件下K+溶出率较高,因此选取1 h 作为较优的时间因素值。
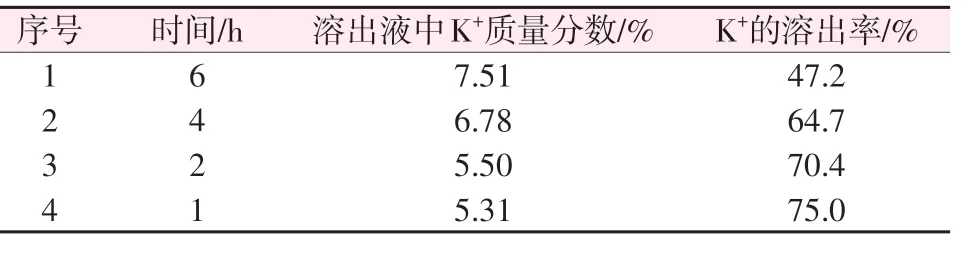
表4 时间因素实验结果Table 4 Result of time factor experiment
2.6 浸取条件的优化
在保持总液固比不变的条件下,考察了滤液和固渣分别连续浸取对K+溶出效果的影响,结果见表5和表6。由表5可知,增加溶浸次数可提高K+溶出率和溶液中K+浓度,当连续浸取6次时,钾的累计溶出率可达95% 左右,溶液中K+质量分数可达12.60%,接近理论最高值13.95%。表6 组成与理论分析结果相比,溶液中SO42-浓度相对较低,可能是组分间相互作用的结果。优化后的浸取条件为连续浸取6次。
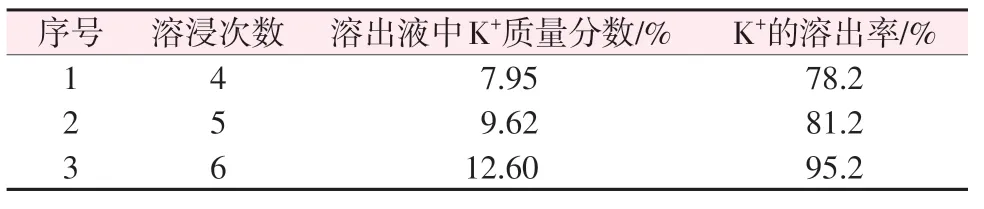
表5 优化实验结果Table 5 Result of optimized experiment
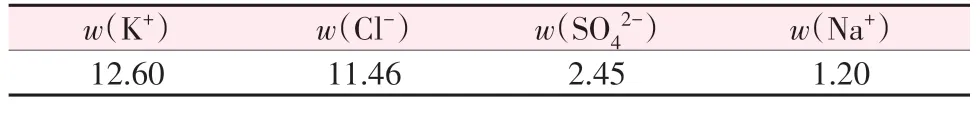
表6 浸取溶液组成Table 6 Chemical compositions of leaching solution %
2.7 蒸发-冷结晶实验
根据表6 溶液组成与相图数据进行蒸发-冷结晶过程水量与析盐量的理论分析可知:在100 ℃条件下,100.0 g 浸取液蒸发失水10.8 g 时(理论最大量),降温至25 ℃可得到纯净的硫酸钾1.6 g;母液在25 ℃条件下继续蒸发失水46.5 g 时(理论最大量),可得到主要是氯化钾同时有少量钾芒硝的含钾混合物18.7 g,此时母液中氯化钠刚要饱和,钾的结晶收率为93.7%。
用上述得到的溶液进行蒸发-冷结晶实验,结果见表7 和图4~6。由图4 可知,2θ为21.334 2°、29.785 6°、30.769 1°、30.960°、37.112 1°、43.450 2°处的衍射峰对应硫酸钾(PDF卡号98-001-9777)的特征衍射峰;2θ为28.330 5°、40.456 9°、50.158 7°、58.674 7°、66.355 7°、73.708 6°处的衍射峰对应氯化钾(PDF卡号98-024-0519)的特征衍射峰。硫酸钾的衍射峰强度相对较高,因此蒸发第一阶段析出的晶体主要是硫酸钾,含少量氯化钾。由图5可知:2θ为28.388 8°、40.541 2°、50.199 5°、66.389 6°、73.695 8°处的衍射峰对应氯化钾(PDF 卡号98-002-8938)的特征衍射峰;2θ为30.441 8°、31.499°、44.332 3°和31.499 8°、45.338 9°、56.420 4°处的衍射峰分别对应钾芒硝(PDF98-002-6018)和氯化钠(PDF 卡号98-004-1439)的特征衍射峰。氯化钾的衍射峰强度相对较强,因此第二阶段析出的晶体主要是氯化钾,含少量钾芒硝及氯化钠。由表7 可知,在浸取液蒸发的两个阶段,按理论分析结果控制蒸发水量,可分别得到纯度较高的硫酸钾和氯化钾,控制其他盐类的析出量,钾的结晶收率为81.3%,蒸发-冷结晶实验结果与理论计算结果基本一致。浸取液蒸发结晶路线见图6,液相组成点变化路径为P→N→A。由图6 可知,浸取液的蒸发路线与理论分析基本一致。根据实验结果可知,优选的蒸发节点控制应与理论分析结果一致。
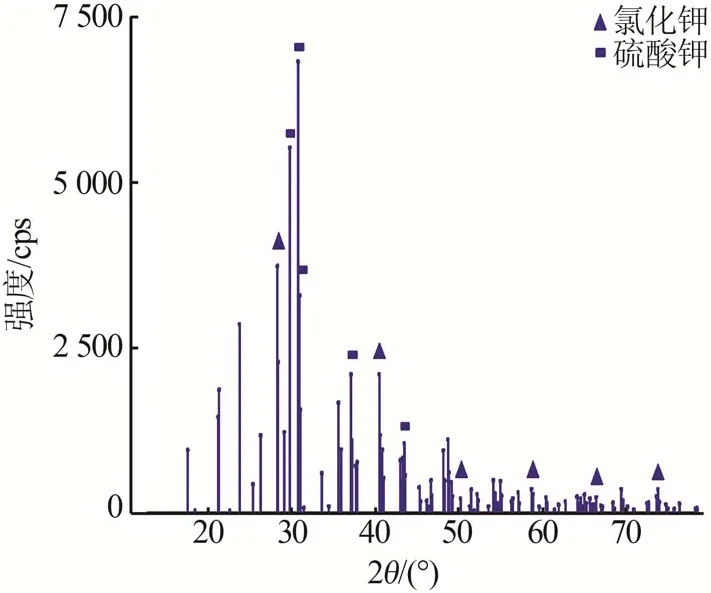
图4 第一阶段蒸发结晶物XRD谱图Fig.4 XRD pattern of crystal precipitated during first stage evaporation
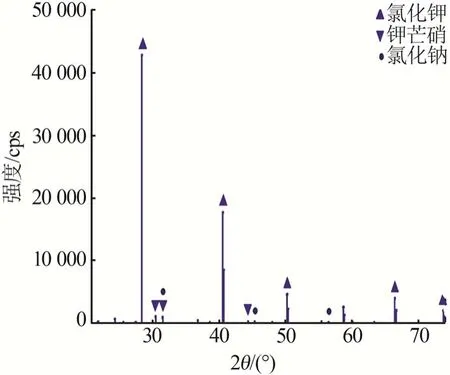
图5 第二阶段蒸发结晶物XRD谱图Fig.5 XRD pattern of crystal precipitated during second stage evaporation
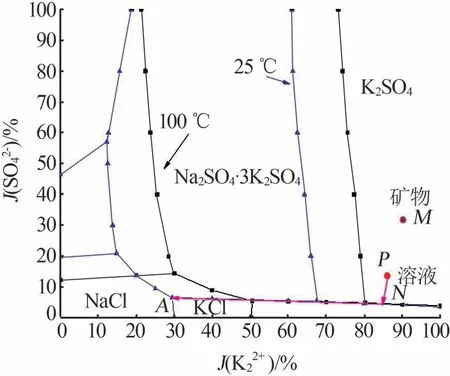
图6 含钾浸取液蒸发路径(红线所示)Fig.6 Evaporation path of leaching solution containing potassium(red line)
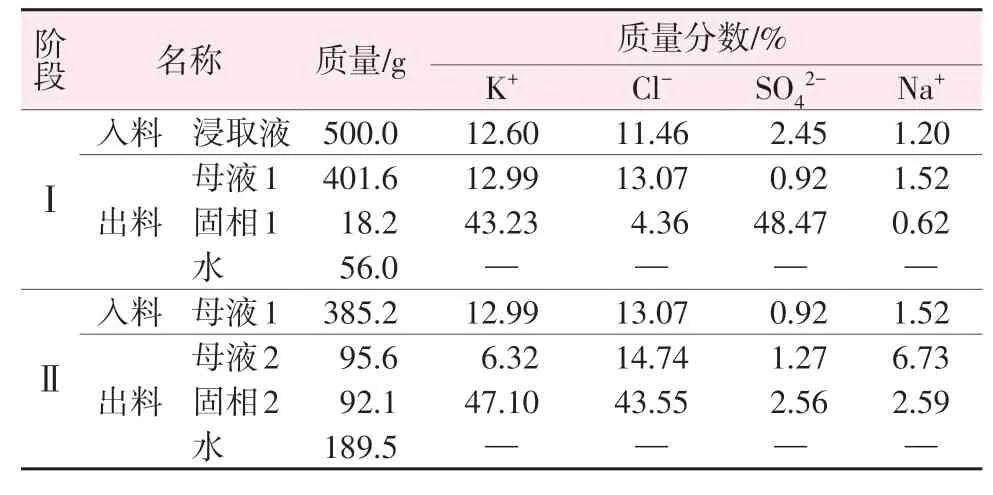
表7 蒸发-冷结晶实验结果Table 7 Results of evaporation-cold crystallization experiment
3 结论
1)铝酸钙飞灰中含有氯化钾、钾芒硝等水溶性含钾组分和钾石膏等非水溶性含钾组分,水溶性钾质量分数为23.52%左右,可作为一种潜在的优质钾资源加以利用。飞灰经水浸取后可以把其中的水溶性钾组分溶解到液相,但是由于飞灰矿物本身的特点,浸取过程中所用的水量与理论分析结果相比偏差较大,单次溶解不能达到较好的溶出效果,经过多次溶解可逐步提高钾的溶出率和浸出液中K+浓度。研究表明,经连续6次溶浸,钾的溶出率可达95%左右、浸出液中K+质量分数达12.60%。
2)铝酸钙飞灰经热溶-蒸发-冷结晶工艺回收其中的钾,优选工艺条件为:溶浸温度为90 ℃,液固比为3.4∶1,采用分步蒸发-结晶,结晶温度为25 ℃,第一阶段蒸发水量为10.8%,第二阶段蒸发水量为53.1%,较优工艺条件下钾的结晶总收率为81.3%,与理论分析结果基本一致。
3)回收利用铝酸钙飞灰中的钾可以联产硫酸钾和氯化钾,使得固体废弃物资源化,符合循环经济“资源化”的要求,对于减少排放、保护生态具有重要意义。
