三氯生对剩余污泥碱性发酵及微生物群落结构的影响
2023-10-19刘泽清宋秀兰张雨青
刘泽清,宋秀兰,张雨青
(太原理工大学 环境科学与工程学院,山西 晋中 030600)
基于活性污泥法的污水处理工艺会产生大量剩余污泥。据统计,2020年我国城市污水处理能力约为5 472.3 km3,剩余污泥产量超过60 Mt(以含水率80%计)[1]。剩余污泥组成十分复杂,包含了众多有机物、致病微生物、重金属等,易对环境造成严重污染。厌氧发酵是应用最广泛的剩余污泥处理处置方法之一,能有效实现污泥的减量化、稳定化[2]。由于以产甲烷为导向的厌氧发酵技术周期长(15~30 d)、经济价值不如短链脂肪酸(SCFA)高,因此,基于剩余污泥的厌氧发酵产酸技术成为持续研究热点[3]。研究表明,SCFA可作为污水处理厂良好的外加碳源,也能用于合成高附加值产品,如可生物降解塑料和生物柴油[4-5]。然而,剩余污泥整体结构复杂,胞外聚合物和半刚性的细胞壁重重包裹着污泥细胞,导致大分子有机物不易破胞溶出,限制了厌氧发酵的速率。为了提高污泥发酵产酸效率,需要对其进行预处理。通常认为,碱性条件较酸性和中性条件更适合污泥厌氧发酵产酸,它能促进污泥溶解、强化水解酸化过程[6-7]。
三氯生(TCS),广谱抗菌剂[8],是一种典型的内分泌干扰物质,常用于生产各种药品和个人护理用品[9]。分散于生态环境中的TCS,经污水处理厂生化处理后最终富集于剩余污泥中,其含量可达0.028~37.189 mg/kg(以TSS计,下同)[10]。由于厌氧发酵过程包含了一系列复杂的代谢反应和微生物活动,因此TCS可能会通过影响部分菌群和生物酶的活力影响发酵产酸效能。研究表明,污泥中TCS含量为100 mg/kg时,可促进丁酸和丙酸的积累,使SCFA产量增加约36%;而较高含量的TCS(500 mg/kg)会抑制发酵[11]。尽管目前已有关于TCS对污泥厌氧发酵产酸影响的研究,但碱性条件下的该类研究仍未见报道。
本工作考察了TCS投加量对剩余污泥碱性发酵产酸效果的影响,通过污泥溶解、水解、酸化和水解酶活力实验探究了TCS强化污泥碱性发酵产酸的机理,并采用高通量测序技术分析了3种发酵条件下功能菌群的变化,以期为污泥资源化提供新的理论基础。
1 材料与方法
1.1 实验材料
实验用剩余污泥取自山西省杨家堡污水处理厂的浓缩池,并置于冰箱4 ℃下沉降24 h,弃去上清液,其基本性质如表1所示。
1.2 实验方法
产酸实验采用6组工作体积为500 mL的血清瓶,每个血清瓶中加入450 mL剩余污泥。向各组血清瓶中分别投加0,40,120,200,400,500 mg/kg的TCS,使污泥的初始总TCS质量浓度分别为0.073,0.785,2.210,3.635,7.197,8.978 mg/L;再用2.5 mol/L的NaOH和HCl溶液调节污泥pH为10,发酵第1 d调3次pH,每次间隔8 h,发酵第2、3 d每天各调节2次,每次间隔12 h。将所有血清瓶用氮气吹扫2 min,并立即用橡皮塞密封以保证厌氧环境;再置于恒温空气振荡器中开始发酵,温度和转速分别设置为30 ℃和200 r/min。实验发酵周期为10 d,期间每天取样,样品在4 500 r/min下离心5 min,取上清液经0.45 μm滤膜过滤,测定SCFA浓度。10 d发酵结束后,测定水相、泥相中TCS的浓度以及污泥VSS,根据发酵前后的VSS计算污泥的VSS减少率,以此表征有机质的减少率。
机理研究中,选取空白、pH 10、pH 10+400 mg/kg TCS 3种发酵条件。在发酵2 d时,取样测定污泥中α-葡萄糖苷酶和蛋白酶的活性;发酵5 d时取样进行微生物分析。进行污泥溶解过程研究时,取样测定发酵前3 d时的SCOD、溶解性碳水化合物和可溶性蛋白质浓度。进行水解过程研究时,将2.423 g牛血清蛋白(BSA,模拟蛋白化合物)和0.719 g葡聚糖(模拟碳水化合物)溶解于405 mL蒸馏水中,接种45 mL原剩余污泥使最终污泥TSS为1.78 g/L,并在上述3种条件下进行3 d发酵,每天取样测定上清液中BSA和葡聚糖的浓度。酸化过程研究方法同水解过程一致,仅将模拟底物更换为L-丙氨酸和葡萄糖。
1.3 分析方法
1.3.1 TCS的测定
取适量污泥样品,在GT10-1型离心机(北京时代北利离心机有限公司)中以8 000 r/min转速离心10 min以分离水相和泥相。将上清液,即水相,用1 mol/L的H2SO4溶液调节pH至2~3,过0.45 μm滤膜,于4 ℃保存。将离心后的污泥,即泥相,平铺于干燥盘中,于-20 ℃冷冻24 h,再置于FD-1A-50型冷冻干燥机(北京博医康实验有限公司)中于-50 ℃冷冻干燥48 h,研磨过筛(60目),称取0.1 g于离心管中,加入5 mL甲醇,用THZ-C型涡旋混合器(大仓市实验设备厂)充分混合,超声萃取30 min,以8 000 r/min转速离心10 min,取上清液于棕色试管中,在40 ℃水浴条件下氮气吹至5 mL,用超纯水定容至100 mL,再用1 mol/L H2SO4溶液调节pH至2~3,于4 ℃保存。
将上述预处理后所得的水相和泥相样品采用Oasis HLB型固相萃取柱(沃特世科技(上海)有限公司)进行萃取,然后采用Agilent 1260 Inifinity Ⅱ型高效液相色谱仪(安捷伦科技有限公司)测定TCS质量浓度。根据下式计算剩余污泥的总TCS质量浓度(ρ,mg/L);根据发酵后的水相TCS质量浓度和发酵前的总TCS质量浓度计算TCS的表观去除率;根据发酵后和发酵前的总TCS质量浓度计算TCS的降解率。
式中:ρw和ρs分别为水相和泥相中的TCS质量浓度,mg/L;Cs为泥相中的TCS含量,mg/kg。
1.3.2 其他
TSS、VSS、SCOD和TCOD的测定均参照标准方法进行[12]。采用SP 2100型气相色谱仪(北京北分瑞利分析仪器有限公司)测定SCFA浓度,包括乙酸、丙酸、正丁酸、异丁酸、异戊酸、正戊酸6种有机酸,其浓度分别乘以换算因子1.07,1.51,1.82,1.82,2.04,2.04转化为以COD计的浓度[13]。可溶性蛋白质和BSA的测定采用福林酚试剂法[14],溶解性碳水化合物、葡聚糖和葡萄糖的测定采用蒽酮-硫酸法[15],L-丙氨酸测定采用液相色谱法[16]。溶解性碳水化合物和可溶性蛋白质浓度分别乘以换算因子1.06和1.50转化为以COD计的浓度。参照文献测定α-葡萄糖苷酶和蛋白酶的相对活力[17]。微生物样品委托生工生物工程(上海)股份有限公司进行Illumina MiSeq平台测序分析。
2 结果与讨论
2.1 TCS对污泥碱性发酵产酸过程的影响
2.1.1 TCS投加量对SCFA产量的影响
图1a显示了TCS投加量对污泥碱性发酵(pH 10)过程中SCFA浓度的影响。整体而言,各组反应体系SCFA浓度均随发酵时间呈现出先迅速增大后逐渐减小的趋势。原因是碱性条件促进了污泥的分解过程,迅速释放出水解、酸化过程所需的有机底物;而污泥中有机物随发酵进行不断被消耗,导致了SCFA浓度难以进一步提高。在发酵的前5 d,随TCS投加量从0升至400 mg/kg,SCFA产量逐渐增大。在400 mg/kg TCS组发酵至5 d时达到最大SCFA浓度,为2 900.37 mg/L(产量2 740.96 mg/L),相比未投加TCS组5 d时提高了352.54 mg/L,这表明投加400 mg/kg的TCS可显著提高SCFA产量。而进一步提高TCS投加量至500 mg/kg时,SCFA浓度发生了下降。这表明一定量的TCS能够有效强化污泥碱性发酵的产酸性能,而过高的TCS浓度可能对微生物有较强危害作用,从而抑制了污泥中产酸优势菌的生长,影响SCFA的进一步积累[11]。因此,在本实验中,强化污泥碱性发酵产酸的最佳TCS投加量为400 mg/kg。
SCFA可作为污水处理厂生物脱氮除磷的外加碳源,而其中乙酸的利用效率最高,因此提高SCFA中乙酸的相对含量有利于污泥资源化利用。图1b显示了碱性发酵5 d时,不同TCS投加量下的SCFA组成。由图可知:在所有发酵条件下,乙酸的质量分数始终是最高的,占SCFA的30.20%~36.73%;其次是丙酸,占SCFA的18.56%~21.39%;而正戊酸的占比最低,约为7%。本实验中,400 mg/kg TCS组的乙酸相对含量最高,质量分数达到36.73%,是未投加TCS组的1.22倍,表明该条件下的发酵液更适合作为污水厂的外加碳源,有助于实现污泥资源化。
2.1.2 TCS投加量对有机质减少的影响
厌氧发酵过程能促进污泥中固体有机质的溶出和利用,这对污泥减量化意义重大。图2显示了10 d碱性发酵结束时不同TCS投加量下的VSS的变化情况,以此表征有机质的变化。由图2可知,所有投加TCS的反应体系中VSS均低于未投加组,相应的减少率均高于未投加组,表明TCS能有效促进污泥厌氧发酵过程中有机质的减少。随着TCS投加量从0升至400 mg/kg,污泥的VSS减少率逐渐变大,在400 mg/kg TCS组达到最高(40.50%),相较未投加TCS组提高了3.39个百分点。这表明该条件下进行发酵对污泥有机质的消耗程度最高,有助于实现污泥减量化。

图2 TCS投加量对有机质的影响
2.1.3 污泥发酵过程对TCS的去除
污泥中TCS的去除有吸附和生物降解两种途径,其中吸附是依靠TCS在固-液相之间的迁移,而生物降解能真正去除TCS。研究表明,污泥厌氧发酵过程可以促进污泥中抗生素的溶出,更好地发挥生物降解作用[18]。图3显示了10 d碱性发酵结束时,TCS在各组污泥样品泥相、水相中的残余浓度及其降解率。由图3数据计算可知,各组水相中TCS的表观去除率均超过90%,其中400 mg/kg TCS组的残余总TCS浓度为3.61 mg/L,降解率达到最高值,为49.80%。
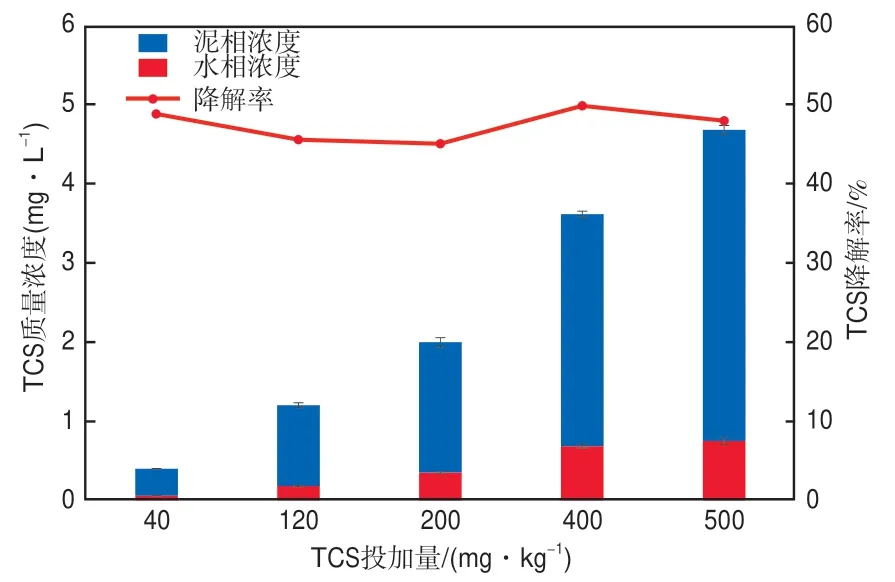
图3 污泥碱性发酵对TCS的去除效果
2.2 TCS强化污泥碱性发酵产酸的机理分析
2.2.1 污泥溶解过程
碳水化合物和蛋白质是污泥细胞和胞外聚合物的主要组成部分,污泥厌氧发酵首先要将这些有机物由颗粒态转化为溶解态,以便进一步利用。因此,可溶性有机物的释放情况能表征剩余污泥的溶解程度。图4显示了3种发酵条件下污泥中SCOD、溶解性碳水化合物及可溶性蛋白质浓度在发酵3 d内的变化情况。由图可知,随发酵时间的延长,3种不同发酵体系下的溶解性有机物浓度均不断增加,且pH 10+400 mg/kg TCS组的SCOD、溶解性碳水化合物和可溶性蛋白质浓度均高于其他组。在发酵3 d时,pH 10+400 mg/kg TCS组的SCOD达到2 616.0 mg/L,分别是空白组和pH 10组的4.09和1.10倍。这表明,投加TCS进一步促进了碱性发酵条件下污泥中颗粒有机物的溶出,增强了污泥厌氧发酵的溶解过程。同时,pH 10+400 mg/kg TCS组的溶解性碳水化合物和可溶性蛋白质浓度在发酵3 d时达到461.1 mg/L和1 225.3 mg/L,分别是空白组的4.52倍和1.14倍,pH 10组的4.66倍和1.04倍。这进一步证明了投加TCS对污泥碱性发酵溶解过程有促进作用,为后续微生物水解及酸化提供了更充足的底物,有利于SCFA的迅速积累。

图4 发酵条件对污泥溶解过程影响
2.2.2 水解、酸化过程
污泥中的大分子有机物经破胞溶出后,在微生物作用下会被进一步水解成小分子,并代谢酸化成SCFA。因此,微生物的水解酸化速率也同SCFA积累密切相关。如图5a和图5b所示,本实验通过葡聚糖、BSA的降解模拟污泥水解过程。不难看出,3种发酵体系下BSA和葡聚糖的降解率均随时间延长而不断提高。在发酵3 d时,pH 10+400 mg/kg TCS组的BSA降解率最高(76.38%),相比空白组和pH 10组分别提高了25.92和2.56个百分点。同时,pH 10+400 mg/kg组发酵第3 d的葡聚糖降解率为44.00%,分别是空白组和pH 10组的1.32和1.10倍。由此可知,pH 10+400 mg/kg TCS组的水解速率最大,可使污泥中更多的溶解性大分子有机物(如碳水化合物和蛋白化合物)水解为低分子量物质(如葡萄糖和氨基酸),为产酸菌群提供更多底物。上述结果表明,在碱性条件下,污泥中含有一定量TCS能有效提高水解效率。此外,本实验通过葡萄糖、L-丙氨酸的降解来模拟污泥酸化过程,如图5c和图5d所示。3种发酵体系下的L-丙氨酸和葡萄糖的降解率也随发酵时间的延长而不断提高。在发酵3 d时,pH 10+400 mg/kg TCS组中L-丙氨酸和葡萄糖的降解率分别为64.72%和71.75%,是空白组的1.17和1.11倍,相比pH 10组分别提高了5.40和3.82个百分点。这表明,污泥碱性发酵下投加TCS能进一步促进酸化过程,更多的水解产物被产酸微生物转化为SCFA。

图5 发酵条件对水解、酸化过程的影响
2.2.3 水解酶活力
SCFA复杂的代谢合成离不开众多生物酶的参与,如功能菌群在水解大分子有机物时会分泌水解酶,以提高转化效率。α-葡萄糖苷酶和蛋白酶是两种关键的水解酶,分别通过破坏多糖的糖苷键和蛋白质的肽链来促进污泥水解,产生葡萄糖和氨基酸。图6显示了污泥发酵2 d时这两种水解酶的相对活力(以空白组酶活力为100%)。由图可知:pH 10+400 mg/kg TCS组的α-葡萄糖苷酶活力为空白组的1.62倍,比pH 10组提高了11个百分点;pH 10+400 mg/kg TCS组的蛋白酶活力是空白组的2.21倍,比pH 10组提高了7个百分点。这表明碱性条件促进了两种关键水解酶的释放,而投加TCS能进一步提高酶活力,从而提升污泥水解速率,为产酸微生物提供更多小分子底物。

图6 发酵条件对水解酶活力的影响
2.3 功能菌群分析
污泥厌氧发酵体系中微生物群落结构复杂,为了实现SCFA的富集,需要各种微生物相互配合。如图7所示,在门水平上的优势菌群主要包括厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)。研究表明,厚壁菌门微生物能释放水解酶、利用有机物产酸且抗极端环境能力强,而放线菌门微生物与大分子有机物的降解密切相关[19-22]。二者在pH 10+400 mg/kg TCS组的合计相对丰度由空白组的5.98%大幅增至51.78%,比pH 10组提高了2.22个百分点。变形菌门(Proteobacteria)微生物主要参与发酵过程中乙酸、丙酸和丁酸的消耗[23],其在pH 10+400 mg/kg TCS组中的相对丰度为21.53%,相较于空白组和pH 10组分别降低了11.27和2.55个百分点。
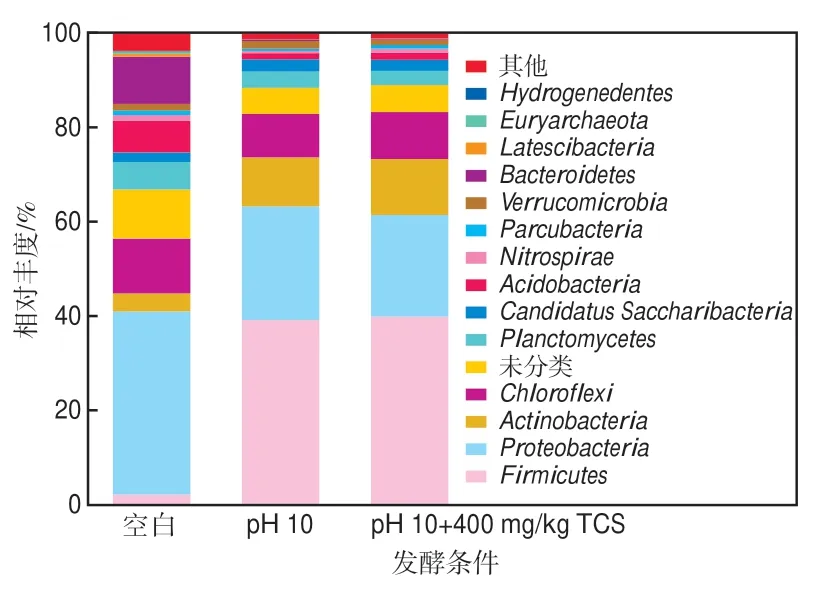
图7 不同发酵条件下微生物在门水平上的相对丰度
如图8所示,在纲水平上的优势菌群主要有梭状芽孢杆菌纲(Clostridia)、放线菌纲(Actinobacteria)和α-变形菌纲(Alphaproteobacteria)。梭状芽孢杆菌纲是水解大分子有机物的主要菌群[24],在pH 10+400 mg/kg TCS组其相对丰度为33.01%,高于空白组(1.76%)和pH 10组(31.50%)。放线菌纲微生物是典型的发酵产酸菌,能利用水解底物进行SCFA的生产[25],其在pH 10+400 mg/kg TCS组中的相对丰度也显著高于空白组(3.80%)和pH 10组(10.15%),达到11.63%。α-变形菌纲微生物可利用糖类和蛋白质转化产生乙酸和丙酸[26],在pH 10+400 mg/kg TCS组中相对丰度为12.32%,相比空白组提高了3.52个百分点。上述结果表明,碱性发酵条件下投加TCS有效富集了污泥中SCFA的生产者,同时也削减了消费者,促进了SCFA的不断积累。

图8 不同发酵条件下微生物在纲水平上的相对丰度
图9进一步在属水平上分析了3组污泥样品的微生物群落分布情况。由图可知,厌氧醋菌属(Acetoanaerobium)、蛋白水解菌属(Proteinivorax)和泰氏菌属(Tissierella)是3种主要的优势菌属,且同属于厚壁菌门(Firmicutes),该菌门中不少微生物都对产酸发挥主要作用。厌氧醋酸菌属微生物可以吸收H2和CO2并转化为乙酸[27],其在pH 10+400 mg/kg TCS组中的相对丰度为15.88%,显著高于空白组(0.08%)且比pH 10组提高了0.88个百分点。这表明,pH 10条件下污泥发酵易产生更多乙酸,而投加TCS也能进一步提高乙酸相对含量。蛋白水解菌属微生物可在碱性厌氧条件下,以蛋白质、二糖、丙酮等物质作基质产生SCFA[28],其在pH 10+400 mg/kg TCS组中的相对丰度达到1.90%,高于pH10组(0.53%),而在空白组中未发现。这说明TCS的存在有效富集了蛋白水解菌属微生物。此外,pH 10+400 mg/kg TCS组中的泰氏菌属的相对丰度由空白组的0.02%升至6.12%,且显著高于pH 10组(4.57%)。有研究表明,该菌属微生物通过代谢有机物可产生乙酸、丁酸和氨氮[29]。
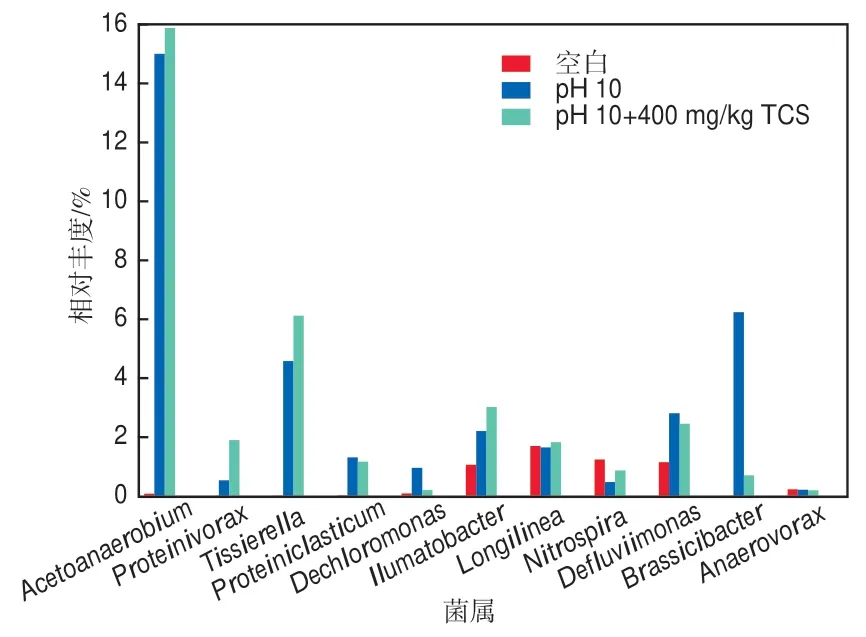
图9 不同发酵条件下微生物在属水平上的相对丰度
上述结果表明,pH 10+400 mg/kg TCS发酵体系通过破坏污泥细胞释放出可溶性有机物,有效促进了水解和产酸菌的富集。该结论证实了TCS对污泥碱性发酵产酸的强化作用。
3 结论
a)TCS影响污泥碱性发酵(pH 10)的产酸效果。当TCS投加量为400 mg/kg且发酵5 d时,SCFA的产量最高,为2 740.96 mg/L,相比未投加TCS时提高了352.54 mg/L。该体系中,乙酸在SCFA中的占比最高,质量分数达36.73%;以VSS减少率表征的有机质减少率最大,达40.50%,有助于污泥资源化利用。
b)机理研究表明,TCS进一步促进了污泥碱性发酵的溶解、水解和酸化过程,同时增强了水解酶的活力,为产酸微生物提供更多底物。
c)功能菌群分析表明,TCS显著强化了厚壁菌门和放线菌门微生物在污泥碱性发酵过程中的富集,尤其是厚壁菌门的厌氧醋酸菌属和泰氏菌属微生物,其相对丰度分别达到15.88%和6.12%,有利于SCFA的积累。
