酶解大豆乳清蛋白制备抗氧化肽及其体外抗氧化活性评价
2023-10-19林彦君刘杨静曲肖凤杜媛媛房文硕尹艺童
林彦君,刘杨静,曲肖凤,杜媛媛,房文硕,尹艺童,李 瑞
(济宁医学院生物科学学院,山东日照 276826)
大豆乳清废水是由大豆分离蛋白生产过程中产生,具有排放量大和富含有机物的特点[1-3]。目前,大多数大豆分离蛋白生产企业将大豆乳清废水排放至污水处理厂经生化法处理[4],这样不仅造成了大量有机物的浪费,也给企业造成了很大的经济负担[5]。因此,大豆乳清废水的回收再利用一直是生产企业亟待解决的关键问题之一。
大豆乳清废水中含有大豆乳清蛋白(whey soy proteins)、低聚糖、大豆异黄酮等有机物[6]。其中,大豆乳清蛋白具有较高的分子量,它的回收能有效降低低聚糖和大豆异黄酮等低分子量有机物的回收难度,所以大豆乳清蛋白的回收再利用可认为是大豆乳清废水资源化的首要步骤[7]。目前,大豆乳清蛋白的资源化主要有两种策略:单独回收其中的蛋白活性组分(如植物凝集素、β-淀粉酶、脂肪氧化酶、胰蛋白酶抑制剂等)并加以利用;整体回收大豆乳清蛋白以作为食品或饲料组分加以利用[8,9]。由于大豆乳清废水中大豆乳清蛋白浓度低且成分复杂,导致单独回收每个蛋白活性组分的成本很高,因而第一种策略尚未实现工业化应用。相比而言,大豆乳清蛋白整体回收的成本较低,并已获得工业化应用。然而,企业所回收的大豆乳清蛋白仅作为动物饲料的添加组分,利用价值相对较低。因此,在整体回收的基础上,进一步提高大豆乳清蛋白的应用价值对其资源化有重要的意义。
抗氧化活性肽,作为天然的抗氧化剂,因其低毒、高效的特点,在食品、医药和饲料等行业备受青睐[10-12]。酶解法具有绿色高效、安全、专一性强和成本低的优点,在水解大豆分离蛋白制备抗氧化活性肽方面已获得广泛的研究[13-15]。然而,酶解大豆乳清蛋白用于制备抗氧化活性肽的研究却少有报道。尹乐斌等[16]利用乳酸菌对大豆乳清废水进行发酵,发酵液中的多肽具有较高的抗氧化活性。上述研究证实了大豆乳清蛋白可用于生产抗氧化肽,但是发酵液中成分复杂,导致抗氧化肽的后续分离十分困难。而采用蛋白酶直接水解从大豆乳清废水中回收的大豆乳清蛋白则会避免上述问题[17]。鉴于此,本实验将采用酶解法水解大豆乳清废水中分离的大豆乳清蛋白以制备抗氧化肽。利用单因素和响应面试验优化大豆乳清蛋白的酶解工艺,以得到活性较高的抗氧化肽混合物。再通过超滤分离该混合物,并以抗坏血酸为参照评价其体外抗氧化活性。本研究旨在为大豆乳清蛋白抗氧化肽的制备提供理论依据,进一步提高大豆乳清蛋白的利用价值。
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕(蛋白含量53.7%±1.4%)湖北兴恒业科技有限公司;碱性蛋白酶(230 U/mg)、胃蛋白酶(30 U/mg)、中性蛋白酶(100 U/mg)上海蓝季科技发展有限公司;DPPH(1,1-二苯基-2-三硝基苯肼)上海麦克林生化科技有限公司;硫酸亚铁、双氧水、水杨酸、无水乙醇、三氯乙酸、铁氰化钾、三氯化铁等 国药集团化学试剂有限公司;其它试剂均为国产分析纯。
752N 紫外可见分光光度计、PHS-3C pH 计上海仪电分析仪器有限公司;JJ-1B 300 W 恒速电动搅拌器 金坛区西城新瑞仪器;Sorvall LYNX6000落地离心机 美国Thermo Scientific 公司;ATN-300 全自动定氮仪 上海精密仪器仪表有限公司;BT100FJ 蠕动泵 保定创锐泵业有限公司;KQ2200E超声波清洗器 昆山市超声仪器有限公司;FD-1A-50 冷冻干燥机 北京博医康实验仪器有限公司;DFY-5L/10 低温恒温反应浴 巩义市予华仪器有限责任公司;WP-UP-YZ-100 超纯水机 四川沃特尔水处理设备有限公司。
1.2 实验方法
1.2.1 大豆乳清废水的制备 模拟工业上碱溶酸沉法制备大豆分离蛋白的流程用以生产大豆乳清废水[18]。首先,按照质量比1:5 的比例,将低温脱脂豆粕与自来水混合,加入6.0 mol/L 氢氧化钠溶液调节混合液pH 至8.0。其次,利用JJ-1B 300 W 恒速电动搅拌器在300 r/min 下搅拌该混合物5.0 h 以促进大豆蛋白的溶解,随后放入落地离心机,在5000 r/min下离心该混合物10 min,取上清液。在上清液中加入6.0 mol/L 盐酸溶液调节其pH 至4.5,并静置5.0 h以沉淀大豆分离蛋白。最后,在5000 r/min 下离心悬浊液10 min,取上清液即为大豆乳清废水。
1.2.2 大豆乳清蛋白的制备 大豆乳清蛋白受热易变性沉淀[19],因而企业所生产的大豆乳清蛋白产品为不溶性的固体沉淀。鉴于此,本文利用热沉淀法从大豆乳清废水中快速提取大豆乳清蛋白作为制备抗氧化肽的原料。将大豆乳清废水煮沸1 min,随后放入离心机并在5000 r/min 下离心10 min,取沉淀。用超纯水清洗沉淀3 次后,利用冷冻干燥机将其在温度-50 ℃和真空度20 Pa 条件下干燥48 h,即得大豆乳清蛋白样品。利用凯氏定氮法测定其蛋白含量为85.6%±2.3%
1.2.3 大豆乳清蛋白的酶解 大豆乳清蛋白的酶解在一个自组装的超声-恒温反应体系(见图1)中进行。在该体系中,低温恒温反应浴中的水,通过两个水流方向相反的蠕动泵(流量100 mL/min),与超声波清洗器(功率100 W)内的水形成循环水。该体系可将由超声震荡所产生的热量迅速带离超声波清洗器,并被低温恒温反应浴消除,以维持水温始终保持在蛋白酶的最适温度。

图1 超声-恒温反应体系Fig.1 Ultrasound-thermostatic reaction system
具体酶解工艺操作如下:首先,将大豆乳清蛋白冻干粉末与纯净水混合均匀,使用0.6 mol/L 的盐酸或氢氧化钠溶液将1000 mL 混合液pH 调节至蛋白酶的最适pH。其次,待反应体系的水温达到蛋白酶的最适温度,将装有混合液的烧杯放入超声波清洗器内水浴,平衡30 min 后加入蛋白酶,并打开超声波清洗器开关进行水解。待达到设定水解时间,将混合液在100 ℃下煮沸5 min 对蛋白酶进行灭活。最后,将混合液水浴冷却至室温,并在10000 r/min 下离心10 min,取上清液冷藏备用。
1.2.4 蛋白酶的筛选 以DPPH 自由基清除率、羟自由基清除率和总还原力为指标,选用单酶(胃蛋白酶、碱性蛋白酶和中性蛋白酶)与双酶(中性+碱性蛋白酶、中性+胃蛋白酶和碱性+胃蛋白酶)在各蛋白酶的最适条件下对大豆乳清蛋白进行水解(水解条件见表1),筛选出最佳蛋白酶。在双酶酶解工艺中,首先利用第一种蛋白酶(左)水解大豆乳清蛋白3 h,煮沸灭酶2 min,随后调节混合液温度和pH 至第二种蛋白酶(右)的最适温度和pH,平衡30 min 后加入第二种蛋白酶,水解3 h,煮沸灭酶2 min。

表1 蛋白酶筛选实验条件Table 1 Experimental conditions for protease screening
1.2.5 单因素实验 以1.2.4 所筛选出的蛋白酶为最佳蛋白酶水解大豆乳清蛋白以制备抗氧化肽,以DPPH 自由基清除率为指标,进行单因素实验。固定大豆乳清蛋白浓度5 mg/mL 和酶解时间6 h,探究酶-底物比2000、3000、4000、5000 和6000 U/g 大豆乳清蛋白对大豆乳清蛋白水解液抗氧化活性的影响;固定酶-底物比5000 U/g 大豆乳清蛋白和酶解时间6 h,探究大豆乳清蛋白浓度3、5、7、9 和11 mg/mL对大豆乳清蛋白水解液抗氧化活性的影响;固定大豆乳清蛋白浓度9 mg/mL 和酶-底物比5000 U/g 大豆乳清蛋白,探究酶解时间4、5、6、7 和8 h 对大豆乳清蛋白水解液抗氧化活性的影响。
1.2.6 响应面优化试验 根据1.2.5 单因素实验的结果,以酶-底物比、酶解时间和大豆乳清蛋白浓度为影响因素,以DPPH 自由基清除率为响应值,利用Design Expert V8.0.6.1 软件,按照Box-Behnken 试验设计原理,进行三因素三水平的响应面试验设计。具体试验因素与水平见表2。
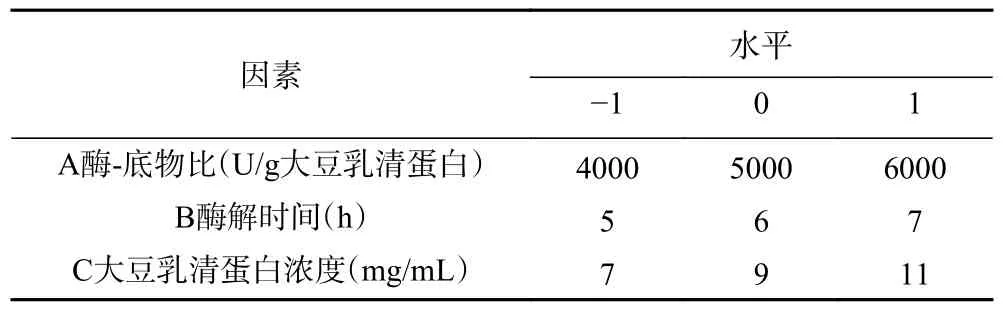
表2 响应面试验因素与水平Table 2 Factors and levels of response surface experiments
1.2.7 大豆乳清蛋白酶解产物体外抗氧化活性的测定
1.2.7.1 总还原力的测定 采用普鲁士蓝法[20]测定大豆乳清蛋白酶解产物的总还原力。具体操作如下:首先,取1 mL 大豆乳清蛋白酶解产物溶液或抗坏血酸溶液和1 mL 纯净水分别为待测溶液和空白对照,向其中分别加入2 mL 磷酸缓冲溶液(pH7.0),随后将两种混合液置于低温恒温反应浴中,在50 ℃下水浴20 min。其次,待水浴结束后,向两混合液中分别加入2 mL 三氯乙酸溶液(100 mg/mL),混匀后放入落地离心机,在转速5000 r/min 和温度5 ℃下离心10 min,取上清液。最后,取两种上清液2 mL,分别先后加入2 mL 纯净水和0.5 mL 三氯化铁溶液(1 mg/mL),混匀后静置10 min,随后在700 nm 下利用紫外可见分光光度计测量待测溶液的吸光度(OD700)。
1.2.7.2 DPPH 自由基清除率的测定 参考梁星等[21]所报道的方法测定DPPH 自由基清除率,具体操作如下:取三个试管标记为a、b 和c 号,向a 号和c 号试管中分别加入2 mL 纯净水,向b 号和c 号试管中分别加入2 mL WSP 酶解产物溶液或抗坏血酸溶液,向a 号和c 号管中分别加入2 mL DPPH 溶液(0.1 mmol/L),混合均匀。室温避光静置30 min 后,以纯净水为空白对照,利用紫外可见分光光度计在517 nm 处测量3 个试管中溶液的吸光度。DPPH 自由基清除率(RDPPH)的计算公式见式(1)。
式中,Aa、Ab和Ac分别为a、b 和c 号试管中溶液的吸光度值。
1.2.7.3 羟基自由基清除率的测定 参考薛山等[22]所报道的方法测定羟基自由基清除率,具体操作如下:首先,取三个试管标记为1、2 和3 号,向其中分别加入2 mL 硫酸亚铁溶液(6 mmol/L),随后向1 号试管中加入2 mL 纯净水,向2 号和3 号试管中加入2 mL 大豆乳清蛋白酶解产物溶液或抗坏血酸溶液,混合均匀。其次,向三个试管中分别加入2 mL 双氧水溶液(6 mmol/L),混合均匀后静置10 min。最后,到达静置时间后,向1 号和2 号试管中加入2 mL水杨酸溶液(6 mmol/L),并向3 号试管中加入2 mL纯净水,混合均匀后静置30 min,随后以纯净水为空白对照,在510 nm 下利用紫外可见分光光度计测量3 个试管中溶液的吸光度。羟基自由基清除率(ROH)的计算公式见式(2)。
式中,A1、A2和A3分别为1、2 和3 号试管中溶液的吸光度值。
1.3 数据处理
每次实验至少重复3 次,随后利用Microsoft Excel Plus 2013 进行方差分析(显著水平设置为P<0.05),利用Origin Pro 9.0 软件进行绘图,利用Design-Expert 8.0.6 软件进行响应面设计及分析。
2 结果与分析
2.1 蛋白酶的筛选
不同蛋白酶的酶切位点不同,因而酶解所产生的多肽就会多种多样[23]。因此,利用3 种单酶和3 种双酶来水解大豆乳清蛋白(具体实验条件见表1),并考察了蛋白酶种类对水解产物体外抗氧化活性的影响,结果如图2 所示。由图可知,利用单酶水解时,胃蛋白酶水解产物的总还原力(0.140±0.03)、DPPH自由基清除率(37.3%±1.6%)和羟基自由基清除率(94.8%±0.8%)均显著高于中性蛋白酶和碱性蛋白酶的水解产物(P<0.05)。这是因为大豆乳清蛋白中蛋白成分复杂,而胃蛋白酶具有广泛的特异性,并且可以水解含有苯丙氨酸、色氨酸、酪氨酸等氨基酸残基肽链中的肽键,而这些氨基酸与多肽抗氧化活性紧密相关[24]。利用双酶水解时,相比胃蛋白酶水解产物,中性和碱性蛋白酶组合水解产物的总还原力无显著性提高(P>0.05),DPPH 自由基清除率和羟基自由基清除率反而有所降低(P<0.05)。碱性和胃蛋白酶组合水解产物的抗氧化性与胃蛋白酶水解产物的抗氧化性无显著性差异(P>0.05)。值得注意的是,中性和胃蛋白酶组合水解产物的总还原力、DPPH 自由基清除率和羟基自由基清除率分别为0.245±0.010、45.4%±1.7%和99.2%±0.4%,均显著高于胃蛋白酶水解产物的对应值(P<0.05)。这可能是因为中性蛋白酶使得胃蛋白酶的酶切位点更加暴露,因而强化了胃蛋白酶对大豆乳清蛋白的水解,促进了更多抗氧化肽的释放[25-26]。综上,选择中性蛋白酶和胃蛋白酶顺序双酶组合作为水解大豆乳清蛋白的最适酶。
2.2 单因素实验
在“2.1”的实验结果的基础上,以中性蛋白酶和胃蛋白酶组合为最适酶,以DPPH 自由基清除率为指标,考察酶-底物比、大豆乳清蛋白浓度和酶解时间对大豆乳清蛋白水解产物抗氧化活性的影响。
如图2 所示,大豆乳清蛋白水解产物的总还原力数值偏低、而羟基自由基清除率的数值偏高,相比较而言DPPH 自由基清除率的数值较为适中。此外,当DPPH 自由基清除率较高时,总还原力和羟基自由基清除率也均较高,因而DPPH 自由基清除率可用于指示大豆乳清蛋白水解产物的抗氧化性。因此,为了简化实验过程,选取DPPH 自由基清除率作为抗氧化活性的表征指标[27]。
2.2.1 酶-底物比对酶解效果的影响 图3 展示了酶-底物比对大豆乳清蛋白水解液DPPH 自由基清除率影响的实验结果。方差分析结果显示酶-底物比对大豆乳清蛋白水解液DPPH 自由基清除率的影响显著(P<0.05)。具体结果如下:随着酶-底物比由2000 U/g 大豆乳清蛋白增加到6000 U/g 大豆乳清蛋白,大豆乳清蛋白水解液的DPPH 自由基清除率由33.2%±0.6%增加到53.0%±0.8%,随后降低到47.7%±0.7%。最大DPPH 自由基清除率出现在5000 U/g大豆乳清蛋白处。随着酶-底物比由2000 U/g 大豆乳清蛋白增加到5000 U/g 大豆乳清蛋白,酶与底物的结合量增加,酶解反应速率提高,促进了抗氧化肽的释放,因此DPPH 自由基清除率会逐渐提高。但是当酶-底物比过多时,释放的抗氧化肽会被过度水解,导致抗氧化活性降低[28],所以,当酶-底物比超过5000 U/g 大豆乳清蛋白时,DPPH 自由基清除率逐渐降低。鉴于上述结果,5000 U/g 大豆乳清蛋白选为最适酶-底物比。
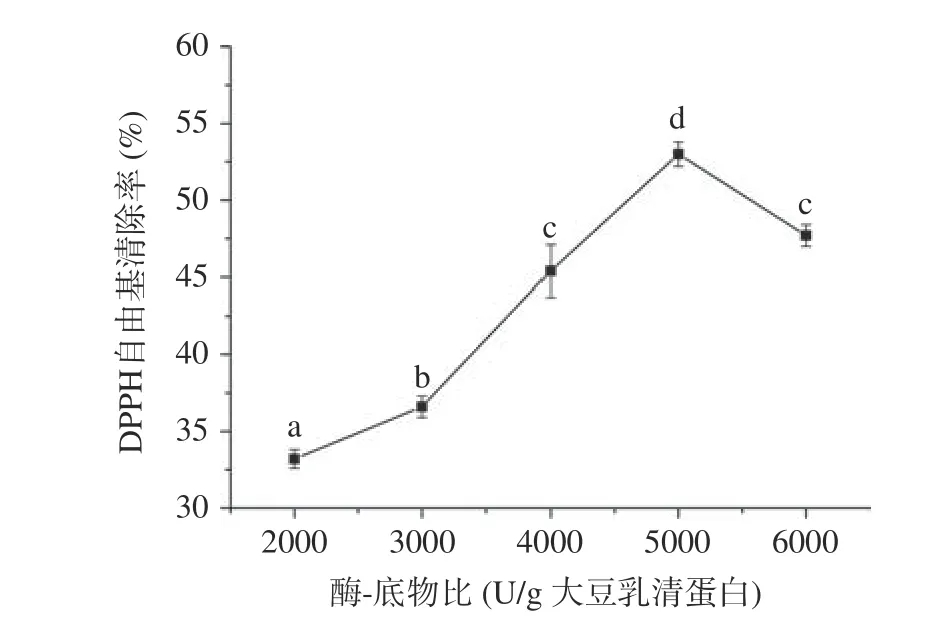
图3 酶-底物比对大豆乳清蛋白水解液DPPH 自由基清除率的影响Fig.3 Effect of enzyme-substrate ratio on scavenging rate of DPPH radical of whey soy proteins hydrolysates
2.2.2 大豆乳清蛋白浓度对酶解效果的影响 图4描述了大豆乳清蛋白浓度对大豆乳清蛋白水解液DPPH 自由基清除率影响的实验结果。由图4 可知,随着大豆乳清蛋白浓度由3 mg/mL 增加到9 mg/mL,大豆乳清蛋白水解液DPPH 自由基清除率由43.5%±0.7%增加到62.2%±0.6%(P<0.05)。随着大豆乳清蛋白浓度的继续增加,DPPH 自由基清除率未发生显著的变化(P>0.05)。当酶-底物比一定的情况下,由米氏方程可知,随着底物浓度的增加,酶催化反应速率会增加,但是当底物浓度增加到较大程度时,酶催化反应的速率增加速率较慢[29]。酶催化反应速率的增加,会强化抗氧化肽的释放,所以随着大豆乳清蛋白浓度的增加DPPH 清除率逐渐增加。当大豆乳清蛋白浓度超过9 mg/mL 时,酶催化反应速率不再大幅度增加,导致抗氧化肽释放变缓,导致DPPH 自由基清除率不再显著增加。综上,9 mg/mL 选择为最佳的底物浓度。
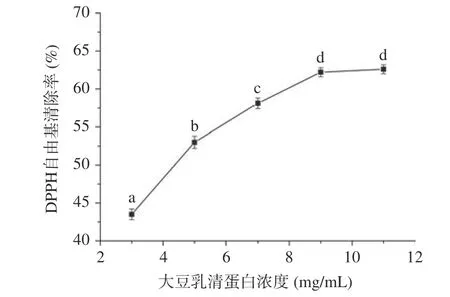
图4 大豆乳清蛋白浓度对大豆乳清蛋白水解液DPPH自由基清除率的影响Fig.4 Effect of whey soy proteins concentration on scavenging rate of DPPH radical of whey soy proteins hydrolysates
2.2.3 酶解时间对酶解效果的影响 酶解时间对大豆乳清蛋白水解液DPPH 自由基清除率影响的实验结果如图5 所示。随着酶解时间的增加,大豆乳清蛋白分子上的特异性位点逐渐被反应,水解液中抗氧化肽的释放量逐渐增加[30]。因此,随着酶解时间由4 h 增加到6 h 时,大豆乳清蛋白水解液DPPH 自由基清除率由46.9%±0.9%增加到62.2%±0.6%(P<0.05)。然而,随着酶解时间继续增加到8 h,DPPH自由基清除率降低到53.9%±0.9%。这可能是因为释放的抗氧化肽链上仍存在特异性位点,随着酶解时间的延长,大豆乳清蛋白分子上的特异性位点被完全反应,蛋白酶进一步与抗氧化肽结合,使得本来活性较高的抗氧化肽遭受了过度酶切,从而导致其活性降低[31]。综上,6 h 选择为最佳的酶解时间。
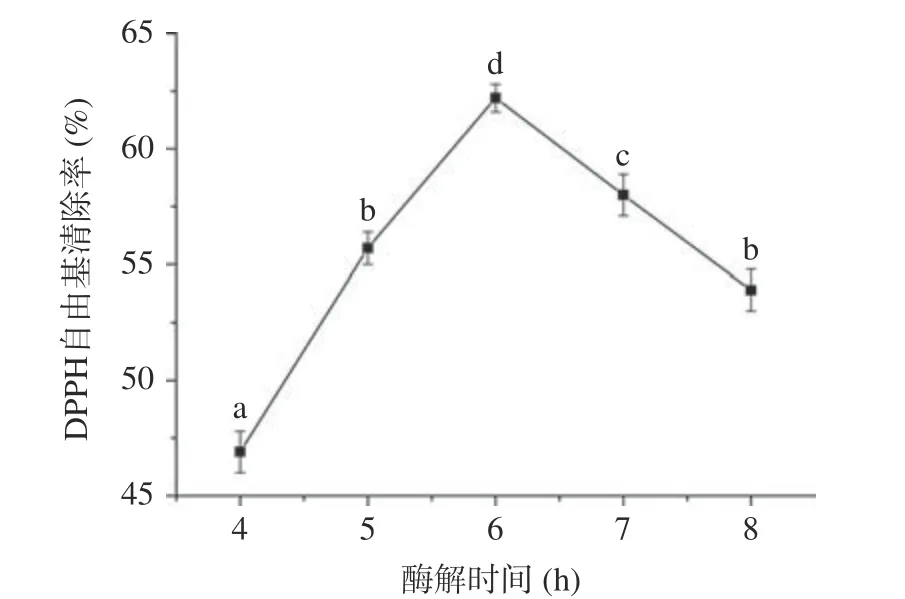
图5 酶解时间对大豆乳清蛋白水解液DPPH 自由基清除率的影响Fig.5 Effect of enzymatic hydrolysis time on scavenging rate of DPPH radical of whey soy proteins hydrolysates
2.3 响应面试验与分析
2.3.1 试验设计与结果 在2.2 小节单因素实验的基础上,以酶-底物比(A)、酶解时间(B)和大豆乳清蛋白浓度(C)为因素,以DPPH 自由基清除率(RDPPH)为响应值,进行三因素三水平的响应面试验设计,具体试验方案及结果如表3 所示。

表3 大豆乳清蛋白酶解响应面试验设计与结果Table 3 Response surface design and results for enzymatic hydrolysis of whey soy proteins
利用Design Expert V8.0.6.1 软件对表3 中的实际实验条件及对应结果进行多元回归拟合,得到拟合方程:RDPPH(%)=-481.13313+0.091863A+77.73250B+12.92625C-2.47500×10-3AB+9.00000×10-4AC-0.10000BC-7.84750×10-6A2-5.29750B2-0.89312C2。
2.3.2 方差分析 多元回归的方差分析结果如表4所示。分析结果表明,相对于残差,多元回归模型拟合所引起的变异极显著(P<0.01),失拟项所引起的变异不显著(P>0.05)。并且,多元回归的决定性系数和校正决定系数接近于1 且相差较小。由此可知,2.3.1 中所描述的多元回归方程模型能较好地预测和分析酶-底物比、酶解时间和大豆乳清蛋白浓度及其交互作用对大豆乳清蛋白水解液DPPH 自由基清除率的影响规律[32]。此外,模型方程中A、C、AB、A2、B2、C2对水解液DPPH 自由基清除率的影响极显著(P<0.01),而B 和AC 的影响显著(P<0.05)。通过对比F值大小,可知各因素对水解液DPPH 自由基清除率的影响顺序为:酶-底物比(A)>大豆乳清蛋白浓度(C)>酶解时间(B)。
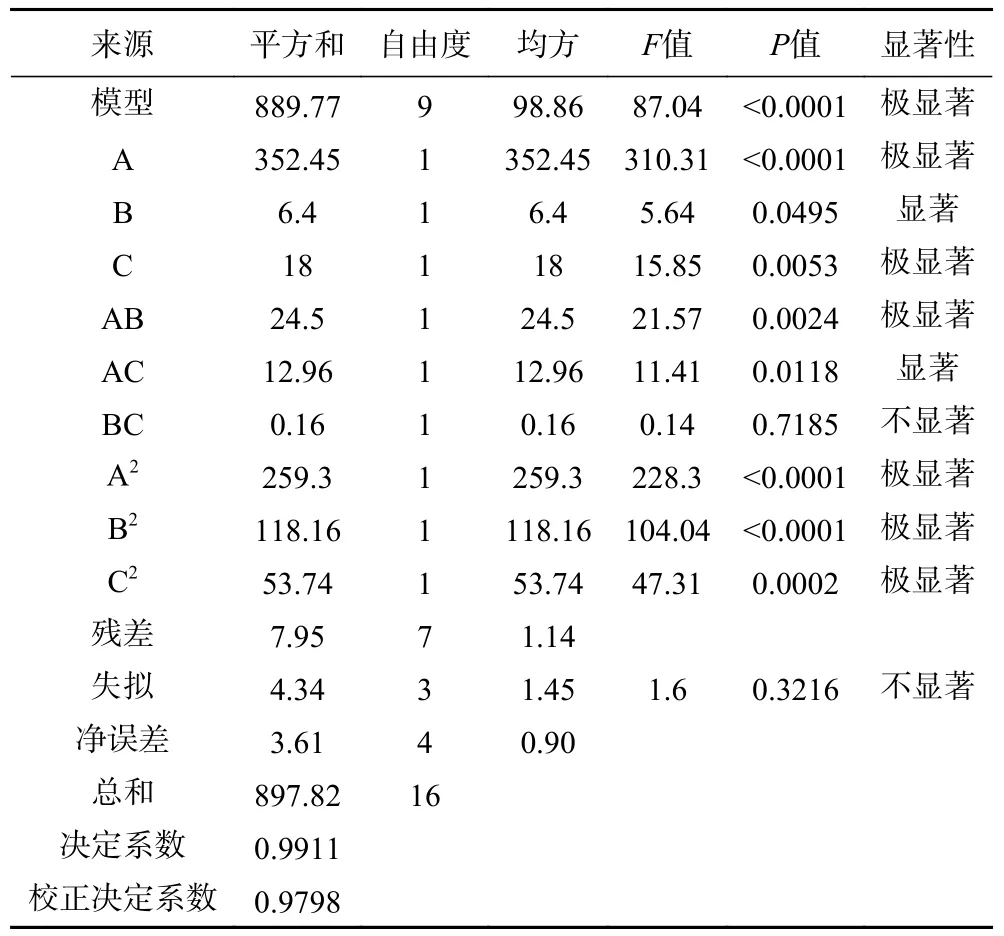
表4 多元回归的方差分析结果Table 4 Results of analysis of variance for multiple regression
2.3.3 双因素交互作用影响分析 酶-底物比、酶解时间和大豆乳清蛋白浓度三因素两两交互作用对大豆乳清蛋白水解液DPPH 自由基清除率影响的结果如图6 所示。由图6 可知,随着各因素的增大,DPPH自由基清除率均是先升高然后降低,与单因素实验结果相一致。对比图6a~图6c 可知,DPPH 自由基清除率随酶-底物比和酶解时间以及酶-底物比和大豆乳清蛋白浓度变化的曲面较为陡峭,且其等高线呈现椭圆形;而DPPH 自由基清除率随酶解时间和大豆乳清蛋白浓度变化的曲面则较为平缓,且其等高线则近似于圆形。以上结果表明,酶-底物比和酶解时间的交互作用和酶-底物比和大豆乳清蛋白浓度的交互作用对大豆乳清蛋白水解液DPPH 自由基清除率的影响显著,而酶解时间和大豆乳清蛋白浓度对大豆乳清蛋白水解液DPPH 自由基清除率的影响不显著[33]。
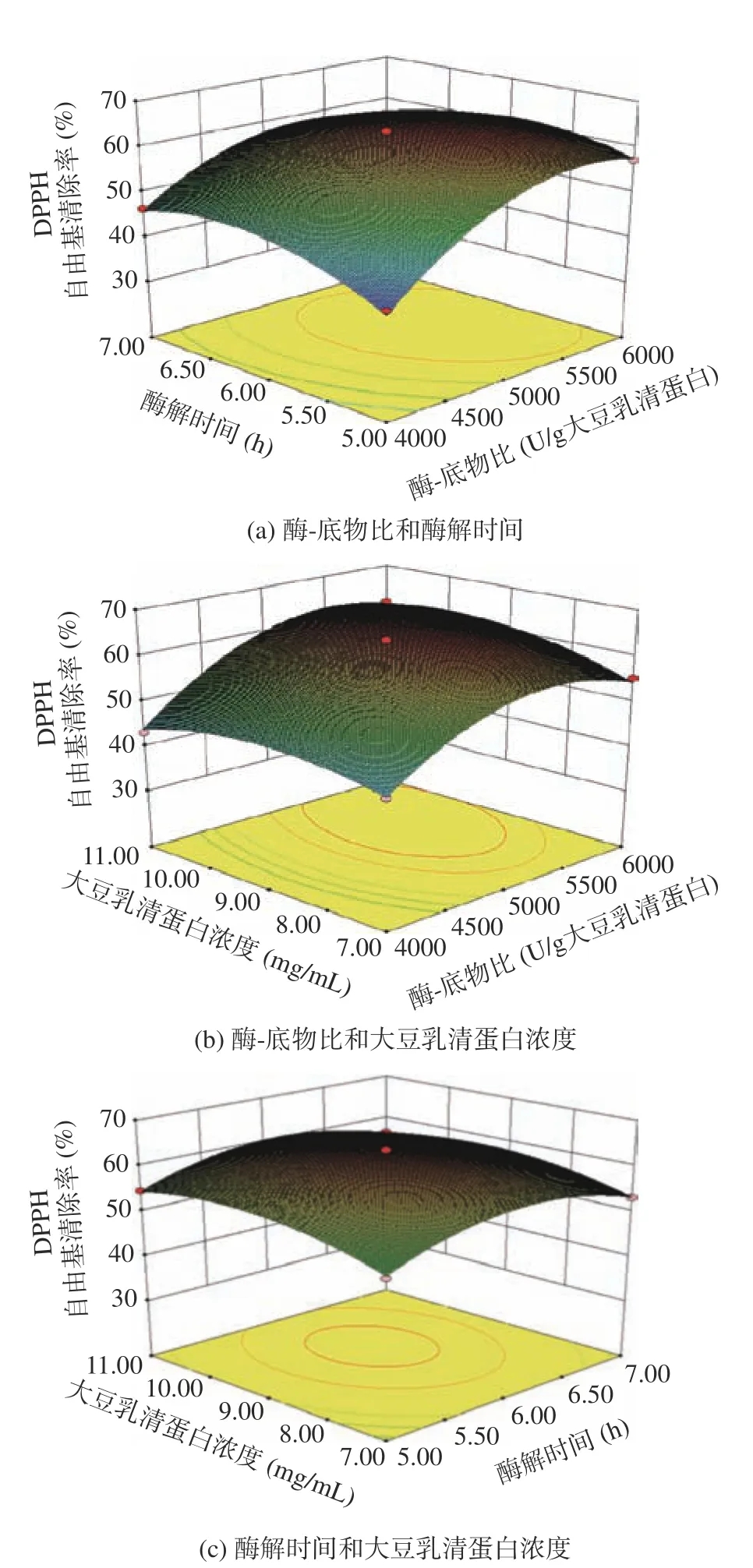
图6 酶-底物比、酶解时间和大豆乳清蛋白浓度交互作用对大豆乳清蛋白水解液DPPH 自由基清除率影响的曲面图Fig.6 Surface maps for effects of interactions among enzymesubstrate ratio,hydrolysis time and whey soy proteins concentration on scavenging rate of DPPH radical of whey soy proteins hydrolysates
2.3.4 最佳酶解工艺参数的确定 利用Design Expert V8.0.6.1 软件对大豆乳清蛋白酶解工艺进行优化,得出理论最佳工艺参数为酶-底物比5000 U/g 大豆乳清蛋白、酶解时间6 h 和大豆乳清蛋白浓度9.0 mg/mL,对应的DPPH 自由基清除率预测值为62.52%。按照上述实验条件,进行3 次验证性实验,测定DPPH 自由基清除率为62.3%±1.1%,与预测值相近,说明该拟合模型所优化出的大豆乳清蛋白酶解工艺条件较为准确。
2.4 大豆乳清蛋白抗氧化肽的体外抗氧化活性评价
在“2.3.4 小节”所确定的最佳工艺条件下,对大豆乳清蛋白进行水解。水解产物经离心去除固体杂质后,利用截留分子量为30 kD 的超滤管分离上清液中的抗氧化肽,冻干后溶于纯净水中配制成不同浓度的抗氧化肽溶液。以抗坏血酸溶液为参比,测定抗氧化肽溶液的总还原力、DPPH 自由基清除率和羟基自由基清除率。实验结果如图7 所示。由图可知,随着浓度的增加,大豆乳清蛋白抗氧化肽和抗坏血酸的总还原力、DPPH 自由基清除率和羟基自由基清除率都显著增加(P<0.05)。此外,在同一浓度下,抗氧化肽的总还原力和DPPH 自由基清除率均显著低于抗坏血酸的对应数值(P<0.05),而羟基自由基清除率随抗坏血酸和抗氧化肽浓度变化的趋势较为接近。利用Origin Pro 9.0 软件对图7 中总还原力、DPPH 自由基清除率和羟基自由基清除率随浓度变化的数据进行多项式拟合,拟合结果如表5 所示,其结果均显著(P<0.05)。利用拟合公式分别计算总还原力为0.5,DPPH 自由基清除率和羟基自由基清除率为50%时所需的大豆乳清蛋白抗氧化肽和抗坏血酸溶液用量,即为半数有效量 IC50[34]。计算结果显示,大豆乳清蛋白抗氧化肽总还原力、DPPH 自由基清除率和羟基自由基清除率的IC50值分别为0.128、0.221 和0.185 mg/mL,分别是抗坏血酸IC50值的2.56、40.76、1.47 倍,表明抗氧化肽的活性略低于抗坏血酸。综合来看,大豆乳清蛋白抗氧化肽有较好的抗氧化活性。
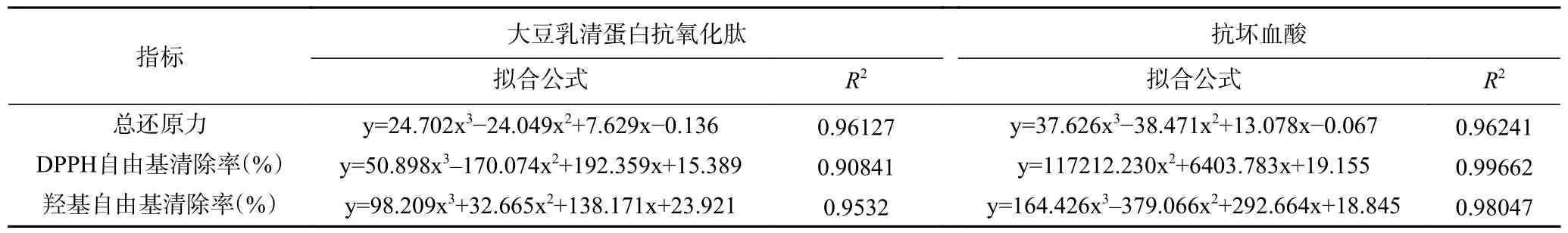
表5 图7 中数据的多项式拟合结果Table 5 Polynomial fitting results of the data in figure 7
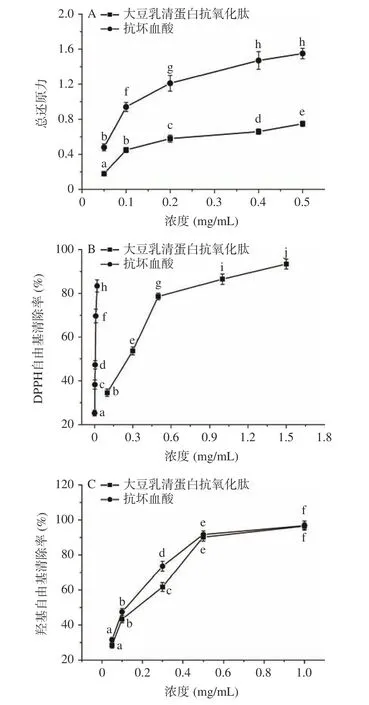
图7 总还原力(A)、DPPH 自由基清除率(B)和羟基自由基清除率(C)随大豆乳清蛋白抗氧化肽与抗坏血酸浓度的变化曲线Fig.7 Variations of total reducing force (A),scavenging rate of DPPH radical (B) and scavenging rate of hydroxyl radical (C)with concentrations of whey soy proteins antioxidative peptides and ascorbic acid
3 结论
在超声恒温反应体系中,采用单因素实验和响应面试验设计确定了酶解大豆乳清蛋白制备抗氧化肽的最佳工艺条件。即中性蛋白酶和胃蛋白酶顺序酶解为水解大豆乳清蛋白的最适酶,酶-底物比5000 U/g 大豆乳清蛋白、酶解时间6 h 和大豆乳清蛋白浓度 9.0 mg/mL。在此条件下,大豆乳清蛋白水解液的DPPH 自由基清除率为62.3%±1.1%。利用超滤从水解液中分离出分子量小于30 kDa 的抗氧化肽,其总还原力、DPPH 自由基清除率和羟基自由基清除率IC50值分别为0.128、0.221 和0.185 mg/mL,分别是抗坏血酸IC50值的2.56、40.76 和1.47 倍,表明抗氧化肽的活性略低于抗坏血酸。综上可得,大豆乳清蛋白可用于制备抗氧化活性较好的活性肽,这对有效提高大豆乳清蛋白的应用价值有重要的意义。
