Box-Behnken 设计-响应面法优化桔梗醇提工艺及醇提物美白活性分析
2023-10-19蔡铁全庞会娜黄意情万志强严铭铭
蔡铁全,庞会娜,黄意情,万志强,,严铭铭,3,
(1.国家市场监督管理总局食品审评中心,北京 100070;2.长春中医药大学东北亚中医药研究院,吉林长春 130117;3.吉林省中药保健食品科技创新中心,吉林长春 130117)
桔梗为桔梗科植物桔梗(Platycodon gradiflorum(Jacq.)A.DC.)的干燥根,始载于《神农本草经》,被列为下品[1-2],具有利咽,宣肺[3-4],祛痰[5],排脓等功效,为我国卫生部批准的药食兼用中药材之一[6]。现代研究表明,桔梗的化学成分主要包括皂苷类[7]、黄酮类[8]、脂肪油、脂肪酸[9]、无机元素[10]等成分,具有抗氧化[11]、降血糖[12]、抗肿瘤[13]等生物活性。经查阅文献可知,近年来桔梗研究主要集中在抗肿瘤、心血管保护及提高人体免疫力方面[14],而在桔梗美白活性方面的研究上,除本课题组前期研究外并未见其相应的研究。
人体的皮肤颜色除了受遗传因素的影响外,还会受到外界因素的影响,如紫外线、光照时间、海拔等,而这些因素就是造成肤色差异的原因。自古以来,中国女性就有对美的追求,所以对色素沉着、雀斑等皮肤问题也越来越重视,从而使美白成为人们生活中不可或缺的一部分[15]。传统的美白剂(氢醌、铅粉等)细胞毒性大,副作用较强,已经无法满足现代人追求美白所要求的安全、滋润、温和等条件,同时“致癌”事件屡发也让人们对美白产品安全性的担忧日益增加。随着美白保健品的研究与开发,发现从植物中提取的活性成分更具有安全、高效的特性,其作为美白保健产品的有效组分深入人心。如今,研发更多天然植物原料已是美白保健品领域研究的热点之一[16-17]。
我国作为桔梗生产大国,在桔梗美白保健品的研发方面具有很大上升空间,因此,从桔梗中寻找和提取功能性物质对桔梗美白保健品的研究与开发具有重要意义。因此,本实验以酶抑制活性和抗氧化为考察指标,优化桔梗醇提工艺,探究桔梗醇提物体外美白功效,为其进一步研究提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
桔梗药材(批号:C359180401b)吉林省仙草医药药材有限公司,经长春中医药大学药学院姜大成教授鉴定为桔梗科植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根;B16F10 小鼠黑色素瘤细胞 中国上海生物科学研究所细胞资源中心;桔梗皂苷D 标准品(批号:24588-201708)、熊果苷对照品(批号:21402-201823)、桔梗对照药材(批号:121028-201612)中国食品药品检定研究院;氢氧化钠、DPPH、ABTS+、过二硫酸钾、乙酰丙酮、埃尔利希国药集团化学试剂有限公司;酪氨酸酶(≥500 U/mg)、L-酪氨酸、透明质酸酶(400~1000 U/mg)、透明质酸钠 北京索莱宝科技有限公司。
ALB-224 万分之一分析天平、AB265-S 十万分之一分析天平 赛多利斯科学仪器有限公司;KQ-250 超声波清洗器 昆山市仪器有限公司;HX-400A高速中药粉碎机 浙江省永康市溪岸五金药具厂;LC-2010AHT 高效液相色谱仪 日本岛津公司;ELSD 6000 蒸发光散射检测器 Alltech CHROM Thermo;DZTW 电子调温电热套 北京市永光明医疗仪器有限公司。
1.2.1 桔梗醇提物的制备 将桔梗药材进行粉碎,过65 目,称取适量药粉,加8 倍量的95%乙醇,加热回流提取3 次,每次1.5 h,滤过,合并滤液,浓缩至浸膏,80 ℃干燥,粉碎,过80 目,即得桔梗醇提物(PGE-ME5)[18]。
1.2 实验方法
1.2.2 指标的测定
1.2.2.1 桔梗总皂苷提取率的测定 参考但汉龙等[19]的方法,稍作修改,分别吸取0.5 mg/mL 的桔梗皂苷D 对照品0、0.2、0.4、0.6、1.2、1.4 mL,挥干后,首先加入0.2 mL 5%香草醛-冰醋酸溶液,然后加入0.8 mL 的高氯酸,混匀之后于水浴中以60 ℃的温度加热15 min,放冷后加入冰醋酸5 mL 震荡混匀后,于550 nm 处测定其吸光度值并记录。将桔梗皂苷D 取样量的质量和吸光度值分别作为横坐标和纵坐标,所得到的标准曲线为Y=0.0016X+0.0148,R2=0.9992。精密配制1.0 mg/mL 的桔梗醇提物,按照上述方法进行测定,桔梗总皂苷提取率的计算公式如下:
式中:Y 为样品的吸光度值;m 为所测样品对应药材的质量,mg。
1.2.2.2 桔梗皂苷D 提取率的测定 桔梗皂苷D 提取方法按2015 年版《中国药典》项下方法提取,测定前过0.45 μm 有机滤膜,采用高效液相色谱-蒸发光散射检测器(HPLC-ELSD)法对其进行测定,选用反向C18 色谱柱(4.6 mm×250 mm),选用乙腈和水作为流动相,以1.0 mL/min 流速进行等度洗脱,流动相乙腈:水的比例为25:75,蒸发光散色检测器的温度是103.8 ℃,气体流量为2.8 L/min。对照品溶液进样量为5、10 μL,供试品溶液进样量为15 μL,采用外标两点法对数方程进行计算[18],所得标准曲线为Y=2.8978X+13.362,R2=0.9994,桔梗皂苷D 的提取率计算公式如下:
式中:Y 为样品的吸光度值,m 为所测样品对应药材的质量,mg。
1.2.2.3 熊果苷提取率的测定 精密称取0.5 g 桔梗醇提物于具塞锥形瓶中,加甲醇提取溶剂10 mL,称重,超声30 min 进行提取,放至室温后补足失重,含量测定前过0.45 μm 有机滤膜,选用反向C18 色谱柱(4.6 mm×250 mm),采用HPLC-ELSD 法测定熊果苷单体,以乙腈和0.1%甲酸水作为流动相(乙腈:0.1%甲酸水=5:95),以0.8 mL/min 的流速等度洗脱,蒸发光散色检测器的温度为105 ℃,气体流量是2.8 L/min。对照品溶液进样量为5、10 μL,供试品溶液进样量为15 μL,采用外标两点法对数方程计算[18],所得标准曲线为Y=4.3033X+12.762,R2=0.9996,熊果苷的提取率计算公式如下:
式中:Y 为样品的吸光度值,m 为所测样品对应药材的质量,mg。
1.2.3 单因素实验 溶媒量8 倍,提取时间1 h,提取次数3 次作为固定的反应条件,选择提取时间(0.5、1、1.5、2、2.5 h)、提取次数(1、2、3、4 次)、溶媒量(6、7、8、9、10 倍)进行单因素实验,平行3 次,考察其对桔梗总皂苷、桔梗皂苷D、熊果苷的提取率的影响。
1.2.4 响应面设计试验 根据单因素实验结果,以提取次数(A)、提取时间(B)、溶媒量(C)为影响因素,以桔梗总皂苷、桔梗皂苷D、熊果苷的提取率为综合评分(综合评分=(30%×桔梗皂苷D 提取率/桔梗皂苷D 提取率最大值+30%×熊果苷提取率/熊果苷提取率最大值+40%×桔梗总皂苷提取率/桔梗总皂苷提取率最大值)×100)作为评价指标(Y),用Box-Behnken进行响应面试验设计[20-23],因素水平见表1。
1.2.5 桔梗醇提物美白活性研究
1.2.5.1 酪氨酸酶活性抑制实验 根据文献修改如下[24],用磷酸缓冲溶液将待测样品和熊果苷配制成质量浓度为3.125、6.25、12.5、18.75、25 mg/mL 的溶液备用,在96 孔板中设置240 μL 总反应体系(见表2),按照表2 数据将试剂依次加入,震荡混匀后,37 ℃水浴中反应20 min 后,于475 nm 下测定吸光度,酪氨酸酶抑制率计算公式如下:

表2 酪氨酸酶催化反应体系(μL)Table 2 Tyrosinase catalytic reaction system (μL)
酪氨酸酶抑制率(%)=[(A-B)/(C-D)]/(A-B)×100
式中:A:等量缓冲液代替样品溶液的吸光度;B:等量缓冲液代替样品溶液和酪氨酸酶溶液的吸光度;C:样品溶液吸光度;D:等量缓冲液代替酪氨酸酶溶液的吸光度。
1.2.5.2 透明质酸酶活性抑制实验 采用Elson-Morgan 法进行透明质酸酶体外抑制实验,用pH5.6 的醋酸缓冲溶液配置透明质酸钠(0.5 mg/mL)、透明质酸酶(600 U/mL)及待测样品(3.125、6.25、12.5、18.75、25 mg/mL)溶液待用,将0.2 mL CaCl2溶液与0.5 mL的透明质酸酶溶液混匀后于37 ℃下孵育20 min,然后加入待测样品溶液0.5 mL,37 ℃下孵育20 min,加入0.5 mL 的透明质酸钠溶液37 ℃孵育30 min,取出后加入0.1 mL 的NaOH,冰水浴中冷却8 min,加入0.1 mL 的埃尔利希,常温下放置20 min 后,于555 nm 下测定吸光度[18]。透明质酸酶抑制率计算公式如下:
透明质酸酶抑制率(%)=[(A-B)/(C-D)]/(A-B)×100
式中:A:醋酸缓冲液代替样品的吸光度;B:醋酸缓冲液代替样品和透明质酸酶的吸光度;C:样品吸光度;D:醋酸缓冲液代替透明质酸酶的吸光度。
1.2.5.3 细胞黑色素生成抑制活性 将B16F10 黑色素瘤细胞接种到24 孔的培养板中,每个孔的细胞个数为1×104个,细胞贴壁后,加入α-黑素细胞刺激激素(100 nmol/Lα-MSH)继续培养48 h,然后加入不同浓度(100、150、200 μg/mL)的PGE-ME5 提取物和熊果苷,分别培养24、48、72 h,每组5 个复孔,给药时间结束后,去除培养基,用PBS(pH7.2)洗涤细胞两次,加入200 μL 含有1% tritonx-100 的PBS,通过冷冻和解冻使细胞破裂。以12000 r/min 离心30 min 后去除上清液,在细胞颗粒中加入300 μL 含10%二甲基亚砜的1 mol/L NaOH,在80 ℃下反应2 h 以溶解细胞的黑色素[25],使用酶标仪在450 nm处测量溶解的黑色素的吸光度值。
黑色素抑制率(%)=(给药组A450-空白组A450)/(对照组A450-空白组A450)×100
1.2.6 桔梗醇提物体外抗氧化活性研究
1.2.6.1 DPPH 自由基清除能力测定 根据文献[26]修改如下:将配制好的桔梗醇提物溶液2 mL 加入到2 mL 0.004% 的DPPH 溶液中,涡旋,避光反应30 min 后,于517 nm 下测定吸光度值A1;以等量乙醇溶液代替DPPH 溶液,得吸光度值A2;以等量蒸馏水代替样品溶液作为空白对照,得吸光度值A0。以VC作为阳性对照。按下列公式计算:
DPPH 自由基清除率(%)=(A0-A1+A2)/A0×100
1.2.6.2 ABTS+自由基清除能力测定 根据文献[27]修改如下:使用pH7.4 PBS 缓冲溶液对ABTS+工作液进行稀释,使其在734 nm 处的吸光度值范围在0.5~0.9 之间即可;取10 μL 桔梗醇提物样品溶液与0.2 mL ABTS+工作液进行混合,室温下避光反应6 min,于734 nm 波长测定吸光度,以VC为阳性对照,按下列公式计算:
ABTS+自由基清除率(%)=[(A0-A1)/A0]×100
式中:A1:样品+ABTS+测得的吸光度值;A0:PBS+ABTS+测得的吸光度值。
1.3 数据处理
所有实验均重复3 次,采用Origin 2019 和Design-Expert V8.0.6 进行实验数据分析及图像绘制。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取次数对桔梗醇提物桔梗皂苷D、熊果苷、桔梗总皂苷提取率的影响 结果如图1 所示,桔梗美白活性提取物中桔梗皂苷D、熊果苷、桔梗总皂苷的提取率的高低与提取次数有关,随着提取次数的增加,各指标性成分的提取率呈现先升高后趋于平缓的趋势,当提取次数小于3 时,各指标性成分随着提取次数的增加,其提取率显著升高(P<0.01),当提取次数达到3 次时,桔梗总皂苷的提取率基本达到最高值。其原因可能是当提取次数较低时,各指标性成分并未完全溶出,因此当提高提取次数时,目标提取物的提取率则会相应的提高,当提取次数达到一定值时,各指标性成分的提取率会达到最高值,因此再增加提取次数时,各个指标成分的提取率将增加不明显。考虑到当提取次数达到3 时,桔梗皂苷D 和熊果苷的提取率并未达到最高值,因此选择2、3、4 次进行响应面优化分析。

图1 提取次数对桔梗醇提物各指标成分提取率的影响Fig.1 Effect of extraction times on extraction rate of each index component of Platycodon grandiflorum ethanol extract
2.1.2 提取时间对桔梗醇提物桔梗皂苷D、熊果苷、桔梗总皂苷提取率的影响 提取时间是影响各指标性成分提取率的关键因素之一,充足的提取时间有利于各指标性成分的溶出。结果如图2 所示,桔梗醇提取物中,桔梗皂苷D 和熊果苷的提取率在测定时间内(0.5~2.5 h)变化不显著(P>0.05),当提取时间在0.5~1.0 h 时,桔梗总皂苷的提取率显著升高(P<0.01),而当提取时间到达1.0~2.5 h 时,桔梗总皂苷的提取率基本保持不变,其原因可能是随着时间的进一步增加,溶解度达到饱和时,桔梗总皂苷不再被溶解,提取率不再有明显提高[28]。因此选择0.5、1.0、1.5 h 进行响应面优化分析。

图2 提取时间对桔梗醇提物各指标成分提取率的影响Fig.2 Effect of extraction time on extraction rate of each index component of Platycodon grandiflorum ethanol extract
2.1.3 溶媒量对桔梗醇提物桔梗皂苷D、熊果苷、桔梗总皂苷提取率的影响 溶媒量是影响细胞内外渗透压的主要因素,适当的溶媒量对各指标性成分的溶出是有利的,还可以节约提取溶液[29]。从图3 中可以看出,当溶媒量为6 倍时,桔梗总皂苷的提取率明显较低,而后随着溶媒量的增加各指标性成分的提取率有了一定的提高,其中当溶媒量由6 提高到8 时,桔梗总皂苷的提取率显著升高(P<0.01)。这是因为适当增大溶媒量,能扩大指标性成分在桔梗内外的浓度差,有利于指标性成分的溶出,但溶媒量对于各指标性成分溶出的增强效应也是有一定的界限的,因此当达到一定的溶媒量时,再继续提高溶媒量也不会显著地增加指标性成分的提取率[30]。因此选择7、8、9 倍进行响应面优化分析。

图3 溶媒量对桔梗醇提物各指标成分提取率的影响Fig.3 Effect of solvent amount on extraction rate of each index component of Platycodon grandiflorum ethanol extract
2.2 响应面试验结果
2.2.1 回归模型的建立与数据分析 在单因素实验基础上,根据单因素实验结果,以提取次数(A)、提取时间(B)、溶媒量(C)为影响因素,以桔梗总皂苷、桔梗皂苷D、熊果苷提取率的综合评分(Y)为响应值,采用Design-Expert 8.0.6 软件进行3 因素3 水平共17 个试验设计,结果如表3 所示,得到关于提取次数(A)、提取时间(B)和溶媒量(C)综合评分的二元多项回归方程:Y=9.68-0.08A-0.036B+0.32C-2.50E-0.3AB+0.023AC-0.015BC-0.95A2-0.44B2-0.27C2。

表3 Box-Behnken 响应面试验设计与结果Table 3 Box-Behnken response surface test design and results
对所得实验数据模型进行方差分析,结果如表4所示。结果表明,本模型的F值为110.73,P<0.0001,模型显著;失拟项F值为0.095,P值为0.9591>0.05,失拟不显著;模型的调整决定系数R2adj值为0.9158,拟合度较高,表明本模型对综合评分进行的分析和预测是准确有效的。由回归模型和方差分析可知,方程一次项A、C 对综合评分的影响达到显著水平(P<0.05);方程二次项A2、B2、C2对综合评分的影响达到极显著水平(P<0.01),而AB、AC、BC 之间的交互作用对综合评分的影响并不显著,根据F值可知,各因素对综合评分影响的大小顺序为:C(溶媒量)>A(提取次数)>B(提取时间)。

表4 二次回归模型方差分析结果Table 4 Results of variance analysis of quadratic regression model
2.2.2 验证实验 运用Design-Expert V8.0.6 软件对模型进行解析,得到了一组桔梗醇提物的最佳提取条件:提取次数2.96 次,提取时间0.97 h,溶媒量8.58 倍。根据工业化生产等实际情况进行调整,最终确定的最佳工艺参数为:提取次数3 次,提取时间1 h,溶媒量8 倍。按照上述优选提取工艺参数制备的提取物作为桔梗最佳美白活性提取物(PGEME5)。通过三次平行验证实验得,PGE-ME5 中桔梗皂苷D、熊果苷、桔梗总皂苷的提取率,与预测值相差不大,指标性成分桔梗皂苷D、熊果苷、桔梗总皂苷的提取率分别为0.122%±0.003%、0.128%±0.005%、0.582%±0.007%,表明工艺合理稳定,可为后续相关规模化生产奠定基础。
2.3 PGE-ME5 美白活性实验结果
2.3.1 对酪氨酸酶及透明质酸酶的抑制结果 熊果苷是常见的美白剂,它通过竞争性抑制人类酪氨酸酶活性而减少色素沉着,在研究中常用作阳性对照[31],PGE-ME5 对酪氨酸酶及透明质酸酶的抑制效果如图4 所示,实验结果表明,随着PGE-ME5 的浓度升高,其对酪氨酸酶及透明质酸酶的抑制率呈上升的趋势,与阳性药熊果苷相比,当给药浓度为18.75 mg/mL时,其抑制效果相当,抑制率分别为92.39%、88.26%,其原因可能是PGE-ME5 中含有多种美白活性成分(熊果苷、桔梗总皂苷等),因此表现出良好的美白活性。

图4 PGE-ME5 对酪氨酸酶及透明质酸酶抑制率Fig.4 Inhibition rate of PGE-ME5 on tyrosinase and hyaluronidase
2.3.2 抑制细胞黑色素结果 与空白对照组比较,以100 nmol/Lα-MSH 刺激的B16F10 细胞(对照组)的黑色素含量明显高于未刺激的细胞,表明造模成功;随着PGE-ME5 提取物浓度的增加,使α-MSH 刺激的B16F10 细胞中黑色素含量呈剂量依赖性显著减少。当给药时间为48 h 时,α-MSH 刺激的B16F10细胞中黑色素生成抑制效果最佳,结果见图5。

图5 PGE-ME5 对细胞黑色素的抑制率Fig.5 Inhibition rate of PGE-ME5 on cell melanin
2.4 PGE-ME5 体外抗氧化活性实验结果
PGE-ME5 对DPPH·、ABTS+自由基清除效果如图6 所示,实验结果表明,随着PGE-ME5 的浓度升高,其对DPPH·及ABTS+自由基的清除率呈上升的趋势,与阳性药VC相比,其抑制效果相当,当给药浓度达到3.13 mg/mL 时,对DPPH 自由基的清除率达到最高值为97.19%,当给药浓度达到4.69 mg/mL时,对ABTS+自由基的清除率达到最高值为80.57%,该实验结果表明PGE-ME5 具有良好的抗氧化活性。
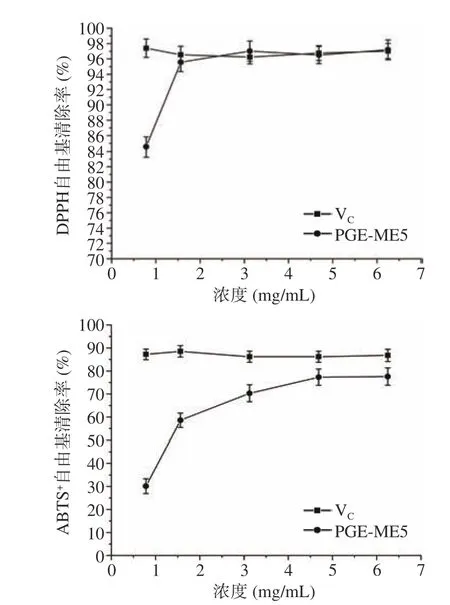
图6 PGE-ME5 对DPPH、ABTS+自由基的清除能力Fig.6 Scavenging ability of PGE-ME5 to DPPH and ABTS+free radicals
3 结论
本研究利用响应面法对桔梗醇提工艺进行了优化,得到最佳提取工艺为:提取次数3 次,提取时间1 h,溶媒量8 倍,在此条件下提取得到的桔梗美白活性提取物(PGE-ME5)中桔梗皂苷D、熊果苷、桔梗总皂苷的提取率分别为0.122%±0.003%、0.128%±0.005%、0.582%±0.007%。美白功效评价结果显示,PGE-ME5具有良好的美白活性,对酪氨酸酶和透明质酸酶的抑制率分别为92.39%和88.26%,此时的给药浓度为18.75 mg/mL,且对B16F10 细胞中黑色素的生成具有良好的抑制效果。抗氧化结果表明,PGE-ME5 具有良好的抗氧化活性,对DPPH·、ABTS+自由基的清除率,分别为97.19%、80.57%。
皮肤的颜色主要是由黑色素决定的。当细胞受到内源性刺激物作用时,就会激活酪氨酸酶,促进黑色素的生成[32]。另外,活性氧(ROS)在黑色素生成过程中也起到十分重要的作用,ROS 在酪氨酸酶催化氧化过程中既是引发剂也是反应物,并通过相关蛋白的作用来诱导黑色素合成基因的表达,从而导致黑色素含量的升高[33]。故抑制酪氨酸酶活性、抗氧化是目前公认美白的两个关键靶点。
DPPH 法及ABTS 法为两大常用的体外抗氧化评价实验,广泛用于评价植物提取物的抗氧化性能[34]。而本实验发现PGE-ME5 在抗氧化、抑制酪氨酸酶活性上均显示出良好的作用,由此初步得出,桔梗醇提物作为一种抗氧化剂可能是通过阻断或减弱酪氨酸酶活性、抑制酶表达,从而达到协同美白效果,具体的美白作用机制还需进一步研究,综上所述,PGE-ME5 具有良好的美白及抗氧化活性,因此,桔梗醇提物可能会成为潜在的天然美白活性成分,用于美白保健产品的研发。
