利用毕赤酵母底盘产生大麻二酚酸合成酶及其催化活性分析
2023-10-19牛庭莉张利国张树权李志江高宝昌戴凌燕
牛庭莉,田 媛,张利国,张树权,李志江,康 悦,迟 建,高宝昌,,戴凌燕,
(1.黑龙江八一农垦大学生命科学技术学院,黑龙江大庆 163319;2.黑龙江省科学院大庆分院植物化学研究所,黑龙江大庆 163316;3.黑龙江省农业科学院经济作物研究所,黑龙江哈尔滨 150086;4.黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
大麻是一年生麻科草本植物,被称为大麻或汉麻,在世界各地种植已有数千年,主要应用在医药、化工和食品领域[1-2]。天然产物大麻素是大麻植物产生的独特次级代谢物,主要存在于大麻的毛状体油室中,是由聚酮和单萜亚结构组成。目前为止,已分离出100 多种大麻素[3]。其中,酸性大麻素四氢大麻酚酸(THCA)、大麻二酚酸(CBDA)和大麻环萜酚酸(CBCA)含量最丰富,且三者均以CBGA 为底物经酶催化而成。其他类型大麻素大多是由这三种物质在热和光照下通过非酶转化、降解反应和自氧化等方式获得[4-5]。在这些代谢物中,具有精神活性的Δ9-四氢大麻酚(THC)[6],由于具有潜在的治疗价值,包括镇痛、抗惊厥、止吐和开胃性而备受关注[7-8]。大麻二酚(CBD)是一种与THC 具有不同环状结构的同分异构体,近年来在治疗阿尔兹海默病、帕金森病、癫痫,以及抗肿瘤和神经保护等方面发挥着重要作用[9-11]。此外,CBD 在食品和化妆品上的应用也比较广泛。CBD 油可缓解焦虑,CBD 糖浆可以安神和缓解疼痛,CBD 苏打水可以舒缓痛症和调节亚健康问题;还有加入适量CBD 的饼干、巧克力、啤酒、披萨等食品,具有独特香气,让人身心愉悦[12];含有CBD 的化妆品具有舒缓皮肤敏感,抗炎及治疗粉刺等作用[13]。但目前CBD 原料短缺、价格高昂、生物提取得率低等问题,限制了其产业发展和应用领域拓展。
酵母表达系统在上个世纪70 年代被发现,在2006 年经美国FDA 批准,获得“最安全微生物”称号[14-15]。毕赤酵母(Pichia pastoris)是在甲醇培养基中生长的一种甲基营养菌,可利用AOX1 启动子来驱动外源蛋白的高水平表达[16-17]。酵母异源表达系统有许多优点,发酵培养基取材稳定、成本低廉、繁殖快速;与细菌相比,具有翻译后修饰,易于遗传操作等优势[18]。外源目的基因线性化后,利用同源重组方式可将外源基因高效整合到酵母细胞的染色体中,产生稳定的细胞系[19-23]。
大麻二酚酸合成酶(CBDAS)可催化底物CBGA生成CBDA,而CBDA 在高温下易脱羧形成CBD。以大麻花叶为材料生物提取大麻素的粗提液中含有很多组分,其中还有一定含量的CBGA 未被完全转化。若能利用操作简便,经济高效的方法获得CBDAS,便可通过体外反应将粗提液中残存的CBGA 进一步单一转化成CBD。本研究以高含量CBD 品种为材料,采用PCR 克隆技术获得CBDAS基因,并构建酵母表达载体,在毕赤酵母中重组表达,利用高效液相色谱分析CBDAS 合成酶的催化活性。研究结果可为工业化定向提高CBD 生物提取率奠定理论基础。
1 材料与方法
1.1 材料与仪器
大麻材料 由黑龙江省农业科学院经济作物所提供;毕赤酵母GS115 和大肠杆菌DH5α感受态购自昂羽生物技术(上海)有限公司;pPIC9K-His 载体 购自淼灵生物技术(武汉)有限公司;GreenGate克隆载体C000 本实验室保存;植物DNA 提取试剂盒 天根生化科技(北京)公司;质粒提取试剂盒索莱宝科技(北京)有限公司;胶回收试剂盒 Omega(美国)公司;限制性内切酶EcoRI、NotI、SacI 和PstI NEB(美国)公司;高保真酶Phanta Super-Fidenlity DNA Polymerase 诺唯赞生物科技(南京)有限公司;ThunderbirdTM SYBR® qPCR Mix TOYOBO(日本)公司。
5428 高速冷冻离心机 德国艾本德公司;Veriti96梯度PCR 扩增仪 美国赛默飞公司;HB-96D 恒温槽 韩国WiseTherm 公司;HV-50 高压蒸汽灭菌器 日本Hirayama 公司;V-1300 可见光分光光度计 上海美析仪器公司;NS-100B 恒温振荡摇床 杭州川恒实验仪器公司;CFX96 实时荧光定量PCR 仪 美国伯乐公司;1260 高效液相色谱仪 美国安捷伦。
1.2 实验方法
1.2.1 大麻基因组提取 称取适量高CBD 含量的大麻叶片经液氮研磨后,按照植物DNA 提取试剂盒说明书提取总基因组。使用NanoDrop2000 检测DNA 浓度和质量。DNA 保存在-20 ℃备用。
1.2.2CBDAS基因的克隆 使用Primer3 plus(https://www.primer3plus.com/)在线网站设计特异引物。以大麻基因组DNA 为模板进行PCR 扩增。本实验选用高保真聚合酶进行目的片段的扩增,PCR 扩增程序:95 ℃预变性2 min,95 ℃变性10 s,52 ℃退火30 s,72 ℃延伸2 min,共32 个循环,72 ℃延伸5 min,4 ℃保存。PCR 产物经1%琼脂糖凝胶电泳后,切胶,按照胶回收试剂盒说明书进行纯化。将纯化产物与C000 载体连接生成C000-CBDAS 载体,转化DH5α感受态后选取阳性克隆进行测序。引物合成和测序均由北京擎科生物科技有限公司完成。
1.2.3 生物信息学分析 使用Snapgene 软件将测序后的CBDAS基因序列翻译成氨基酸,利用在线软件Expasy(https://www.expasy.org/)中的ProtParam-和ProtScale 分析CBDAS 蛋白的基本理化性质和亲/疏水性,利用Smart(http://smart.embl-heidelberg.-de/)和NCBI 的CD-search(https://www.ncbi.nlm.nih.gov/cdd/)在线软件分析CBDAS 蛋白的保守结构域,利用NetNGlyc-1.0(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)在线软件分析CBDAS蛋白的糖基化位点。
1.2.4 酵母表达载体的构建 设计含有NotI 和EcoRI酶切位点的特异性引物ppCBDAs-F 和ppCBDAs-R,保护碱基和酶切位点用下划线表示(见表1)。以C000-CBDAS 质粒为模板,用带接头引物进行PCR扩增,PCR 产物经琼脂糖凝胶电泳检测后回收。使用NotI 和EcoRI 酶分别对回收产物和pPIC9K载体进行双酶切,纯化后连接成pPIC9K-CBDAS 质粒,并转化大肠杆菌,通过测序和酶切鉴定筛选阳性克隆。

表1 本研究使用的引物Table 1 Primers used in this study
1.2.5 酵母转化和阳性重组菌的筛选 将重组质粒pPIC9K-CBDAS 经SacI 限制性内切酶进行线性化,再通过电转化方式导入毕赤酵母GS115 感受态中;将细胞液均匀涂布于MD 固体培养基上,于30 ℃倒置培养3~5 d。参考赵明明等[24]方法,用去离子水冲洗平板上的菌落并收集,吸取200 μL 菌液涂布于不同G418 浓度(1、2、4、6 mg/mL)的YPD 平板上,于30 ℃倒置培养3~5 d。挑取YPD 平板上的单克隆,采用高温-乙酸乙酯法提取酵母基因组[25];以AOX1-F 和CBDAS-R 为引物进行PCR 鉴定。PCR反应程序:95 ℃预变性3 min;95 ℃变性20 s,54 ℃退火30 s,72 ℃延伸2 min 15 s,32 个循环;72 ℃延伸5 min,4 ℃保存。PCR 产物进行1%琼脂糖凝胶电泳鉴定。
1.2.6 重组蛋白的诱导表达 参考卢可心[26]方法,挑取鉴定为阳性的重组菌接种至YPD 液体培养基,于30 ℃、190 r/min过夜培养;将活化的菌液按1%接种于20 mL BMGY 培养基,于30 ℃、190 r/min培养至OD600为2~6 时,利用血球计数板计算酵母菌数量,收集菌体后用BMMY 培养基重悬至菌数约为8.0×109个/mL,再于30 ℃、190 r/min 培养,每隔24 h 补充1%体积比的甲醇,连续诱导96 h。每组3 个重复,取菌体破碎后进行SDS-PAGE 分析。
1.2.7 Western blot 分析 将pPIC9K-CBDAS 重组蛋白通过SDS-PAGE 电泳分离后转移至PVDF 膜上。5%脱脂奶粉封闭2 h 后,用TBST 冲洗表面。将PVDF 膜转至含有His 抗体(1:5000)的TBST中,4 ℃孵育过夜。TBST 摇晃清洗6 次(5 min/次)后移至含有HRP 标记的二抗TBST 中(1:4000),室温孵育2 h,TBST 摇晃清洗6 次(5 min/次)。最后用ECL 超敏化学发光检测试剂盒和成像分析仪检测条带。
1.2.8 荧光定量PCR(qRT-PCR)检测基因表达情况
培养方法同1.2.6,在诱导48 h 后收集酵母菌,用Trizol 法提取总RNA,核酸蛋白测定仪检测RNA 浓度及纯度,符合A260/A280=1.8~2.1 后用于逆转录反应。使用逆转录试剂盒合成cDNA,反应体系10 μL,反应条件:37 ℃,15 min;50 ℃,5 min;98 ℃,5 min;4 ℃,保存。采用SYBR® Green Realtime PCR MasterMix 进行qRT-PCR 反应,反应体系20 μL,反应条件:95 ℃预变性10 min,95 ℃变性15 s,55 ℃退火30 s,共39 个循环,引物序列见表1。反应完成后,确认扩增曲线及融解曲线,导出ct 值,以毕赤酵母菌的Actin基因为内参,相对定量用2-∆Ct来分析基因的表达水平[27]。
1.2.9 重组蛋白诱导表达的条件筛选 选取可以成功表达的重组菌株进行后续筛选,诱导时间为0、12、24、48、72、96 h;诱导培养基BMMY 的pH 分别为3.0、4.5、6.0、6.5、7.0、7.5;甲醇添加量为0.5%、0.75%、1%、2%、4%,为保证甲醇浓度不变,每隔24 h 再次添加;具体操作同1.2.6,每组三个重复。
1.2.10 CBDAS 酶活性测定
1.2.10.1 大麻萜酚酸(CBGA)的提取 取高CBGA含量大麻品种的烘干叶片,每0.1 g 中加入50 mL 甲醇,超声破碎30 min 后,4 ℃离心20 min 收集上清液,再用0.22 μm 滤膜去除杂质,-20 ℃保存备用。
1.2.10.2 反应液的制备 反应体系参照修改的Taura等[28]方法,体系一中加入100 μL CBGA 粗提液,0.5 μL TritionX-100,超滤浓缩后的重组蛋白液25 μg,用0.1 mol/L 柠檬酸钠缓冲液(pH5.0)定容至500 μL。在37 ℃反应0、2、4、8、12 h 后,加入600 μL甲醇终止反应,每组三次重复;将反应液离心3 min,取上清,过0.22 μm 滤膜,用于HPLC 检测;体系二中将CBGA 粗提液换成终浓度为25 μmol/L CBGA标准品,在37 ℃反应12 h 后,加入600 μL 甲醇终止反应,其余成分和反应过程均和体系一相同。通过产生CBDA 和CBD 的含量来反映酶的生物活性。
1.2.10.3 液相色谱条件 色谱柱:Shimadzu sil-16 C18柱(150 mm×4.6 mm×3 μm),柱温:30 ℃;流动相:A 为水溶液中含有0.1%甲酸,B 为乙腈中含有0.1%甲酸;等度洗脱:25% A,75% B,保留时间30 min;紫外检测器:230 nm;流速:0.7 mL/min;进样量:10 μL。
1.3 数据处理
DNA 序列和氨基酸序列数据用Snapgene 软件处理。使用统计学软件SPSS23.0 和Prism 5.0 进行分析作图,采用单因素方差分析比较各组间数据,t检验法进行组间差异显著性分析,P<0.05 差异显著。
2 结果与分析
2.1 CBDAS 基因的克隆
以大麻的基因组为模板,使用引物CBDASF 和CBDAS-R 进行PCR 扩增,电泳图如图1。通过测序可知CBDAS基因全长1635 bp,编码544 个氨基酸,Taura 等[28]在克隆纤维型大麻CBDAS基因时,也得出该基因编码544 个氨基酸的结论。将克隆的CBDAS基因序列信息提交到NCBI 数据库(登录号OP627908),但与NCBI 数据库已公布大麻CBDAS基因序列(登录号NC_044378.1)比较,有6 处碱基不同,引起2 个氨基酸发生改变(Cys-Tyr和Lys-Gln),其余4 个为同义突变(图2)。可见,不同大麻品种间CBDAS基因存在差异。
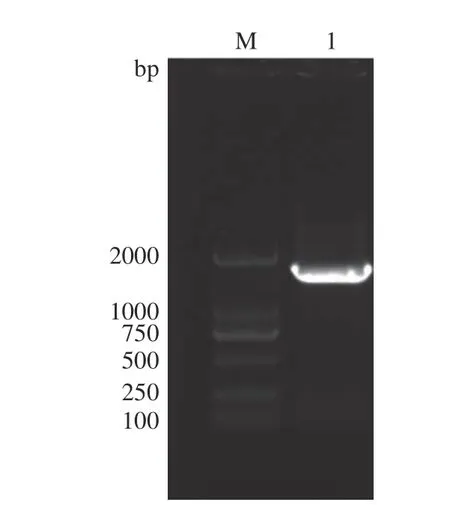
图1 CBDAS 基因扩增结果Fig.1 Amplification results of CBDAS gene
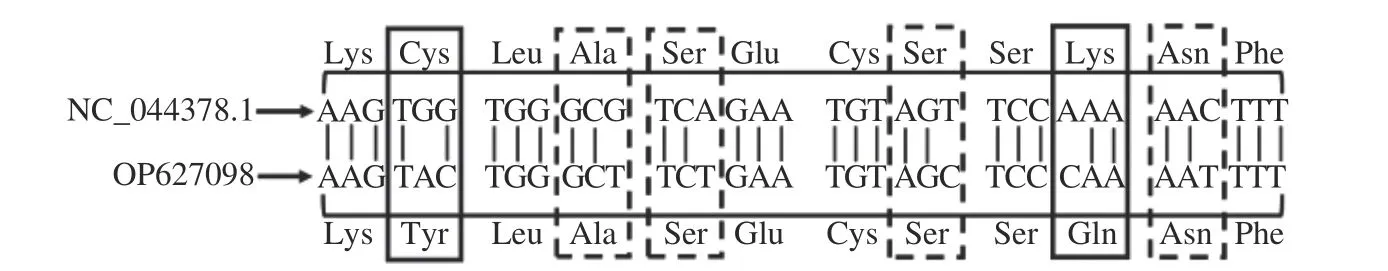
图2 CBDAS 基因序列比对Fig.2 Alignments of CBDAS gene sequences
2.2 CBDAS 蛋白的生物信息学分析
利用在线分析软件ProtParam 预测了大麻CBDAS蛋白的基本理化性质。结果表明,CBDAS 蛋白分子量为62.3 kD,理论等电点pI 为8.84;具有51 个酸性氨基酸残基(Asp+Glu),59 个碱性氨基酸残基(Arg+Lys);分子式为C2843H4351N745O793S20;在酵母中估算的半衰期大于20 h。此外,CBDAS 蛋白的不稳定系数为29.28(小于40 属于稳定蛋白),亲水性平均系数(Grand average of hydropathicity,GRAVY)为-0.219,因此,CBDAS 是稳定的亲水性蛋白。常丽等[29]利用ProtPScale 软件预测大麻品种Carmen的CBDAS 蛋白时,得出其不稳定系数为30.57,GRAVY 为-0.202,与本研究的结论相似。利用NetNGlyc-1.0 在线软件分析发现CBDAS 蛋白存在7 个N-糖基化位点,分别是位于45、65、168、296、304、328、498 位的天冬酰胺。利用Smart 和NCBI的CD-search 软件分析CBDAS 蛋白的保守结构域,两者结果一致(图3),氨基酸479-537 范围的结构域为BBE,存在于小檗碱桥和小檗碱桥样酶中,这些酶参与许多异喹啉生物碱的生物合成;而81-218 结构域家族由多种利用FAD 作为辅助因子的酶组成,大多数酶类似于氧化还原酶。
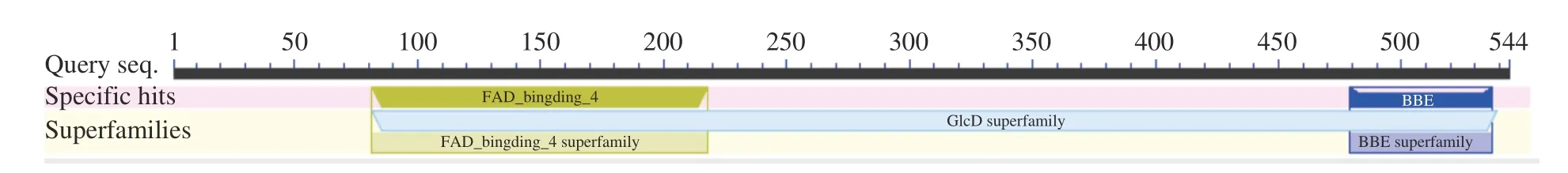
图3 CBDAS 蛋白的保守结构域分析Fig.3 Analysis of conservative domains of CBDAS protein
2.3 重组酵母表达载体构建与鉴定
以C000-CBDAS 为模板,以ppCBDAS-F/R 为引物,扩增获得的CBDAS基因片段大小约为1635 bp。CBDAS基因回收产物与酵母表达载体pPIC9K 用EcoRI 和NotI 分别进行双酶切,经回收、连接、转化后进行鉴定。用AOX-F 引物对载体进行测序,比对后表明序列正确。再用SacI 限制性内切酶对测序正确的重组子进行线性化,再用PstI 酶切,琼脂糖凝胶电泳结果显示,可见5297、2555、1827 和1241 bp等不同片段(图4)。测序和酶切验证后表明,重组酵母表达载体pPIC9K-CBDAS 构建成功。
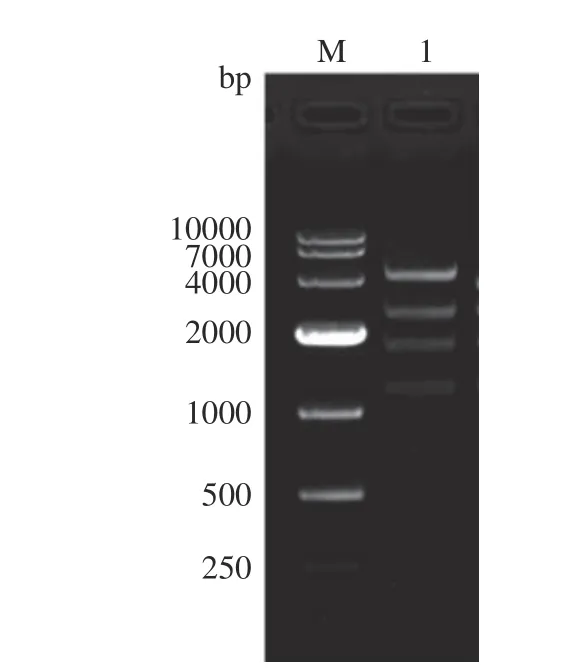
图4 重组酵母表达载体pPIC9K-CBDAS 的酶切鉴定Fig.4 Enzymatic digestion identification of recombinant yeast expression vector pPIC9K-CBDAS
2.4 毕赤酵母转化和阳性重组菌筛选
将线性化质粒电转入毕赤酵母GS115 感受态中,30 ℃培养3~5 d,再利用不同浓度G418 筛选高拷贝菌后,挑取单菌落提取基因组DNA,用pPIC9K载体中AOX1 和CBDAS基因序列设计的引物进行PCR 扩增,获得2002 bp 的条带(图5),表明pPIC9KCBDAS 质粒已经整合到毕赤酵母GS115 的染色体中。

图5 重组酵母菌株PCR 鉴定Fig.5 PCR identification of the recombinant yeast
2.5 Western blot 和qRT-PCR 验证重组蛋白表达
以酵母菌的Actin基因为内参,经qRT-PCR 分析后发现,在以水为阴性对照(CK)和转入空载体pPIC9K 的酵母菌中,均未检测到CBDAS基因的表达,而在重组菌中有该基因的表达(图6A)。Western blot 分析显示,重组蛋白CBDAS 在毕赤酵母中能正常表达,在75 kD 处具有特异性条带,而在导入空载体酵母菌中无表达(图6B),比利用Protparam 软件预测的蛋白分子质量(62.3 kD)略大,在前面糖基化位点分析时发现CBDAS 蛋白存在多个N-糖基化位点,推测该酶在酵母表达中可能发生糖基化修饰而导致分子量变大。姚昌阳等[30]也在利用毕赤酵母诱导表达裂解多糖单加氧酶(LPMO)的研究中发现,重组的LPMO 蛋白条带大小范围为46~50 kD,比预测的分子量34 kD 大,认为该蛋白发生了糖基化修饰。

图6 qRT-PCR 基因表达分析和重组蛋白的Western blot 验证Fig.6 Gene expression analysis by qRT-PCR and Western blot validation of the recombinant protein
2.6 重组CBDAS 蛋白诱导表达的条件筛选
pPIC9K 为分泌型载体,理论上应会在胞外分泌出大量重组蛋白。但可能由于多肽链在内质网中聚集,导致加工以及囊泡运输等过程影响外源蛋白分泌表达,从而使一定量外源蛋白仍滞留在胞内[31]。由于上清中CBDAS 蛋白较少所以收集菌体经超声破碎后的蛋白用于后续实验。为使重组CBDAS 蛋白高效表达,对主要影响其表达的诱导时间、甲醇浓度和诱导培养基BMMY 的pH 等因素进行筛选,结果如图7。诱导时间、甲醇浓度和培养基的pH 对重组蛋白表达确有较大影响,重组菌在培养48 h,诱导培养基pH6.0,1%甲醇添加量时表达量最大。
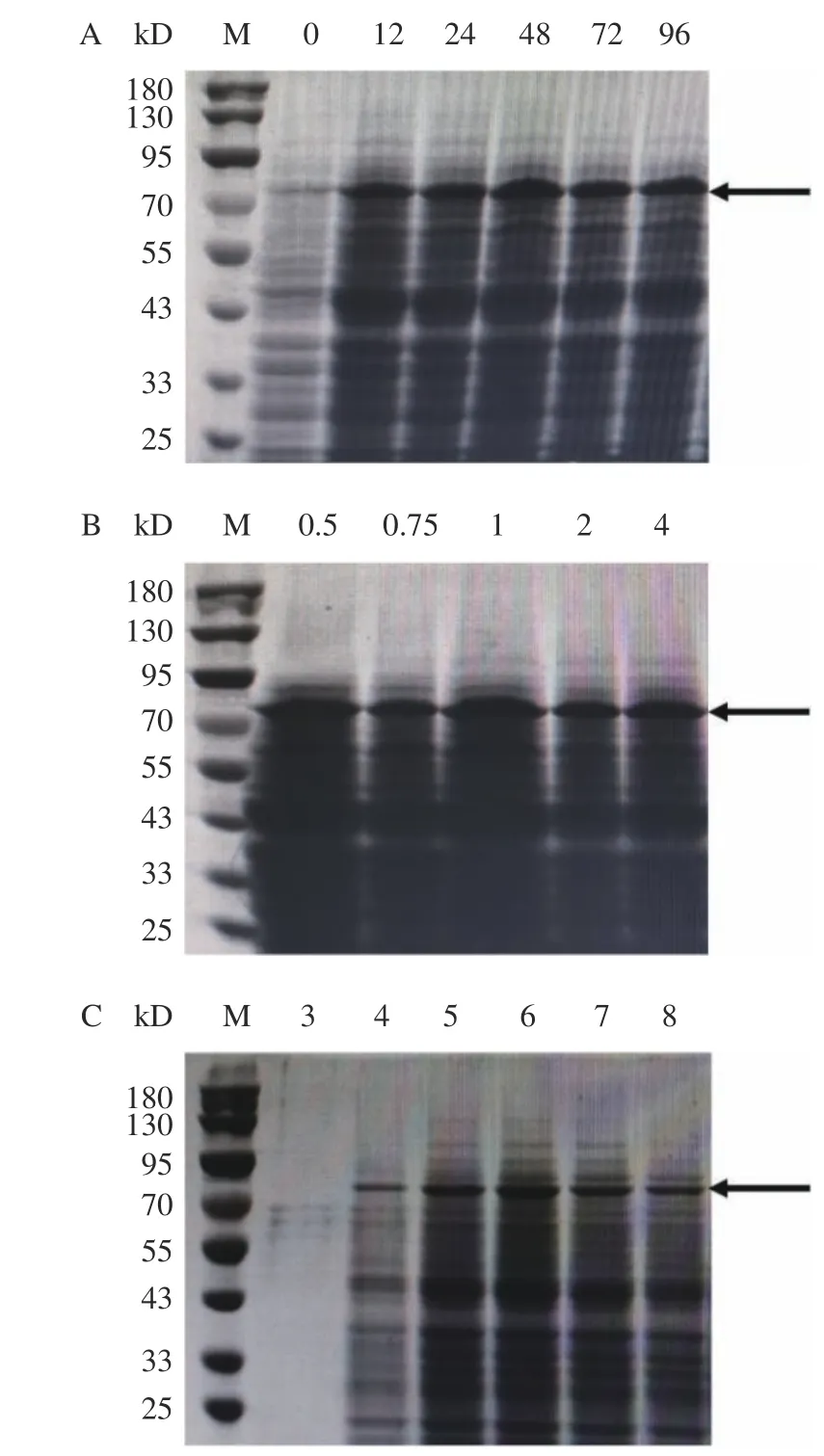
图7 重组蛋白诱导表达的条件筛选Fig.7 Screening conditions for inducing expression of recombinant protein
2.7 CBDAS 酶活性分析
将转入空载体pPIC9K 酵母菌株和导入目的基因的重组酵母菌株pPIC9K-CBDAS 同时在诱导培养基BMMY(pH6.0),1%甲醇添加量下进行诱导培养,48 h 后收集菌体经超声破碎收集上清液,用超滤管进行浓缩制备成待测酶液,利用BCA 试剂盒检测总蛋白浓度,毕赤酵母重组酶活性测定如图8。反应体系的总体积保持不变,设置一组只加底物不加酶液的空白对照(CK),另两组分别加入pPIC9K 和pPIC9K-CBDAS 重组菌株提取的酶液。当使用大麻叶片粗提液中CBGA 为底物发生反应时,由于粗提液中含有CBDA 和CBD,因此,在0 h 时三组均会检测到这两种物质。随着反应时间增加(0~12 h),CK 组和pPIC9K 组的CBDA 和CBD 的含量略微下降,但差异不显著。对于pPIC9K-CBDAS 组来说,反应2 h 后,CBDA 和CBD 的含量未发生显著变化;当反应4 h 后,CBDA 含量显著增加(P<0.05);在8h 后CBD 含量显著增加(P<0.05),12 h 时生成的CBDA 和CBD 含量达到最大值;在重组酶CBDAS作用下,新合成CBDA 60.64 ng/mL,CBD 128.01 ng/mL,分别比pPIC9K 组的高15.67 倍和37.87 倍(图8A~图8E)。为进一步确定重组CBDAS 的生物活性,减少大麻叶片粗提液中其他物质对反应的干扰,以CBGA 标准品为底物,反应12 h 后分析重组酶催化底物CBGA 产生CBDA 和CBD 的情况,结果如图8F。CK 组和pPIC9K 组中未检测到CBDA,但有CBD 检出,这是因为CBGA 标准品中含有少量的CBD 而导致;pPIC9K-CBDAS 组中新合成CBDA 20.12 ng/mL,CBD 207.87 ng/mL,CBD 含量比pPIC9K组高9.34 倍。CBDAS 酶和底物发生反应直接生成CBDA,但当反应时间长于4 h 后,CBDA就会发生脱羧反应生成CBD,所以在8 和12 h 时会产生大量的CBD。由上可知,通过毕赤酵母重组产生大麻的CBDAS 无论在大麻叶片粗提液还是标准品中,都可以催化底物CBGA 生成CBDA 和CBD。经对比,以CBGA 标准品为底物的转化效率明显低于大麻叶片粗提液,这可能由于在CBGA粗提液中含有的复杂物质成分所致,可促进CBDAS酶催化活性,并增强CBDA 脱羧作用。

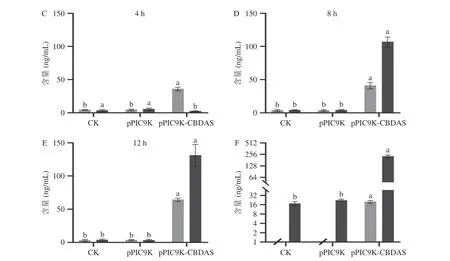
图8 重组酶催化底物CBGA 产生CBDA 和CBD 的情况Fig.8 Production of CBDA and CBD by catalyzing substrate CBGA by the recombinant enzyme
3 结论
大麻品种间CBDAS基因存在差异,从而使蛋白的基本理化性质发生改变,本研究中克隆得到CBDAS经生信预测认为是一种稳定的亲水性蛋白。目前,人们多以大麻花叶为材料来提取大麻素,存在季节依赖、周期长、纯度低等问题,且在提取CBD 过程中会浪费粗提液中尚存的CBGA。利用经济高效的方法获得CBDAS,便可通过体外反应将粗提液中残存的CBGA 进一步转化成CBD。本文通过构建酵母表达载体,转化毕赤酵母获得重组菌,经qTRPCR 和Western blot 验证后认为CBDAS基因可在酵母中得到表达。而重组菌在培养48 h、培养基pH6.0 和1%甲醇添加量等诱导条件下CBDAS 蛋白表达量最大。通过毕赤酵母重组产生大麻的CBDAS无论在大麻叶片粗提液还是标准品中,都可以催化底物CBGA 生成CBDA 和CBD,具有很强的生物活性。研究结果为今后CBD 在医疗、食品和化妆品等领域的应用开发提供基础。重组CBDAS合成酶在大麻叶片粗提液中的催化活性高于CBGA标准品,其具体原因还有待于进一步研究。
