生牛乳中β-内酰胺酶检测杯碟法的优化
2023-10-19陆雯俞琦娅朱晗昀童晓玲李秀通王珍
陆雯,俞琦娅,朱晗昀,童晓玲,李秀通,王珍
绿城农科检测技术有限公司(杭州 310000)
青霉素对奶牛的乳腺炎及一些细菌性感染有很好的治疗效果[1],且价格低廉、便于获取,被广泛应用于畜牧生产中。但青霉素频繁的超剂量使用会使牛奶中含有高浓度的残留物,长期食用抗奶会对人体带来不同程度的危害[1-2]。β-内酰胺酶是一种抗生素分解剂,能将牛乳中抗生素残留量降到限量标准,为谋取经济利益,一些不良商贩利用此原理在生鲜牛乳中违法添加β-内酰胺酶,从而得到“无抗奶”,更滋生出抗生素滥用的现象,因此牛乳中有β-内酰胺酶的残留[3]。国内外对生牛乳的β-内酰胺酶检测主要有高效液相色谱法、碘量法和杯碟法[4-7]。高效液相色谱法操作复杂,检测成本高[6]。碘量法灵敏度差且不同样本重复性差[7]。杯碟法灵敏度高,易操作,易判定[9-13]。但该方法不能排除非人为添加的可能性。奶牛体内的致病菌产生耐药性后自身代谢产生β-内酰胺酶。有研究证明革兰阳性菌只产生青霉素酶和头孢菌素酶这两种β-内酰胺酶,外源添加的β-内酰胺酶主要是青霉素酶[14]。革兰阴性菌可产生的β-内酰胺酶种类繁琐,已发现有2 000余种,被认为是内源性β-内酰胺酶[15],且内源性β-内酰胺酶能被检出。其来源应该有2种途径:一是牛体本身产生;二是牛体本身感染某些有抗性的微生物,而这些微生物在体内不断表达分泌β-内酰胺酶类,致使生鲜牛乳检测呈阳性。为排除非人为添加导致牛乳中β-内酰胺酶的不合格、提高检测准确性,在SN/T 3979—2014《乳及乳制品中β-内酰胺酶的测定方法杯碟法》和NY/T 3313—2018《生乳中β-内酰胺酶的测定》中杯碟法的基础上,通过增加内源性β-内酰胺酶的检测,即同步增菌培养,利用2,3,5-氯化三苯基四氮唑(TTC)显色反应[16]及培养前后对照试验,排除内源性β-内酰胺酶的干扰。
1 材料与方法
1.1 材料及仪器
藤黄微球菌[Micrococcus luteusCICC(B)28001,中国工业微生物菌种保藏管理中心提供]。
样品:鲜牛乳样品100份、人工添加β-内酰胺酶标准品的灭菌脱脂牛乳50份和无任何添加灭菌脱脂牛乳50份。
标准品:青霉素G、β-内酰胺酶标准品(4 000 000 U/mL)、舒巴坦,均购自中国药品生物制品检定所。
培养基:营养琼脂培养基、抗生素检测用培养基Ⅱ(pH 6.5±0.1),均购自青岛海博生物技术有限公司。
生化培养箱(LRH-250F,上海一恒科学仪器有限公司);精密移液器(Research plus,德国艾本德股份公司);游标卡尺(Ⅰ型,桂林五顺量具制造有限公司)。
1.2 方法
将样品平均分成4份,第1份在冷藏保存24 h内进行测定,其余每隔24 h测定1次,共测定3次。同时每隔12 h进行1次菌落总数的测定,以观察牛乳中微生物的变化。
1.2.1 检验用板的制备
将藤黄微球菌制成菌悬液,按照适当比例加入灭菌后冷却至46±1 ℃的抗生素检定培养基Ⅱ中,充分摇匀后制备菌体数量约1×108CFU/mL的含菌培养基;取15~20 mL含菌培养基倒入无菌培养皿,凝固后备用。
1.2.2 试样的测定
各取1.00 mL充分混匀的生牛乳于4个1.5 mL离心管,分别标为A、B、C、D,每个稀释品平行试验2个,同时用灭菌水作为空白试验,按照表1依次分别加入β-内酰胺酶标准溶液(4 000 U/mL)、舒巴坦标准溶液、青霉素标准溶液。混匀后,取A~D试样各200 μL分别加入到放置于检验用平板上的4个牛津杯中,平板加盖后放入37±1 ℃生化培养箱中培养18~22 h。测量各抑菌直径,取2个平行测定结果的平均值。

表1 试样的添加 单位:μL
1.2.3 内源性β-内酰胺酶测定
1.2.3.1 内源性β-内酰胺酶测定前的培养
各取1环生牛乳试样接种于已灭菌的脱脂奶粉中于37±1 ℃生化培养箱中,设置5组每组3平行,培养24 h。同时设置无接种的灭菌脱脂乳作为对照。
1.2.3.2 TTC浓度的选择
在经过1.2.3.1培养的试液中每组分别添加浓度0,0.01,0.05和0.10 mol/L TTC,每个浓度添加3支,于37℃恒温水浴中孵育2 h,观察颜色变化。
1.2.3.3 杯碟法测试
将初测阳性的牛乳样品经过接种培养后按照1.2.2步骤进行操作,分别测定抑菌圈直径大小。以灭菌脱脂乳作为阴性对照,未经处理的原牛乳样品作为阳性对照。
2 结果与分析
2.1 不同时间冷藏后的检测结果
测定的100份样本中,在48 h内检测的结果均为阴性,而72 h有2批样品出现阳性结果,结果见表2,同时观察阳性批次对应的菌落生长情况,结果见图1。试验结果表明,部分牛乳中可能含有产生内源性β-内酰胺酶产生的微生物。
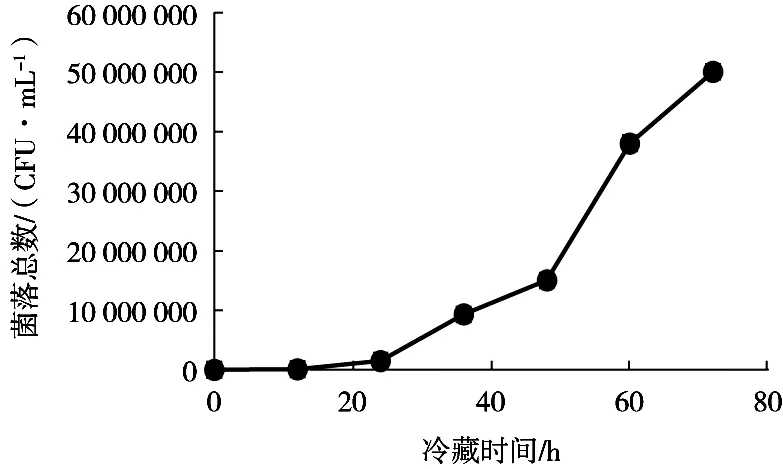
图1 不同冷藏时间的生牛乳中微生物的生长情况

表2 不同冷藏时间的检测结果

表3 不同TTC浓度显色情况
2.2 TTC浓度的选择
在2.1中检出的阳性样品,经1.2.3.1操作培养24 h后,添加不同浓度的TTC试液并于37 ℃水浴孵育2 h后发现,终浓度0.000 5%~0.001 0% TTC的试液颜色红色不明显,0.002 0%粉色明显,因TTC有一定毒性,故在保证结果可辨的情况下选择终浓度为0.002 0%的TTC作为最终试验浓度。
2.3 生鲜乳中内源性β-内酰胺酶的测定结果确认
取冷藏72 h的样品,分别按1.2.2和1.2.3步骤进行测定,结果见表4。结果表明,测定的100份样本中,有2份出现阳性结果。2份初测阳性样品经1.2.3.1步骤测试发现有2份样品中TTC变红,证明有内源性β-内酰胺酶的存在。结合TTC检测结果,可最终确认外源性β-内酰胺酶检出批次为0份。
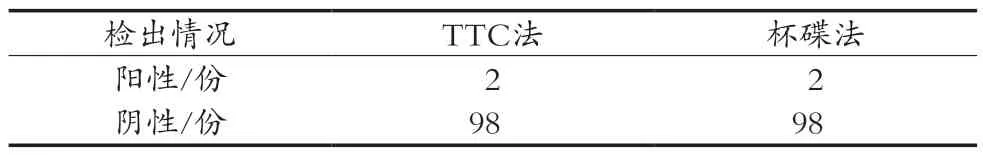
表4 2种方法检测生鲜乳中β-内酰胺酶的检出情况
2.4 人工制备的灭菌脱脂乳中β-内酰胺酶的测定结果
对50份添加β-内酰胺酶大于方法检出限的灭菌脱脂乳和50份未添加抗生素的灭菌脱脂乳分别按1.2.2和1.2.3步骤进行测定,结果见表5。结果表明,TTC无法测定外源性添加的β-内酰胺酶,杯碟法测定的结果与实际一致。
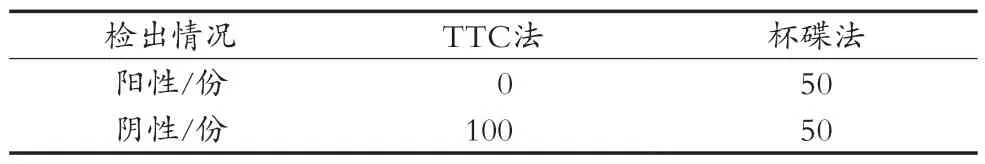
表5 2种方法检测人工制备的灭菌脱脂乳中β-内酰胺酶的检出情况
3 讨论
对于出现阳性的2份样品,经内源性β-内酰胺酶测定处理后的样品与未处理前的样品同时用杯碟法步骤进行操作测定,均出现阳性结果。结果表明,样品中存在分泌内源性β-内酰胺酶的细菌,经过培养后因菌体大量繁殖导致分泌的β-内酰胺酶量达到杯碟法的检出限而被检出。而对于人工添加β-内酰胺酶的样本,TTC检测法无法检出,可排除样本中内源性β-内酰胺酶活性微生物的存在或未达到检出的阈值。
在已有β-内酰胺酶杯碟法检测基础上,增加TTC检测法在一定程度上可对可疑阳性样品进一步筛查排除内源性β-内酰胺酶的干扰,提高检测结果的可靠性。因TTC法只能检测活菌,无法排除本身已产生β-内酰胺酶而无活菌的样品,对于此,试验结果可为后期进一步研究提供方向。
4 结论
在β-内酰胺酶杯碟法的基础上增加检测牛乳内源性β-内酰胺酶方法,可排除内源性β-内酰胺酶的干扰,提高检测结果的可靠性。
