铜绿假单胞菌中黄曲霉毒素B1降解酶的纯化及其降解产物解析
2023-10-18许艳华董慧燕娄海伟王香玉赵仁勇
许艳华, 董慧燕, 娄海伟, 王香玉, 赵仁勇
(河南工业大学粮油食品学院,郑州 450001)
黄曲霉毒素是由黄曲霉和寄生曲霉等真菌产生的次级代谢产物,是一类二呋喃香豆素衍生物的类似物质[1]。已报道的黄曲霉毒素有20种,常见的有4种:黄曲霉毒素B1(Aflatoxin B1,AFB1)、B2(AFB2)、G1(AFG1)和G2(AFG2)[2]。其中,AFB1的毒性最强,具有很强的致突变性和致癌性,被国际癌症研究机构(International Agency for Research on Cancer, IARC)列为一级致癌物[3]。粮食和饲料极易受黄曲霉毒素的污染,对人畜健康造成了极大的威胁,因此黄曲霉毒素的脱毒研究受到学者的广泛关注[4]。
目前,黄曲霉毒素的脱毒方法主要分为物理、化学和生物法。物理法主要包括加热、吸附和紫外照射等,化学法有碱处理和氧化剂处理[5-7]。这些方法可以单一使用,也可以互为补充达到更好的降解效果。但是物理和化学法存在解吸附作用和化学试剂残留等问题,对食品营养、感官品质和风味有极大影响[8,9],而生物降解法由于条件温和,且具有特异性的优势逐渐成为研究热点[10]。生物法降解黄曲霉毒素主要有2种途径,包括菌体吸附和酶的降解作用[11]。Peltonen等[12]选取20株乳酸菌和双歧杆菌降解AFB1,72 h后发现有2株乳杆菌和1株鼠李糖乳杆菌可以去除50%以上的AFB1,但是通过反复水洗后结合的AFB1会再次被释放。菌体吸附AFB1的这种可逆性限制了其在生产中的广泛应用。在微生物酶降解AFB1方面,已报道的黄曲霉毒素降解酶有漆酶[13,14]、过氧化物酶[15, 16]、氧化酶[17]和还原酶[18]等。其中,漆酶主要由真菌产生,例如云芝(Trametesversicolor)、黑曲霉(Aspergillusniger)和平菇(Pleurotusostreatus)等,前两株真菌所产漆酶对AFB1的降解率分别为87%和55%[19];其中黑曲霉能够将AFB1转化为黄曲霉毒醇[20]。Yehia等[21]从平菇的培养滤液中分离到一种分子质量约为42 ku的锰过氧化物酶,该酶与AFB1反应24 h后,对AFB1的降解率可达67%。由鼠耳芥(Phanerochaetesordida)分泌的锰过氧化物酶能先将AFB1氧化为AFB1-8,9-环氧化物,随后水解为AFB1-8,9-二氢二醇[22]。也有许多学者对降解黄曲霉毒素的细菌进行研究,Taylor等[18]从分枝杆菌中分离并鉴定出降解黄曲霉毒素的F420H2-依赖性还原酶,通过辅因子F420H2还原不饱和酯进而激发毒素分子的水解。
基于本实验室前期筛选到一株能产生高温下降解AFB1降解菌株——铜绿假单胞菌M4(Pseudomonasaeruginosa)[23],研究进一步利用超滤、离子交换色谱和凝胶过滤色谱等分离手段对该菌株产生的降解酶进行纯化,最终得到能够高效降解AFB1的小分子多肽。利用薄层色谱(Thin Layer Chromatography, TLC)和超高效液相色谱-飞行时间质谱仪(Ultra-high Performance Liquid Chromatography-Quadrupole Time-of-Flight Mass Spectrometry,UPLC-Q-TOFMS)对AFB1的降解产物进行鉴定,并推测其降解机理,为生物法降解AFB1提供材料。
1 材料与方法
1.1 材料与试剂
铜绿假单胞菌M4菌株,本实验室保存。
AFB1标准品(纯度>98%);甲酸、乙腈均为质谱级;二硫苏糖酰醇、碘乙胺、蛋白酶K均为分析纯;甲醇为色谱级;Sephadex G-50凝胶;薄层层析硅胶板G。
1.2 培养基
种子培养基:蛋白胨10.0 g,牛肉膏3.0 g,NaCl 5.0 g,蒸馏水1 L,pH 7.0,121 ℃高压灭菌20 min。
发酵培养基:蛋白胨10.0 g,牛肉膏3.0 g,葡萄糖2.0 g,NaCl 8.5 g,KH2PO41.0 g,蒸馏水1 L,pH 7.0,121 ℃高压灭菌20 min[24]。
1.3 仪器与设备
HiPrePTMDEAE FF型离子交换柱,3 ku超滤离心管,5810R型高速冷冻离心机,Concentrator plus型真空离心浓缩仪,ZHWY-111B型恒温培养振荡器,ZHJH-C1109C型超净工作台,YXQ-LS型立式压力蒸气灭菌器,Freezone型冷冻干燥机,e2695型高效液相色谱仪,2489型制备液相色谱仪,BioLogicDuoFlow层析系统,Ultimate3000型超高效液相色谱-电喷雾-离子肼串联质谱,高效液相串联飞行时间质谱仪。
1.4 实验方法
1.4.1 AFB1的提取及检测
AFB1的提取及检测参照GB 5009.22—2016《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》第三法高效液相色谱-柱后衍生法。经免疫亲和柱净化后在50 ℃条件下用氮气吹干,用1 mL流动相复溶,经0.22 μm无菌滤膜过滤后用高效液相色谱仪检测AFB1。高效液相分析柱为C18(250 mm×4.6 mm,5 μm),流动相为甲醇水溶液(甲醇∶水的体积比=45∶55),流速为0.8 mL/min,运行时间为25 min,柱温为30 ℃,荧光检测器的激发波长λex=360 nm,发射波长λem=440 nm。AFB1降解率计算公式为:
式中:X1为空白对照组中AFB1质量/ng;X2为样品组中残留AFB1质量/ng;Y为降解率/%。
1.4.2 AFB1降解酶的分离纯化
1.4.2.1 超滤分离
将菌株接种于种子培养基中,37 ℃、160 r/min条件下活化培养24 h,然后以体积分数5%接种量接种于发酵培养基中,于相同培养条件下培养48 h得到发酵液;将发酵液在4 ℃、8 000 r/min条件下离心10 min,去除菌体得到上清液。在截留分子质量为3 ku的超滤管内于4 ℃、6 000 r/min条件下离心60 min,得到滤上溶液(>3 ku)与滤下溶液(<3 ku)。
1.4.2.2 凝胶过滤层析分离
将溶胀好的Sephadex G-50葡聚糖凝胶倒入1.5 cm×80 cm的层析柱中,用20 mmol/L磷酸钠缓冲液(pH 7.4)进行预平衡。将超滤得到的滤下溶液用0.22 μm滤膜过滤,然后注入到Sephadex G-50色谱柱中,用20 mmol/L磷酸钠缓冲液(pH 7.4)进行洗脱,流速为0.5 mL/min。利用2489型制备液相系统在紫外波长214 nm下检测吸收峰,收集各洗脱峰并测定其降解特性。前期预实验得知其粗酶是耐高温的降解酶,高温处理条件为121 ℃,30 min。
1.4.2.3 离子交换层析分离
在对凝胶过滤色谱分离的各洗脱峰进行检测后,使用BioLogicDuoFlow层析系统将具有高降解活性的组分进一步纯化。用20 mmol/L磷酸钠缓冲液(pH7.4)进行预平衡,将经凝胶过滤层析纯化后的溶液注入到HiPrePTMDEAE FF型离子交换柱(1.6 cm×10 cm)中,用20 mmol/L磷酸钠缓冲液(含1 mol/L NaCl,pH 7.4)对样品进行梯度洗脱,流速为0.6mL/min,在214 nm紫外波长下检测洗脱峰,收集后测定各个洗脱峰的降解特性。
1.4.3 酶活力测定
参照武瑞霞等[25]对酶活力的定义并稍微修改,在37 ℃、pH 7.4条件下,反应72 h降解1 ng AFB1所需要的酶量定义为1个酶活单位(U)。
1.4.4 蛋白浓度测定
参照高英等[26]的方法进行测定。
1.4.5 峰5组分多肽鉴定
1.4.5.1 还原烷基化
用纯水将样品溶解,加入10 mmol/L的二硫苏糖醇溶液,于56 ℃水浴中还原1 h。加入50 mmol/L的碘乙酰胺溶液,避光反应40 min。使用脱盐柱对样品脱盐,然后在45 ℃真空离心浓缩仪中挥发干溶剂。
1.4.5.2 多肽检测
用0.1%的甲酸水溶液将还原烷基化的样品复溶,注入到超高效液相色谱-电喷雾-离子肼串联质谱仪(Ultra-high Performance Liquid Chromatography with Electrospray Ionization tandem Mass Spectrometry,UPLC-ESI-MS/MS)中进行检测,使用Maxquant(1.6.2.10)软件检索目标蛋白数据库。超高效液相色谱检测柱为C18(150 μm×150 mm,5 μm),流动相为A(0.1%甲酸水溶液)和B(含0.1%甲酸的乙腈溶液),线性梯度洗脱条件为0~5 min 6%~9%B,5~20 min 9%~14%B,20~50min 14%~30%B,50~58 min 30%~40%B,58~60 min 40%~95%B,流速为6×10-4mL/min,运行时间60 min。
质谱的操作参数为喷雾电压2 200 V,毛细管温度270 ℃,扫描范围400.0~6 000.0m/z,裂解模式为碰撞诱导解离,在正离子模式下分析。在依赖数据的扫描模式下收集高质量的碎片数据。通过全扫描分析获得原始图谱数据,并使用Xcalibur3.0(Thermo Fisher Scientific)进行分析。
1.4.6 AFB1降解产物的检测
1.4.6.1 薄层色谱法
用20 mmol/L磷酸钠缓冲液(pH 7.4)将待测组分复溶,取975 μL并加入25 μL AFB1标准溶液(20 μg/mL)混匀,使AFB1终质量浓度为500 ng/mL,于37 ℃、160 r/min条件下避光反应72 h,以无菌发酵培养基与AFB1在相同条件下反应后的溶液作为空白组,参照邵帅等[27]使用的薄层色谱法观察AFB1的降解情况。
1.4.6.2 高效液相色谱法
将待测组分与AFB1标准溶液(100 μg/mL)混合,使AFB1终质量浓度为2.5 μg/mL,于37℃、160 r/min条件下分别避光反应0、6、24和72 h。以反应0 h的混合液为空白对照,利用e2695型高效液相色谱仪分离降解产物。液相分离条件为:流动相为甲醇水溶液(甲醇∶水的体积比=70∶30);流速0.3mL/min;柱温30℃;紫外检测器的波长为213 nm。
1.4.6.3 UPLC-Q-TOF MS质谱法
如1.4.6.2所示方法制备0 h和72 h样液,用等体积的氯仿萃取3次,合并有机相,氮吹后用流动相(甲醇∶水的体积比=70∶30)复溶,经0.22 μm无菌滤膜过滤后,利用UPLC-Q-TOF MS对AFB1降解产物进行鉴定。超高效液相分离条件同1.4.6.2中e2695型高效液相检测条件。
在装有电喷雾离子源的Q-TOF系统上以正离子模式进行质谱分析。最佳条件设置为毛细管电压2 800 V,锥孔电压20 V,裂解电压3 V,离子源温度80 ℃,脱溶剂化温度180 ℃。锥孔和脱溶剂化气体流速分别为80 L/h和400 L/h。数据收集范围为100~1 000m/z。
1.5 数据处理
利用SPSS 20.0软件对实验数据进行方差分析;采用Origin 8.5软件进行绘图,使用Xcalibur3.0软件对UPLC-ESI-MS/MS图谱分析;采用Massynlynx v4.1对UPLC-Q-TOF MS结果进行分析。
2 结果与分析
2.1 AFB1降解酶的分离纯化
2.1.1 凝胶过滤层析色谱
使用3 ku超滤管将铜绿假单胞菌M4菌株的发酵上清液离心,得到滤上(29 U/mg)和滤下(218U/mg)两部分溶液(数据未列出),选用比活性较高的滤下液(<3 ku)进行Sephadex G-50凝胶过滤层析分离,在120~420 min时间内得到2个明显的洗脱峰,将其命名为组分1和组分2。2个组分对AFB1的降解特性如图1显示,组分1和组分2对AFB1的降解率分别为9.48%和22.02%。加热处理前后,组分1对AFB1的降解率无显著差异(P<0.05);而加热处理后的组分2对AFB1的降解率为66.15%,比热处理前增加了2倍。在类似的研究中,有学者筛选到降解AFB1的沙克氏杆菌(Bacillusshackletonii)L7,其上清液经超滤浓缩并加热处理后降解率由70.12%增加至76.67%。经蛋白酶K处理后,2个组分的降解率均显著下降(P<0.05),因蛋白酶K可破坏蛋白质的结构而影响蛋白酶的活性[29],结合实验室前期实验可以推测2个组分中的降解活性物质均为耐高温蛋白类。因组分2对AFB1具有较好的降解效果,所以进一步对组分2进行纯化。

注:图中不同字母之间表示差异显著(P<0.05),下同。
2.1.2 离子交换色谱
凝胶过滤层析得到的组分2进一步经离子交换层析分离得到5个组分,分别命名为峰1、峰2、峰3、峰4和峰5(图2a)。由图2b可知,未处理的5个组分对AFB1的降解率范围为10.99%~17.08%,经加热处理后,峰5组分对AFB1的降解率增加了1.88倍。除峰1组分外,蛋白酶K处理后的其他组分对AFB1的降解活性均显著下降(P<0.05)。发酵上清液纯化过程中的蛋白浓度及比活性见表1,峰5组分比活性为2 298.49 U/mg,回收率为10.57%,表明纯化效果良好。进一步对峰5组分进行多肽鉴定。

表1 发酵上清液分离纯化过程中的蛋白浓度及比活性

注:图a为组分2的离子交换色谱图,1~5为峰号。图b为离子交换色谱各洗脱峰对AFB1的降解特性对比。
2.2 峰5组分多肽鉴定
采用Xcalibur.3.0软件对UPLC-ESI-MS/MS质谱图进行分析,从总离子流图可知峰5组分是多肽混合物(图3)。多肽经碰撞诱导解离时的破裂作用优先发生在肽键上,生成专一的序列离子,根据碎片断裂情况可解析得到多肽序列[30](图4)。采用MaxQuant(1.6.2.10)软件对UPLC-ESI-MS/MS原始文件进行分析,并根据样品的种类在目标蛋白质数据库中进行搜索,在峰5组分中检测出6个主要肽段,其所带电荷量不同,分子质量范围为646.38~1 715.96 u(表2)。目前,在多肽对黄曲霉毒素脱毒的相关研究中,有学者利用凝胶过滤色谱及高效液相色谱从巨大芽孢杆菌(Bacillusmegaterium)CGMCC7089的发酵液中分离得到3种抑制黄曲霉生长和产毒的活性多肽[31]。

图3 峰5组分总离子流色谱图

注:a是肽段FIDLKNQQARIKDK的二级质谱图,b是肽段DLFLEKIKREGNRV的二级质谱图。
2.3 峰5降解AFB1的产物分析
2.3.1 薄层色谱法检测AFB1降解产物
AFB1是荧光化合物,在紫外灯下能发出蓝色荧光[32],采用薄层色谱法可以方便快捷的对AFB1的降解情况进行初步判断。Lee等[33]曾报道内酯环的破坏会导致AFB1荧光特性的消失,而改变环戊烯酮环、呋喃环及内酯环上取代基则不会影响荧光特性;也有学者报道过具有荧光特性的AFB1降解产物[27,34]。将自然晾干的硅胶板置于365 nm紫外灯下照射,结果见图5。硅胶板上0 h样品的AFB1有明显的蓝色荧光斑点,降解72 h后样品荧光强度明显减弱,且在硅胶板上出现了新的荧光斑点,这说明AFB1可能被降解成了新的具有荧光特性的物质。因此推测很可能是AFB1的内酯环结构受到了部分破坏。

图5 AFB1降解产物的薄层色谱图
2.3.2 高效液相法检测AFB1降解产物
多肽降解AFB1的高效液相色谱结果见图6,AFB1标准品的保留时间为13.05 min,且随着降解时间的延长,其响应值和峰面积均呈现逐渐下降的趋势,表明AFB1被降解。由薄层色谱结果可知,产物的迁移率小于AFB1,极性比AFB1强,降解产物的保留时间应比AFB1短。与0 h相比,在保留时间4.73 min时出现了新的物质P,并且随着降解时间的延长响应值不断变大,该物质P有可能是AFB1降解产物。
2.3.3 降解产物的质谱分析
为进一步确定降解产物的结构式,利用UPLC-Q-TOF MS图谱和相关的文献进行分析。用软件Xcalibur v.3.0扣除0 h的背景影响,在72 h降解液中检测到一个主要的产物峰P,其二级质谱图(图7)显示产物P的质荷比为206.058 9,利用Massynlynx v4.1软件进行分析,其分子式为C11H10O4。图8推测出产物P可能的3种结构式及相应的裂解途径,根据薄层色谱已知AFB1产物具有荧光特性,所以AFB1的降解产物最可能是图8a。如图9所示,在多肽的作用下,AFB1的结构发生了变化,呋喃环上的8、9位双键被破坏,苯环上的甲氧基团和环戊烯酮发生断裂,这些结构的变化使降解产物毒性降低,或无毒[33]。在类似的研究中,Samuel等[35]利用薄层色谱、气质联用和近红外光谱等方法从恶臭假单胞菌(Pseudomonasputida)MTCC 1274和2445两株菌对AFB1的降解液中检测并推测出AFB1的降解产物为AFD1(质荷比:286)、AFD2(质荷比:206)和AFD3(质荷比:149)。Eshelli等[36]对红球菌降解AFB1的产物碎裂方式进行推测,发现AFB1经内酯环水解、脱羧反应得到了AFD1和AFD2这2种中间产物。

图7 AFB1降解产物P的二级质谱图
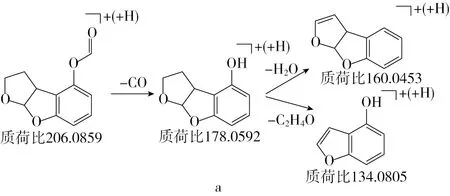
图8 AFB1降解产物P可能的裂解途径

图9 推测AFB1可能的降解途径
3 结论
利用超滤、凝胶渗透色谱及离子交换色谱等方法从铜绿假单胞菌M4发酵上清液中分离到了新的降解AFB1的小分子多肽,经加热处理后,其对AFB1的降解率增加了1.17倍。根据薄层色谱结果所示,有新的降解产物出现。利用UPLC-Q-TOF MS图谱及Massynlynx v4.1系统分析,降解产物P的分子式为C11H10O4,推测多肽破坏了AFB1的主要毒性位点,降解产物P的毒性可能远低于AFB1,或无毒。在进一步的研究中,应考虑通过合成或克隆表达的手段得到大量的多肽,并通过核磁手段验证产物结构,为该多肽的实际工业化应用奠定基础。
