元宝枫籽油膳食补充对大鼠肠道菌群和代谢物的影响
2023-10-20常婷婷陈显扬纪宝明宋王婷
张 珂, 常婷婷, 陈显扬, 纪宝明, 宋王婷
(北京林业大学草业与草学院1,北京 100083) (宝枫生物科技(北京)有限公司2,北京 101300)
元宝枫(AcertruncatumBunge)是我国特有的树种,具有景观造林、油品加工及医学用药等方面的应用和开发价值[1]。元宝枫籽油富含亚油酸(C18∶2)、油酸(C18∶1)等不饱和脂肪酸,质量分数高达92%,优于其他食用油,如葵花籽油、菜籽油和花生油等[2]。另外,元宝枫籽油中质量分数为3%~7%的是神经酸,一种来源稀少但对人类健康,尤其是在大脑发育和维护方面至关重要的极长链脂肪酸[3]。元宝枫籽油于2011年获我国卫生部批准作为新资源食品,也是可用于量产神经酸的重要木本油料资源之一[4]。
代谢组学是一种涉及对生物系统中完整的内源代谢物进行全面分析的方法[5]。随着对内源性代谢物的整体及其变化的检测、量化和分类,探索生物体代谢变化规律或变化过程的本质[6]。脂质在生命活动中扮演十分重要的角色,对生物体的健康及疾病发展具有深刻意义。脂质组学作为代谢组学的一个分支,越来越多应用于生物体疾病的发生与发展等方面的研究。
肠道菌群是人体最大的微生态系统,对人体的物质和能量代谢具有重大影响。肠道菌群的构成受到饮食等各种环境因素的影响[7]。微生物-肠-脑轴是肠道菌群、肠道和大脑之间的双向通讯网络,通过炎症及内分泌系统相互作用调节免疫、胃肠和中枢神经系统功能[8]。膳食脂肪酸摄入对塑造微生物群落组成方面具有重要作用[9]。肠道菌群及其代谢物不仅调节人体健康,而且在连接饮食和宿主方面具有重要意义[10]。大量研究表明宿主先天/适应性免疫系统与肠道菌群之间存在动态相互作用[11, 12]。肠道菌群的失调可能会损害宿主的免疫反应并导致各种炎症性疾病的发展[10]。在小鼠模型中,元宝枫籽油膳食补充能有效抑制由高脂[13]或脂多糖[14]摄入导致的肠道炎症反应及代谢紊乱等问题,并促进肠道健康。孙朋浩等[15]通过对小鼠喂食元宝枫籽来探究其肠道菌群的变化,发现元宝枫籽对机会性致病菌具有一定程度的抑制作用。元宝枫籽中的脂肪酸对肠道菌群及代谢物的影响,以及二者之间的相互作用鲜见报道。
实验室前期工作已证明了元宝枫籽油的膳食补充可促进动物学习和记忆能力显著提高,并通过对血清和脑组织的脂质组学分析找出了起效的生物标志物和潜在的代谢通路[16]。为进一步了解元宝枫籽油的摄入对肠道菌群及肠-脑轴的潜在影响,采用16 S rDNA测序技术联合脂质组学的手段,对摄入元宝枫籽油后大鼠的肠道菌群和粪便代谢物进行综合分析,为元宝枫籽油针对肠-脑轴相关的医药开发提供参考。
1 材料与方法
1.1 材料
6~8周龄雄性SD大鼠,体重180~200 g,购于维通利华实验动物中心(中国北京)。动物均处于室内温度(22±2)℃、相对湿度45%、12 h昼夜循环采光的适宜环境中,可自由进食、饮水。
乙腈和甲醇均为色谱级。
元宝枫籽油的成分由中国北京PONY谱尼测试集团,以GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》[17]方法测定,结果详见表1[16]。

表1 元宝枫籽油的脂肪酸构成[16]
1.2 仪器与设备
ACQUITY超高效液相色谱(UPLC),XEVO-G2XS三重四极杆飞行时间(QTOF)质谱,电喷雾离子源(ESI)。
1.3 方法
1.3.1 动物实验方法及样品采集
20只大鼠随机分为两大组(n=10/组):对照组和处理组。大鼠在正式实验前适应性饲养1周。元宝枫籽油通过灌胃法进行饲喂。根据卫生部2011年第9号文件的推荐用量,神经酸的每日补充剂量应不高于300 mg,以人体重60 kg,人与大鼠的给药换算系数6.3,可计算出神经酸的给药量为30mg/kg。研究中神经酸在元宝枫籽油中质量分数6.8%,计算可得元宝枫籽油的给药剂量为442 mg/kg。为避免其他油料中含有同类脂肪酸对研究的干扰,给对照组灌胃相同剂量生理盐水。所有动物连续灌胃7 d,收集第1天、第7天的粪便样本,于-80 ℃备用。
本实验单位使用许可证编号为SCXK(京)2016-0006;动物质量合格证编号为No.11001119110-67847。实验经北京维通利华实验动物技术有限公司机构实验动物管理和使用委员会批准,符合实验动物饲养和使用的相关规定。通过北京维通利华实验动物技术有限公司机构实验动物管理和使用委员会的动物伦理审查(No. P2019070)。
1.3.2 肠道菌群16 S rDNA测序
大鼠粪便样本委托杭州联川生物技术股份有限公司进行16 S rDNA高通量测序分析。提取样品总DNA后检测样品的纯度和浓度。对16 S rDNA基因的V3+V4测序区域用通用引物进行PCR扩增。AxyPrep DNA GelExtraction Kit用于纯化扩增子。产物经过定量和均一化后形成测序文库,随后进行文库质检,合格的产物使用IlluminaMiSeq平台对其进行测序。
1.3.3 脂质组学样品制备
称取0.1 g粪便样品于1 mL预冷的异丙醇中,涡旋1 min后在室温静置10 min,随后将混合物在-20 ℃储存过夜。之后将样品在14 000 r/min下离心20 min,将上清液转移到新试管中,以V异丙醇∶V乙腈∶V水=2.5∶1∶1,稀释至110,储存在-80 ℃备用。
1.3.4 脂质组学测定方法
样品通过ACQUITY的UPLC和XEVO-G2XS QTOF质谱和ESI进行分析。样品脂质成分分离在Acquity超高效液相色谱与C18反相色谱柱(2.1×100 mm,1.7 μm,Waters)上进行。流动相为:A相为含有0.1% 甲酸乙腈/水(60∶40)的10 mmol/L甲酸铵溶液;B相为含有质量分数0.1%甲酸异丙醇/乙腈(90∶10)的10 mmol/L甲酸铵。流动相的流速为0.4 mL/min,初始条件为B相40%。按照洗脱条件对样品进行分离洗脱:0~2 min,B相40%、2~2.1min,B相43%、2.1~12 min,B相50%、12~12.1 min,B相54%、12.1~18 min,B相70%、18~18.1 min,B相99%、18.1~20 min,B相回到40%。
样品进样量为1 μL。采用Xevo-G2XS QTOF质谱仪检测阳性和阴性模式的脂质离子,质谱仪在m/z为50~1200的MSE模式下操作,采集时间为0.2 s。源温度为120 ℃。脱溶剂温度为550 ℃,气体流量为1 000 L/h,流动气体为氮气。毛细管电压为2.0 kV (+)/1.5 kV(-),锥体电压为20 V。以亮氨酸脑啡肽(200 pg/μL,V乙腈∶V水=1∶1)作为锁定质量用于精确质量测定,并用0.5 mmol/L甲酸钠溶液进行校正。
1.4 数据处理分析
1.4.1 微生物多样性分析
使用Greengenes数据库(V.13.8)选择具有100%相似性的操作分类单位(OTU)进行分类鉴定,以分析16 S rDNA测序数据[18]。将OTU的代表性序列与微生物参考数据库进行比对,得到每个OTU对应的物种分类信息,然后统计每个样本的组成(门、纲、目、科、属和种)。在此基础上,利用QIIME2软件生成了不同分类级别的物种丰度表。
1.4.2 脂质组数据处理
原始质谱数据集在Waters XEVO-G2XS QTOF仪器上生成,并由Progenesis QI 2.0软件处理。为了识别和评估两组间的特征,使用MetaboAnalyst网站进行组学分析,并用R语言中vegan 26包中进行单变量和多变量分析。
2 结果与分析
2.1 肠道菌群变化分析
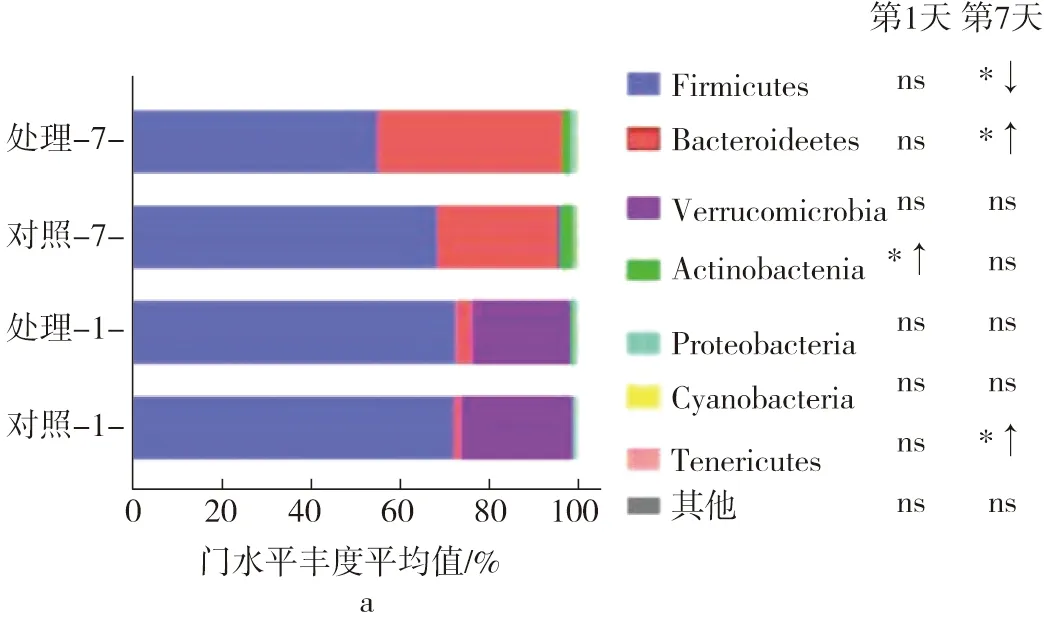
大脑发育及功能维持与存在于人体肠道中的复杂菌群结构有关[19]。肠-脑轴对维持稳态具有重要意义,而肠道菌群被认为是肠-脑轴调节的关键之一[20]。连续补充元宝枫籽油7 d后,采集第1天和第7天2组大鼠的粪便样本,利用16 S rDNA基因测序对V3和V4区域进行焦磷酸测序,分析肠道菌群的构成变化。如图1所示,处理组和对照组之间Chao1指数、Simpson指数和Shannon指数没有显著,说明元宝枫籽油的补充对大鼠肠道菌群的多样性和丰富度没有显著影响。进一步在门、纲、目、属水平上分析菌群丰度的结果显示,元宝枫籽油的补充使得对照组和处理组之间的肠道菌群构成出现了显著差异(图2a~图2e)。

图1 大鼠肠道菌群alpha多样性指数




注:*表示与对照相比P<0.1。
门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是优势菌门。元宝枫籽油处理第7天厚壁菌门丰度显著下降,而拟杆菌门显著上升(图2a)。研究表明,在阿尔茨海默病模型的小鼠和患者中,厚壁菌门和放线菌门的丰度会增加,而拟杆菌的水平会降低[21, 22]。并且随着疾病的发展,失调的菌群会影响神经炎症和淀粉样蛋白变性的发生[21]。
元宝枫籽油的补充对梭菌纲(Clostridia)和梭菌目(Clostridiales)均有显著的调节作用(图2b、图2c)。PAP小鼠是常用于研究阿尔兹海默病的模型动物,研究发现,PAP鼠肠道菌群中梭菌纲和梭菌目的丰度长期低于正常动物水平[23]。而梭菌纲和梭菌目均对于元宝枫籽油的摄入响应较为敏感。
属水平上,艾克曼菌(Akkermansia)、罗姆布茨菌(Romboutsia)和Paramuribaculum丰度在第1天和第7天均显著降低,而拟杆菌属(Bacteroides)显着增加。在自闭症鼠模型研究发现,其肠道艾克曼菌水平显著提高[24],拟杆菌丰度显著下降[25]。近年来研究人员将基于调整肠道菌群的手段应用于自闭症和情感障碍患者的治疗当中,获得了有效的改善[26]。此外,乳杆菌属(Lactobacillus)和瘤胃球菌(Ruminococcaceae)_UCG-013的丰度明显降低,而瘤胃球菌_UCG-014显著提高;处理组的瘤胃球菌_UCG-014和毛螺菌(Lachnospiraceae)_NK4A136在第7天显著下降,而普雷沃氏菌(Prevotellaceae)_UCG-001和普雷沃氏菌_NK3B31显著增加(图2e)。拟杆菌与体内的物质和能量代谢有关[27]。普雷沃氏菌参与肠黏膜黏蛋白的合成、发酵可溶性纤维、产生具有营养神经细胞和抗炎作用的短链脂肪酸[28]。阿尔兹海默病的发展过程中,瘤胃球菌_UCG-014和毛螺菌与促炎性外周免疫T细胞(Th1)和神经炎性小胶质细胞(M1)相关,而普雷沃氏菌_UCG-001与参与神经保护性外周T免疫细胞(Th2)和小胶质细胞(M2)相关[21]。元宝枫籽油的补充可促进神经保护作用的相关菌群,同时抑制神经炎症相关菌群,有效调节肠道菌群的构成,因此具有开发多种精神障碍的食疗资源的潜力。
统计属水平上丰度前15的菌群的层次聚类热图显示,元宝枫籽油使大鼠肠道菌群组成发生了显著变化(图2f)。
2.2 粪便代谢标志物筛选
肠道菌群结构的变化会影响肠道的代谢,采用非靶向脂质组学方法分析两组大鼠的粪便样本,并用Progenesis QI 2.0分析粪便代谢物数据,获得5118个特征化合物。其中正离子模式下53.76%(1 508/2 805)的化合物与脂质或类脂化合物相容的特征性分子种类匹配,在负离子模式下可获得34.03%(803/2 313)的化合物。正交偏最小二乘判别分析(OPLS-DA)对代谢物进行进一步考察。通过OPLS-DA模型获S-plot图(图3a、图3c),在P<0.05、处理组/对照组倍数的对数绝对值大于0.5的标准下,获得差异物火山图(图3b、图3d)。在变量重要性投影(VIP)>1.0,P<0.05条件下处理组第1天可检出111个显著差异的代谢物,第7天检出101个差异代谢物。
注:火山图中,TRUE(黑色)代表符合筛选标准的代谢物,FALSE(灰色)代表不符合筛选标准的代谢物。
为了找出补充元宝枫籽油变化的核心化合物,基于OPLS-DA的结果提高筛选标准:差异化合物的倍数变化(处理组/对照组)≥1.4或≤0.7,VIP>5.0,最终得到9种代谢物作为标志物,详见表2。其中,含有C160以及C241支链的代谢物可以作为补充元宝枫籽油的粪便生物标志物,即第1天的磷脂酰胆碱(PC)[(241(15Z)/160)],以及第7天的磷脂酰乙醇胺(PE)(140/160)、PC(241(15Z)/160)和PE(160/15∶0)。这些结果表明元宝枫籽油中的成分参与了生物体以及肠道菌群的代谢过程,进而对宿主的生物学进程产生了影响。

表2 粪便标志物
2.3 粪便生物标志物和与肠道菌群的相关性分析
为了解元宝枫籽油补充后肠道菌群和代谢物之间相互作用,进行相关性分析。补充第1天(图4a),粪便代谢物CE[20∶5(5Z,8Z,11Z,14Z,17Z)]与艾克曼菌、罗姆布茨菌和瘤胃球菌_UCG-013呈显著正相关(P<0.05),而与Paramuribaculum呈负相关;PC[24∶1(15Z)/16∶0]与乳杆菌属和Paramuribaculum呈正相关,与罗姆布茨菌和瘤胃球菌_UCG-013呈负相关;乳酰胺B与瘤胃球菌_UCG-014及瘤胃球菌_UCG-013成显著正相关。补充后PC[24∶1(15Z)/16∶0]是连续出现且含量积累的唯一一种代谢产物,其结构中含有神经酸(C24∶1)脂肪酸链。并且显著关联的菌群种类最多。因此推测PC[24∶1(15Z)/16∶0]与菌群的调节密切相关。

注:空白框(无球)表示未达到显著相关性(显著性为P<0.05)。
第7天(图4b),PE(14∶0/16∶0)与乳杆菌属显著正相关,与罗姆布茨菌显著负相关;Pitheduloside D与瘤胃球菌_UCG-014和毛螺菌_NK4A136_group均显著负相关;熊胆酸与艾克曼菌和毛螺菌_NK4A136_group均显著正相关;PC[24∶1(15Z)/16∶0]与拟杆菌、普雷沃氏菌_UCG-001和普雷沃氏菌_NK3B31_group显著正相关,与瘤胃球菌_UCG-014、罗姆布茨菌和毛螺菌_NK4A136_group显著负相关;PE(15∶0/15∶0)与普雷沃氏菌_UCG-001显著正相关,与Paramuribaculum显著负相关。4-甲氧基肉桂酰齐墩果酸甲酯和PE(16∶0/15∶0)与菌群均无显著相关性。
2.4 粪便代谢物和肠道菌群间的相互作用和功能预测
基于KEGG数据库对属水平的肠道菌群进行功能预测分析,见图5。元宝枫籽油补充1 d后,显著变化的肠道菌群所影响的相关功能主要与代谢疾病、复制与修复、消化系统、代谢、翻译、免疫系统、核苷酸代谢、信号分子与相互作用、内分泌系统等有关;补充7 d后,显著变化的菌群与酶家族显著相关(P<0.1)。

图5 肠道菌群基于KEGG数据库的功能预测分析
2.5 粪便标志物影响的代谢通路分析
为了解粪便代谢物的潜在代谢途径,利用Cytoscape对粪便生物标志物进行网络分析,将不同的生物标志物及其代谢转化过程中的关键化合物抽象为节点,并用连接来展示不同节点之间的关系,并分析节点间的转化路径以及涉及的代谢通路。通过分析可知,显著变化的8种脂肪酸类代谢物主要通过花生四烯酸代谢、胆汁酸生物合成、甘油磷脂代谢、亚油酸盐代谢以及磷脂酰肌醇磷酸代谢等途径进行相互转化。利用MetaboAnalyst 5.0网站对8个生物标志物进行进一步的通路分析,用于探索元宝枫籽油补充影响的重要生物代谢途径。由图6可见,与Cytoscape的处理结果相似,代谢通路(P<0.05),按照P值从小到大排列,分别是甘油磷脂代谢、类固醇生物合成、亚油酸代谢、α-亚麻酸代谢、糖基磷脂酰肌醇-锚定生物合成。

图6 MetaboAnalyst对粪便标志物的通路分析
联合粪便生物标志物以及显著改变的肠道菌群,以及二者各自影响的通路及功能,构建了代谢物-菌群-代谢通路相互作用网络(图7)。在肠道菌群方面,粪便代谢物的产生主要与10种细菌(乳杆菌属、艾克曼菌、瘤胃球菌_UCG-014、罗姆布茨菌、拟杆菌、普雷沃氏菌_UCG-001、毛螺菌_NK4A136、瘤胃球菌_UCG-013、Paramuribaculum、普雷沃氏菌_NK3B31)相关。这些菌群主要参与涉及代谢疾病、复制、修复、消化系统、代谢、翻译、免疫系统、核苷酸代谢、信号分子和相互作用、内分泌系统和酶家族等代谢路径。而这些菌群通过与粪便标志物与花生四烯酸代谢、胆汁酸生物合成、甘油磷脂代谢、亚油酸代谢和磷脂酰肌醇磷酸代谢有关。甘油磷脂已被证明在神经细胞中发挥结构和功能作用[29]。前期研究报道补充元宝枫籽油能提高动物的学习和记忆能力[16],因此实验中甘油磷脂代谢和花生四烯酸代谢的改变可能与补充元宝枫籽油后的大鼠神经系统的调节有关。有研究报道在小鼠上,甘油磷脂代谢异常与阿尔兹海默病相关[30];花生四烯酸代谢参与神经的早期发育[31]并对氧化应激发挥保护作用[32]。此外,Zellweger综合征也与胆汁酸合成途径有关[33]。
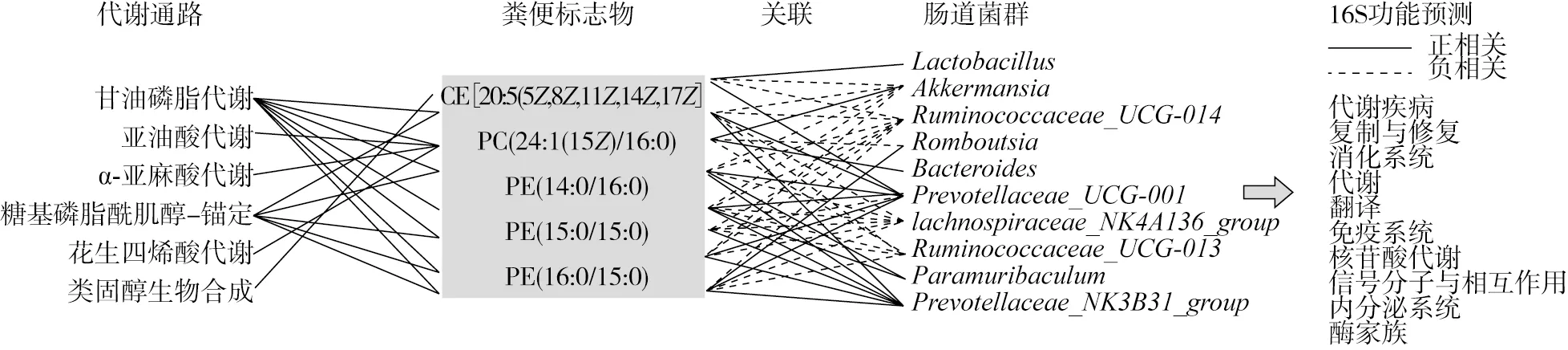
注:实线、虚线分别代表代谢物和微生物之间的正相关、负相关
3 结论
通过联合16S rDNA测序和LC-QTOF-MS的脂质组学技术,评估了膳食补充元宝枫籽油对大鼠肠道菌群和代谢物的影响。研究发现元宝枫籽油的摄入可引发大鼠肠道菌群结构的重塑,相关性分析显示这种变化与含有神经酸(C24∶1)支链的代谢物——PC[24∶1(15Z)/16∶0]密切相关。菌群结构的变化分析暗示与神经系统的部分功能相关。结果显示元宝枫籽油具有调节改善肠道菌群的效应,可能通过肠-脑轴对神经系统产生保护作用。
