长链非编码RNA OTUD6B-AS1、微RNA-365a-3p在肝癌中表达与临床病理特征及预后的关系
2023-10-17宋奇锋高良辉林师佈张译中沈立
宋奇锋,高良辉,林师佈,张译中,沈立
作者单位:海南医学院第一附属医院肝胆外科,海南 海口570100
肝癌是在全球范围内最常见的致命恶性肿瘤,而在所有的肝癌病人中,超过90%为肝细胞癌[1]。尽管近年来由于治疗方法的改进有效地降低了肝癌的发病率,但肝癌病人的长期预后仍不理想[2]。因此,探索有效的生物标志物对于改善肝癌的预后具有重要意义。长链非编码RNA(LncRNA)位于细胞核或细胞质中,长度超过200个核苷酸。虽然LncRNA不具备蛋白质编码能力,但它们在表观遗传学和调节基因表达方面具有重要作用[3]。已证实LncRNA参与脑发育、胚胎发育、组织学分化和器官发生,且已有大量研究表明LncRNA还参与了癌症中许多复杂的细胞过程[4]。例如,LncRNA人去泛素化酶含有卵巢肿瘤结构域的6B反义RNA1(OTUD6B-AS1)被证实在肝癌中高表达[5],然而,其在肝癌预后中的作用仍不清楚。微RNA(miRNA)是基因表达过程中重要调节因子,参与调控癌细胞增殖、转移、侵袭等过程,其在癌症中功能已得到普遍认可。miR-365a-3p在多种类型癌症中具有抑癌作用,已有研究表明miR-365a-3p能够通过靶向抑制E2F2表达,从而抑制肝癌细胞增殖[6];且另有研究认为,miR-365a-3p可作为肝细胞癌的预后生物标志物[7]。本研究通过Starbase数据库预测得出miR-365a-3p可能与LncRNA OTUD6B-AS1存在靶向关系。于是,在本研究中首先对肝癌病人血清中LncRNA OTUD6B-AS1、miR-365a-3p的表达进行检测,进而评估了其表达与预后的相关性,以期为肝癌病人做出最佳的临床治疗决策提供参考。
1 资料与方法
1.1 一般资料 纳入2015年3月至2017年3月海南医学院第一附属医院收治的肝癌病人86例(肝癌病人组),和同期体检的健康志愿者86例(健康对照组)。其中肝癌病人组男性54例,女性32例,年龄(55.32±5.38)岁。健康对照组男性48例,女性38例,年龄(54.25±4.86)岁。两组一般资料比较差异无统计学意义(P>0.05)。另外,收集整理肝癌病人肿瘤长径、TNM分期等临床病理特征资料。
纳入标准:①符合《原发性肝癌诊疗规范(2017年版)》[8]中诊断标准;②具备手术指征,行手术切除,术后经病理确诊为肝细胞癌;③病人入组前未接受过靶向治疗等相关治疗项目;④病人或其近亲属在充分了解研究目的和过程后签署知情同意书;⑤临床资料均完整,且获得长期随访。排除标准:①合并其他肿瘤;②患有肾脏疾病;③入院前感染;④合并严重的心脑功能障碍;⑤不愿配合后续研究;⑥有免疫缺陷。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 血清及组织样品收集 采集所有研究对象的外周血(5 mL),静置30 min,然后在3 000 r/min和25 ℃下离心10 min,收集血清用于后续检测。收集术中切除的肝癌组织及对应的癌旁组织,立即置于液氮中,随后放置在-80 ℃贮存。
1.3 血清及组织中LncRNA OTUD6B-AS1、miR-365a-3p表达检测 RNA分离试剂盒(15596018,美国Invitrogen)从血清样本及组织样本中提取总RNA。按照TransScript Green两步qRT-PCR Super-Mix试剂盒(AQ201-01,北京TransGen Biotech)说明书进行逆转录,并在StepOne™ Real-Time PCR系统(美国Applied Biosystems)上进行LncRNA OTUD6BAS1、miR-365a-3p表达检测。以β-actin或U6为内参使用2-ΔΔCt法计算相对表达量。引物序列见表1。

表1 引物序列
1.4 生物信息学分析 使用Starbase数据库对LncRNA OTUD6B-AS1与miR-365a-3p之间的靶向关系进行分析。
1.5 随访 随访5年,采用电话、微信随访,来院复查形式进行定期随访,获取疾病情况及生存资料,随访截止2022年4月30日,记录术后5年累积生存时间,即术后第1天至死亡时间。
1.6 统计学方法 本研究采用SPSS 22.0进行数据分析。GraphPad prism7用于绘制图像。计数资料以例(%)表示,组件比较采用χ2检验;符合正态分布的计量资料以表示,两组间比较为独立样本t检验或配对t检验。Pearson分析血清中LncRNA OTUD6B-AS1与miR-365a-3p表达的相关性。以Kaplan-Meier法绘制生存曲线,并通过log-rank检验比较生存率差异。Cox回归模型分析肝癌病人预后的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组血清及组织中LncRNA OTUD6B-AS1、miR-365a-3p表达水平比较 肝癌病人组血清LncRNA OTUD6B-AS1表达水平高于健康对照组,miR-365a-3p表达水平低于健康对照组(P<0.05),见表2。
表2 两组血清LncRNA OTUD6B-AS1、miR-365a-3p表达水平比较/

表2 两组血清LncRNA OTUD6B-AS1、miR-365a-3p表达水平比较/
组别健康对照组肝癌病人组t值P值例数86 86 LncRNA OTUD6B-AS1 1.02±0.32 1.59±0.41 10.16<0.001 miR-365a-3p 1.05±0.26 0.42±0.15 19.46<0.001
肝癌组织LncRNA OTUD6B-AS1表达水平高于对应的癌旁组织,miR-365a-3p表达水平低于对应的癌旁组织(P<0.05),见表3。
表3 肝癌病人肝组织LncRNA OTUD6B-AS1、miR-365a-3p表达水平比较/
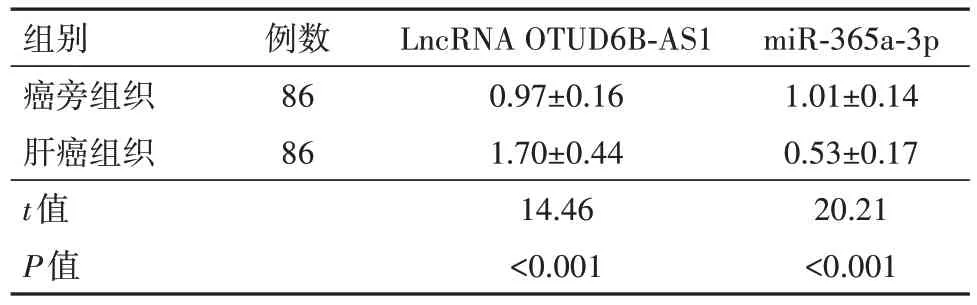
表3 肝癌病人肝组织LncRNA OTUD6B-AS1、miR-365a-3p表达水平比较/
组别癌旁组织肝癌组织t值P值例数86 86 LncRNA OTUD6B-AS1 0.97±0.16 1.70±0.44 14.46<0.001 miR-365a-3p 1.01±0.14 0.53±0.17 20.21<0.001
2.2 肝癌病人血清中LncRNA OTUD6B-AS1、miR-365a-3p表达与临床病理特征的相关性 以肝癌病人血清中LncRNA OTUD6B-AS1、miR-365a-3p表达水平中位数(1.57、0.43)为界限,其中LncRNA OTUD6B-AS1表达水平>1.57的病人为LncRNA OTUD6B-AS1高表达组(n=43),≤1.57的病人为LncRNA OTUD6B-AS1低表达组(n=43),miR-365a-3p表达水平>0.43的病人为miR-365a-3p高表达组(n=43),≤0.43的病人为miR-365a-3p低表达组(n=43)。结果显示,肝癌病人血清LncRNA OTUD6B-AS1、miR-365a-3p表达水平与TNM分期、淋巴结转移、分化程度有关(P<0.05),与性别、年龄、肿瘤长径、乙肝病毒、血管侵犯无关(P>0.05)。见表4。
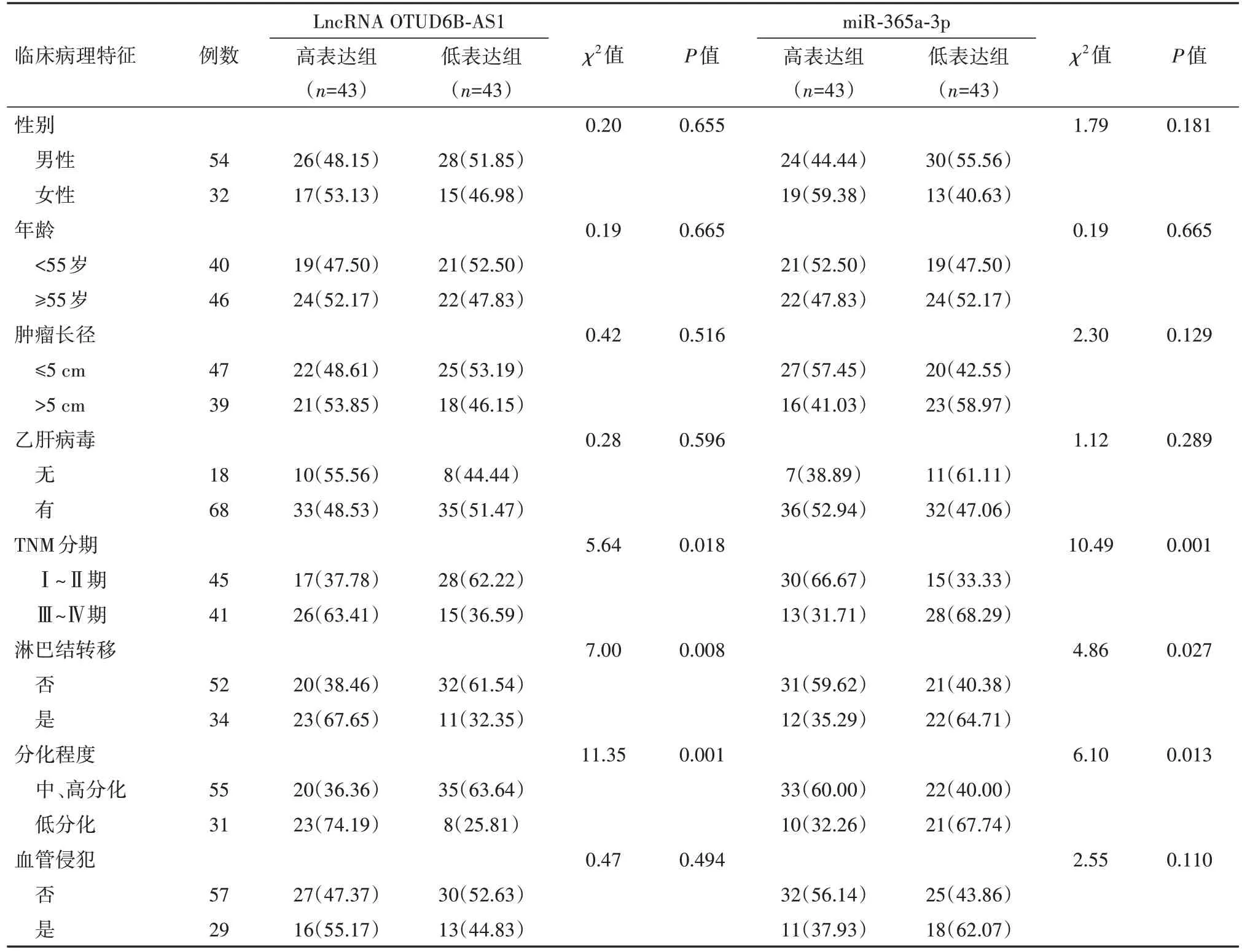
表4 肝癌病人86例血清中LncRNA OTUD6B-AS1、miR-365a-3p表达与临床病理特征的相关性/例(%)
2.3 肝癌病人血清中LncRNA OTUD6B-AS1与miR-365a-3p表达的相关性分析 经Starbase数据库预测发现,LncRNA OTUD6B-AS1与miR-365a-3p之间存在靶向结合位点,经Pearson相关性分析显示,肝癌病人血清中LncRNA OTUD6B-AS1与miR-365a-3p表达呈现负相关(r=-0.47,P<0.05)。见图1。
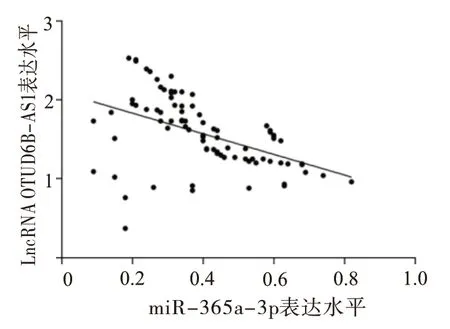
图1 肝癌病人血清中LncRNA OTUD6B-AS1与miR-365a-3p表达的相关性
2.4 肝癌病人血清中LncRNA OTUD6B-AS1、miR-365a-3p表达与预后的相关性 所有病人随访5年,死亡64例,86例肝癌病人的生存率为25.58%(22/86)。LncRNA OTUD6B-AS1低表达组生存率37.21%(16/43)高于LncRNA OTUD6B-AS1高表达组13.95%(6/43)(χ2=6.11,P=0.013);miR-365a-3p高表达组生存率41.86%(18/43)高于miR-365a-3p低表达组9.30%(4/43)(χ2=8.03,P=0.005)。
以预后(死亡=1,存活=0)为自变量,将单因素分析有差异因素为自变量,多因素Cox回归分析显示,LncRNA OTUD6B-AS1高表达以及miR-365a-3p低表达是影响肝癌病人死亡的独立危险因素(P<0.05)。见表5。

表5 Cox回归分析影响肝癌86例预后的影响因素
3 讨论
肝癌是全球最常见的胃肠道恶性肿瘤,好发于过度饮酒、感染肝炎病毒、肝硬化等人群,近年来发病率和死亡率呈明显的上升趋势,危害大[9]。由于早期肝癌的临床症状比较隐蔽,诊断时病情常较严重,即可能已发展至中期,甚至是晚期,临床治疗效果不好。且早发现、早治疗的肝癌病人较中晚期病人生存时间长。因此,探讨能辅助评估肝癌病人预后的指标至关重要。
LncRNA是长度超过200 nt非编码RNA,在表观遗传变化、转录调控和转录后修饰中发挥作用[10],通过对miRNA和靶蛋白的靶向调控,参与各种疾病的发生和发展。已有研究表明LncRNA参与并调控肿瘤细胞增殖、迁移、上皮间质转化等过程,与肝癌等多种恶性肿瘤有关[11]。LncRNA OTUD6BAS1也是LnRNA中的一员,近期张小博等[5]报道也证明LncRNA OTUD6B-AS1可促进肝癌细胞发展。另有学者发现,LncRNA OTUD6B-AS1在肝癌组织中高表达,通过miR-664b-3p调节GSKIP/Wnt/β-catenin信号传导增强肝癌细胞增殖和侵袭[12]。本研究结果显示,LncRNA OTUD6B-AS1在肝癌病人血清及肝癌组织中高表达,与既往报道一致[12],且与肝癌病人的TNM分期、淋巴结转移以及分化程度有关,说明LncRNA OTUD6B-AS1表达升高可能参与肝癌发生及病情恶性进展,其机制可能与LncRNA OTUD6B-AS1能靶向调控肝癌病理机制中关键基因进而调控信号转导有关。
miRNA作为一种新型生物标志物,在癌细胞的细胞周期、分化和细胞凋亡中发挥着至关重要的作用[13]。大量研究表明,miR-365a-3p在多种人类癌症中充当肿瘤抑制因子,如Yang等[14]表明miR-365a-3p过表达可诱导胃癌细胞周期停滞在G1期,显著抑制细胞增殖;黄君华等[15]研究显示,miR-365a-3p与三阴性乳腺癌的不良进展相关,可通过调节JAKSTAT通路抑制肿瘤恶性进展。但miR-365a-3p在肝癌中的作用尚不清楚,因此,本研究检测了血清及肝癌组织中miR-365a-3p表达情况,结果显示,肝癌病人血清及肝癌组织中miR-365a-3p表达降低,说明miR-365a-3p可能与肝癌的发生有关,且血清与癌组织中miR-365a-3p表达具有一致性。进一步研究发现,miR-365a-3p表达与肝癌病人TNM分期、淋巴结转移、分化程度有关,提示miR-365a-3p可能参与并影响肝癌发展过程,其可能在肝癌发病过程中发挥抑癌基因作用。本研究还发现,LncRNA OTUD6B-AS1高表达与miR-365a-3p低表达肝癌病人具有更低的5年累积生存率,且LncRNA OTUD6B-AS1高表达及miR-365a-3p低表达均为肝癌病人预后不良独立危险因素,提示LncRNAOTUD6B-AS1与miR-365a-3p可作为评估肝癌预后的标志物。另外,通过Starbase数据库分析发现,LncRNA OTUD6B-AS1与miR-365a-3p存在结合位点,相关性分析也证实肝癌病人血清中LncRNA OTUD6B-AS1与miR-365a-3p表达水平呈明显负相关,说明二者可能共同参与肝癌发生发展。
综上所述,肝癌病人血清及肝癌组织中LncRNA OTUD6B-AS1表达上调,miR-365a-3p表达下调,与TNM分期、淋巴结转移、分化程度有关,二者的异常表达可作为肝癌病人的预后评估标志物。然而,本研究仍存在不足之处,肝癌病人中乙肝病毒感染率较高,可能影响LncRNA OTUD6B-AS1、miR-365a-3p检测水平的准确性;LncRNA OTUD6BAS1、miR-365a-3p参与肝癌的具体调控机制还需深入探究。
