α-半乳糖基神经酰胺静脉注射对小鼠肝脏恒定性自然杀伤T细胞及亚群的影响
2023-10-17陈俊玉张景楠彭楠滕景芳曹彩霞孟明王彦
陈俊玉,张景楠,彭楠,滕景芳,曹彩霞,孟明,王彦
作者单位:1河北大学附属医院检验科,河北 保定071000;2河北大学基础医学院,河北 保定071000;3保定市中心血站,河北 保定071000
自然杀伤T细胞(natural killer T cell,NKT cell)是一类兼具T细胞相关受体和自然杀伤细胞(natural killer cell,NK cell)相关受体的淋巴细胞亚群。根据细胞是否表达恒定TCR链,NKT细胞可分为恒定性NKT(invariant NKT,iNKT)细胞与多样性NKT(diverse NKT,dNKT)细胞。通过CD1d分子提呈的糖脂类抗原可与iNKT细胞的TCR结合使其活化,活化的iNKT细胞可迅速高效地分泌大量细胞因子和趋化因子[1],通过与其他免疫细胞的相互作用,调控机体的免疫系统,在造血、肿瘤、自身免疫病等方面发挥重要的作用[2-4]。根据其分泌细胞因子的不同,iNKT细胞可分为iNKT1、iNKT2、iNKT10及iNKT17亚群[5],分别分泌干扰素-γ(IFN-γ)、白细胞介素(IL)-4、IL-10、白细胞介素-17(IL-17)。不同的iNKT细胞亚群功能不同,甚至截然相反,故iNKT细胞不同方向的激活以及亚群的差异分布,可调控免疫反应朝不同的方向进展,并且产生不同强度的免疫反应,对机体起到双向调节作用[6]。
α-半乳糖基神经酰胺(α-GalCer)是一种从海绵中提取的糖脂类物质,可特异性激活iNKT细胞,刺激其增殖活化并释放多种促炎和抑炎因子[7],在不同器官中引起不同亚群的变化。研究表明,肝组织中存在大量的 iNKT 细胞,约为其他器官的20~100倍,约占肝脏总淋巴细胞数的20%~35%[8],是体内重要的免疫反应器官。大量研究表明,iNKT细胞与许多肝脏疾病如乙型病毒性肝炎、肝癌、自身免疫性肝病等有着密切的关系[9-11]。由于iNKT细胞对机体的调控具有双向功能,因此研究如何使iNKT细胞向保护机体的方向分化至关重要。本研究自2022年1―3月通过采用静脉注射α-GalCer的方式,用流式细胞仪在注射完成后第2、4、6、8、10天对小鼠肝脏中的 iNKT 细胞频率和亚群进行检测,外周血血清中 IL-4,IFN-γ,IL-17A 的表达水平采用酶联免疫吸附测定(ELISA)检测,来探讨静脉注射α-GalCer对肝脏中iNKT细胞增殖与分化的影响,从而为临床上肝脏相关疾病中以iNKT为靶标的免疫治疗提供基础实验依据。
1 材料与方法
1.1 动物 C57BL/6J雄性4~5 周龄小鼠。购自北京华阜康生物科技股份有限公司,许可证编号SCXK(京)2019-0008。饲养于 无特定病原体(SPF)级动物室内,所有动物均适应饲养1周后予以分组进行实验。大鼠的处理符合动物伦理学相关标准。
1.2 实验材料与仪器
1.2.1 材料 α-GalCer购于AdipoGen 公司,小鼠组织淋巴细胞分离液、0.5 mol/L 乙二胺四乙酸(EDTA)(pH8.0)、牛血清白蛋白(BSA)购于北京索莱宝生物科技有限公司,Foxp3/TRN Factor Stain Buffer购于Invitrogen 公司,FITC Hamster Anti-Mouse TCR-β、AlexaFluor®647-mouse anti-PLZF、BV421 Mouse Anti-Mouse RORγt购于美国BD Pharmingen公司,T-selected-CD1d tetramer-PE 购于日本MBL公司,PE/Cyanine7 anti-T-bet Antibody购于美国Biolegend公司。小鼠IFN-γ、IL-4、IL-17A ELISA试剂盒购于杭州联科生物技术股份有限公司。
α-GalCer 溶液的配制: 以100%的二甲基亚砜溶液(DMSO)溶解α-GalCer成浓度为1 g/L,用 磷酸盐缓冲溶液(PBS)稀释到10 mg/L,现配现用。
1.2.2 仪器 流式细胞仪FACS CantoII 为美国BD Pharmingen公司产品,酶标仪为美国Bio-tek EPOCH公司产品。
1.3 方法
1.3.1 动物分组 选择C57BL/6健康雄性小鼠60只,采用随机数字表法分为观察组和对照组,每组30只(每组分为5个时间点,每个时间点6只小鼠)。观察组以100 ng/g体质量的剂量注射α-GalCer,对照组以同样的注射方式注射相同剂量的生理盐水。
1.3.2 小鼠肝脏中淋巴细胞的获取 分别于注射后第2、4、6、8、10天取小鼠肝脏组织,在培养皿中加入适量的 PBS,润湿细胞筛,剪碎组织并研磨,制备单细胞悬液,1 000 r/min,4 ℃离心8 min,获取细胞沉淀,PBS重悬后转移到装有淋巴细胞分离液的离心管中,2 000 r/min,4 ℃,20 min进行密度梯度离心,分离出淋巴细胞。PBS 清洗离心,弃上清后获取单细胞悬液。
1.3.3 流式细胞术(FACS)检测肝脏中iNKT细胞频率 计数单细胞悬液并调整细胞密度,置于流式管中(每管1×106个细胞),加入anti-TCRβ 1 μL和α-GalCer负载的CD1d-tetramers 1 μL并混匀,4 ℃避光孵育30 min,1 mL PBS清洗重悬,1 000 r/min,4 ℃离心5 min,弃上清,加500 μL PBS重悬,FACS检测。
1.3.4 FACS 检测肝脏中 iNKT 细胞亚群 同“1.3.3”,清洗弃上清后,依据 Foxp3/Transcription Factor Staining Buffer试剂盒的具体操作步骤对细胞进行透化固定处理,4 ℃避光45 min,加1 mL破膜缓冲液,4 ℃ 500g离心 5 min,弃上清,加入1 μL PLZF,1 μL T-bet和1 μL ROR-γt ,混匀,4 ℃避光孵育 30 min,加1 mL破膜缓冲液涡旋混匀,4 ℃条件下500g离心 5 min,弃上清,加 500 μL PBS 重悬,FACS上机检测。
1.3.5 ELISA检测外周血血清IL-4,IFN-γ,IL-17A水平 小鼠眼球血,4 ℃条件下,12 000 r/min离心8 min,离心后血清转移到EP 管中,-20 ℃保存,检测前低温复溶。采用杭州联科生物技术股份有限公司提供的Mouse IL-4、IFN-γ,IL-17A ELISA试剂盒进行检测,严格按照产品说明书进行操作。
1.4 统计学方法 所有数据用 SPSS 24.0 软件进行统计分析,计量资料结果经统计学检验符合正态分布,采用表示,各指标间比较采用多因素设计的方差分析,组内不同时间点比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠肝脏 iNKT 细胞频率及亚群的变化
2.1.1 肝脏iNKT细胞频率及亚群频率变化 组间比较发现,与对照组相比,静脉注射α-GalCer可引起肝脏iNKT细胞频率及亚群频率变化,且差异有统计学意义(F=198.40,P<0.001)。组内比较发现,对照组肝脏iNKT细胞频率及亚群频率变化与时间节点无关(P<0.05);静脉注射α-GalCer可引起肝脏iNKT细胞及亚群频率随时间推移呈波动性变化(P<0.05)。观察组不同时间点iNKT细胞频率比较差异有统计学意义(F=5.46,P=0.003)。静脉注射α-GalCer 第2天可使肝脏iNKT细胞达到较高水平,于第4天降至低于正常水平,随后逐渐恢复至正常水平(P<0.05)。与第2天相比,第4、6、8 和10天iNKT细胞频率均显著降低,均差异有统计学意义(P<0.05)。见表1。
表1 小鼠肝脏iNKT细胞频率变化/(%,)

表1 小鼠肝脏iNKT细胞频率变化/(%,)
注:①与第2天相比,P<0.05。
组别对照组观察组第10天3.14±0.35 2.51±0.11①鼠数6 6第2天2.72±0.19 20.87±2.15第4天2.72±0.19 5.61±0.51①第6天2.93±0.24 2.65±0.26①第8天3.06±0.45 2.62±0.64①
2.1.2 肝脏iNKT1亚群细胞频率变化 观察组iNKT1亚群细胞频率在各时间点的比较差异有统计学意义(F=7.19,P=0.001)。静脉注射α-GalCer可使肝脏iNKT1亚群频率降至低于正常水平,且随时间延长呈现上下波动,与第2天相比,第4天iNKT1亚群频率降低(P<0.05),第6天iNKT1亚群频率升高(P<0.05),第8天iNKT1亚群频率再次降低(P<0.05),直至第10天iNKT1亚群频率恢复至正常水平(P<0.05)。见表2。
表2 小鼠肝脏iNKT1细胞频率变化/(%,)

表2 小鼠肝脏iNKT1细胞频率变化/(%,)
注:①与第2天相比,P<0.05。
组别对照组观察组第10天3.12±0.11 3.25±0.53①鼠数6 6第2天3.68±1.02 1.04±0.37第4天2.74±0.21 0.48±0.12①第6天2.81±0.33 1.99±1.04第8天2.93±0.29 0.60±0.11
2.1.3 肝脏iNKT2亚群细胞频率变化 观察组各时间点iNKT2亚群细胞频率间差异有统计学意义(F=5.79,P=0.002)。iNKT2亚群细胞频率于注射α-Gal-Cer后第2天达到较高水平,后逐渐下降,与第2天相比,各时间点iNKT2亚群频率均显著降低,差异有统计学意义(P<0.05)。见表3。
表3 小鼠肝脏iNKT2细胞频率变化/(%,)

表3 小鼠肝脏iNKT2细胞频率变化/(%,)
注:①与第2天相比,P<0.05。
组别对照组观察组第10天36.37±1..18 6.26±1.28①鼠数6 6第2天38.03±1.70 75.13±3.48第4天40.13±3.20 33.83±9.08①第6天40.16±3.15 17.20±5.37①第8天38.03±1.70 12.00±1.99①
2.1.4 肝脏iNKT17亚群细胞频率变化 观察组各时间点iNKT17亚群细胞频率间的差异有统计学意义(F=4.02,P=0.012)。静脉注射α-GalCer可使肝脏iNKT17亚群频率低于正常水平,随后逐渐恢复,与第2天比较,第4和10天肝脏iNKT17亚群频率均显著提高(P<0.05)。第6和8天略有提高,但差异无统计学意义(P<0.05)。见表4。
表4 小鼠肝脏iNKT17细胞频率变化/(%,)

表4 小鼠肝脏iNKT17细胞频率变化/(%,)
注:①与第2天相比,P<0.05。
组别对照组观察组第10天4.17±0.14 2.72±1.09①鼠数6 6第2天4.53±1.29 0.17±0.06第4天4.35±1.29 4.13±1.08①第6天3.11±0.33 1.44±0.45第8天3.90±0.33 1.17±0.26
2.1.5 各时间点肝脏iNKT17各亚群细胞频率变化 第2、4天观察组与对照组的iNKT细胞频率相比,差异有统计学意义;除第10天外,其他时间点观察组iNKT1亚群细胞频率与对照组差异有统计学意义(P<0.05);除第4天外,其他时间点iNKT2及iNKT17亚群细胞频率与对照组比较差异有统计学意义(P<0.05)。
2.2 不同时间血清细胞因子的变化情况 与第2天相比,观察组静脉注射α-GalCer后IL-4水平于第6天降低; IFN-γ水平于第6天和第8天降低;IL-17A水平于第8天升高,均差异有统计学意义(P<0.05)。两组第6天IL-4水平比较,差异有统计学意义;两组各时间点IFN-γ浓度比较,差异有统计学意义;除第6天外,两组IL-17A的浓度差异有统计学意义。见表5。
表5 两组小鼠外周血血清细胞因子浓度比较/(ng/L,)
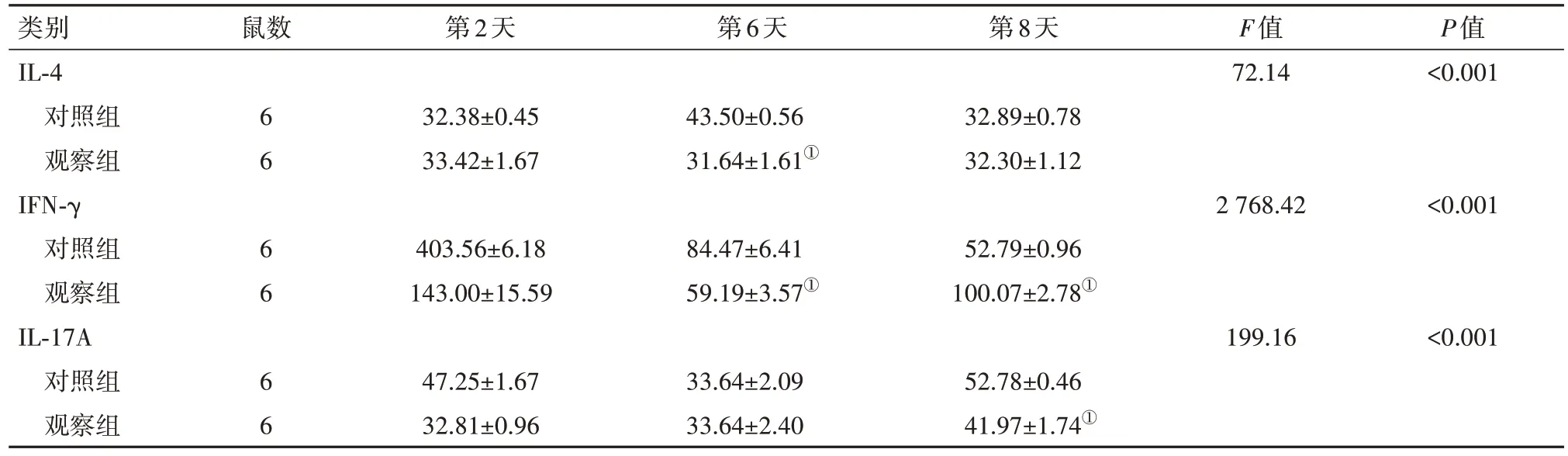
表5 两组小鼠外周血血清细胞因子浓度比较/(ng/L,)
注:IL-4为白细胞介素-4,IFN-γ为干扰素-γ,IL-17A为白细胞介素-17A。①与观察组第2天 相比,P<0.05。
类别IL-4对照组观察组IFN-γ对照组观察组IL-17A对照组观察组鼠数第2天第6天第8天F值72.14 P值<0.001 6 6 6 6 6 6 32.38±0.45 33.42±1.67 43.50±0.56 31.64±1.61①32.89±0.78 32.30±1.12 2 768.42<0.001 403.56±6.18 143.00±15.59 84.47±6.41 59.19±3.57①52.79±0.96 100.07±2.78①199.16<0.001 47.25±1.67 32.81±0.96 33.64±2.09 33.64±2.40 52.78±0.46 41.97±1.74①
3 讨论
最新研究显示,iNKT细胞可分为四个主要亚群包括iNKT1、iNKT2、iNKT17和iNKT10,目前普遍认为,肝脏和脾脏中主要包含iNKT1亚群,iNKT2亚群则主要分布在胸腺、脾脏和肺中,iNKT17亚群主要存在于淋巴结、肺和皮肤中,iNKT10为近几年在脂肪组织中发现的一种新的iNKT亚群[12]。本研究主要检测了肝脏中的iNKT1、iNKT2、iNKT17三种亚群,结果显示肝脏中iNKT2亚群频率高于iNKT1亚群,与多数研究不符。之前有一项研究发现[13],iNKT细胞在自然活化状态下能够抑制肝脏炎性介质的增多与聚集从而达到保护肝组织的目的,这说明机体在正常情况下,是处于保护机体的状态,能够通过某种机制控制炎症因素的产生与扩大,因此本实验中对照组小鼠肝脏iNKT2亚群频率高于iNKT1亚群,可能是小鼠处于对自身机体的保护状态下。
静脉注射α-GalCer后,肝脏iNKT1亚群低于正常水平,后逐渐升高,于第10天升至正常水平;iNKT2亚群高于正常水平,但随时间逐渐下降;iNKT2亚群频率始终高于iNKT1亚群。而以往有实验研究显示,静脉注射α-GalCer能使脾脏和肝脏中的NKT1细胞被激活[14]。可能是因为此次实验中正常情况下时iNKT2亚群就高于iNKT1亚群,再加上注射α-GalCer后,机体对于抗原的侵入所做出的应答为抑炎效应大于促炎效应。许多研究表明,iNKT细胞在激活后很快(在8~12 h内)变得不可检测[15],其TCR受体在8~12 h时下调最为明显,之后表达水平再次升高,在24~48 h时恢复正常水平。因此,iNKT1亚群频率的下调,可能是因为其表面的TCR受体下调,导致其被检出受限,并非真正数量上的减低。
iNKT17细胞亚群主要分布在淋巴结、肺和皮肤等组织中,在肝脏、脾脏等组织中含量较低,正常对照组中,iNKT17亚群频率低于iNKT1亚群和iNKT2亚群,在注射α-GalCer后iNKT17亚群频率也始终低于正常对照组,可能与此有关[16]。另外在我们前期的一项研究中[17],通过单次及多次尾根皮下注射α-GalCer,观察各个脏器iNKT细胞及亚群的变化,结果显示注射α-GalCer后能诱导iNKT 细胞明显增殖,各器官中的iNKT亚群变化也有较大差异,这两项实验均说明不仅iNKT细胞的分布具有器官组织特异性,iNKT对于刺激做出反应进而向不同亚群分化时,在不同组织中也有着较大差异,也进一步说明iNKT细胞亚群的器官组织定位以及所产生细胞因子的种类和运作方式的重要性。
iNKT细胞是先天性淋巴细胞,联系着先天性免疫和适应性免疫。与适应性免疫细胞相比,它们具有成熟的效应表型,使其能够快速对刺激做出应答。本研究中,静脉注射α-GalCer后第2天,iNKT细胞的频率即迅速升高,除iNKT细胞能迅速对刺激做出应答的原因外,还可能与静脉注射的方式有关,静脉给药途径是将物质输送到动物体内的最有效途径,药物能迅速进入血液,起效快[18],另外由于在血液中代谢较快,静脉注射抗原免疫应答持续时间短,也就导致结果变化较为迅速。
iNKT1细胞在激活时主要分泌IFN-γ;iNKT2细胞则主要产生IL-4、IL-13和IL-5;iNKT17细胞分泌大量IL-17[5]。分泌IFN-γ的iNKT细胞和分泌IL-17的iNKT细胞可促进肝脏炎症的病理进程,分泌IL-4的iNKT细胞则发挥抑制炎性反应的作用。观察组血清IFN-γ自注射后即低于正常水平(P<0.05),到第8天超过正常水平(P<0.05),与iNKT细胞亚群的变化一致。在一项来自幼稚小鼠的离体iNKT细胞的分析中显示[19],在体内暴露于抗原的2 h内,肝脏中的大多数iNKT细胞就会同时产生IL-4和IFN-γ。而本实验中显示血液中IL-4和IFN-γ水平的变化有着明显的时间差异,这说明iNKT细胞激活后,组织中的细胞因子与血液中的细胞因子可能在数量及种类上有着不同程度的差异,加上本实验采集外周血的时间与注射时间间隔较长,导致未能及时捕捉到血液中细胞因子初始的变化情况,所以,外周血血清中的细胞因子水平与组织中iNKT细胞的增殖活化的关系尚需进一步研究探讨。
IL-17家族有A~F六个成员,其中关于IL-17A的研究较多[20],实验结果显示,观察组IL-17A水平一直低于对照组,IL-17A是一种参与慢性炎症的促炎因子,在一项由α-GalCer诱导的急性肝功能衰竭的模型中发现,IL-17的分泌增加在加快疾病进展方面起着重要作用[21]。再次说明此实验中小鼠对于抗原刺激所产生的效应以保护机体为主。
α-GalCer等外源性糖脂类抗原刺激体内iNKT细胞,使其能够迅速产生IL-4和IFN-γ。有研究表明,静息的iNKT细胞具有高水平的IL-4和IFN-γ mRNA,在高水平表达IL-4和IFN-γ mRNA的T细胞中存在的一种识别基序家族RNA结合蛋白TIA-1和TIAR的编码mRNA,同样存在于iNKT细胞中,同时还发现编码趋化因子RANTES(CCL5)的mRNA在iNKT细胞中具有组成性表达[22-23]。这些发现表明,iNKT调节其细胞因子分泌的机制可能在某种程度上与之有关,这也可能是细胞能做出快速反应的原因之一。但它是否适用于iNKT细胞产生的所有细胞因子及趋化因子,以及它们具体的作用机制,是我们下一步需要研究探讨的问题。
iNKT细胞和细胞因子、趋化因子、其他免疫细胞及免疫组织微环境等互相交织成一张复杂的免疫网络,其功能的多样性提示我们它在机体中发挥作用的复杂性,α-GalCer重复处理会导致无能,有研究依据iNKT细胞功能的双面性,设计了一种“双重打击”的方法治疗脓毒血症,使iNKT细胞能够逃脱无能并在双相败血症中发挥有益作用[24]。这说明合理利用iNKT细胞的免疫双重功能来治疗疾病是未来一大热点。
综上所述,静脉注射α-GalCer能促进小鼠肝脏iNKT细胞的增殖,诱导iNKT 细胞各亚群的变化,本实验为肝脏疾病的基于iNKT细胞的免疫治疗提供了基础研究依据。
