黑加仑平脂胶囊制备工艺及质量标准研究
2023-10-17高惠静冯文玲吴洁茹许少全
高惠静,袁 圆,冯文玲,吴洁茹,许少全,赵 军Δ
(1. 新疆医科大学第一附属医院,新疆乌鲁木齐 830054; 2. 新疆医科大学药学院,新疆乌鲁木齐 830011)
高脂血症是多种原因导致的脂质代谢紊乱性疾病,可引发冠状动脉粥样硬化性心脏病、糖尿病、胰腺炎、肾衰竭等,是心血管疾病的高危因素[1-2]。《中国居民营养与慢性病状况报告(2015 年)》指出,我国成人高脂血症患病率为40.4%[3]。随着人民生活水平的提高及受不良生活习惯的影响,高脂血症发病率逐年上升,且呈年轻化趋势[4]。目前,临床常用的调脂西药有他汀类、贝特类等[5],虽能有效调控血脂,但可导致肌病、横纹肌溶解、2 型糖尿病、抑郁症、睡眠障碍等药品不良反应[6-7]。中药调血脂的药源丰富,疗效确切,配方灵活,毒副作用小,长期应用耐受性好,应用前景广阔。中医将高脂血症纳入“血瘀”“痰湿”“脂膏”等范畴,治疗以健脾益气、化痰降浊为主[8]。黑加仑平脂方是维吾尔族常用民间验方,由黑加仑籽、山楂和甘草组方。方中,黑加仑籽为君药,具有祛痰化瘀、养心健脾功效[9];山楂为臣药,具有化瘀血、开胃气功效[10];甘草为佐药,具有益心气、和脾胃功效[11]。该方经新疆医科大学中医学院周铭新教授论证,具有化瘀祛痰、健脾养心的作用,主治高脂血症[9]。本研究中通过单因素试验、L9(34)正交试验优选黑加仑平脂胶囊的制备工艺,并建立其质量控制标准,为产品的后续开发和转化应用提供参考。现报道如下。
1 仪器与试药
1.1 仪器
Clarus500 型气相色谱仪(美国PE 公司);2695 型高效液相色谱仪(美国Waters 公司);BP211 D 型电子天平(德国Sartorius公司,精度为十万分之一);F80型高速万能粉碎机(北京永光明医疗仪器厂);FDV 型超微细粉粉碎机(台湾佑崎有限公司);8002 型电子恒温水浴锅(北京永光明医疗仪器厂);R201型旋转蒸发器(上海申胜生物技术有限公司);CX31 型光学显微镜(日本Olympus 公司);WFH-203B 型暗箱式三用紫外分析仪(上海精科实业有限公司);CQ50A 型微型超声波清洗器(上海超声波仪器厂,功率为200 W,频率为40 kHz)。
1.2 试药
黑加仑籽(新疆维帝食品有限责任公司,批号为100923);山楂(批号为110903),甘草(批号为110120),均购自安徽省亳州市凯利中药饮片有限公司;γ-亚麻酸甲酯对照品(批号为110898 - 201605,含量大于98%),金丝桃苷对照品(批号为111521-200303,含量大于98%),甘草酸单铵盐对照品(批号为110731 -200409,含量大于98%),熊果酸对照品(批号为110742-201622,含量大于98%),甘草次酸对照品(批号为110723-200612,含量大于98%),山楂对照药材(批号为121138 - 200302),甘草对照药材(批号为120904 -200410),均购自中国食品药品检定研究院;十七烷酸甲酯对照品(安普实验室技术上海有限公司,批号为T2370005,含量不低于98%);甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 黑加仑平脂胶囊制备工艺优选
2.1.1 黑加仑籽粉碎方法考察[12]
称取黑加仑籽1 000 g,共6 份,其中3 份采用低温超微粉碎,3 份采用普通机械粉碎,收集通过80 目筛的细粉,计算出粉率(%),采用气相色谱(GC)法测定γ-亚麻酸的含量。结果见表1。可见,低温超微粉碎法的出粉率显著高于普通机械粉碎法(P<0.05),但2 种方法粉碎后的细粉中γ-亚麻酸含量无显著差异(P>0.05),这可能与粉碎时间短有关,低温可有效保护药材中γ-亚麻酸和超氧化物歧化酶等不稳定活性物质。故选择低温超微粉碎法。
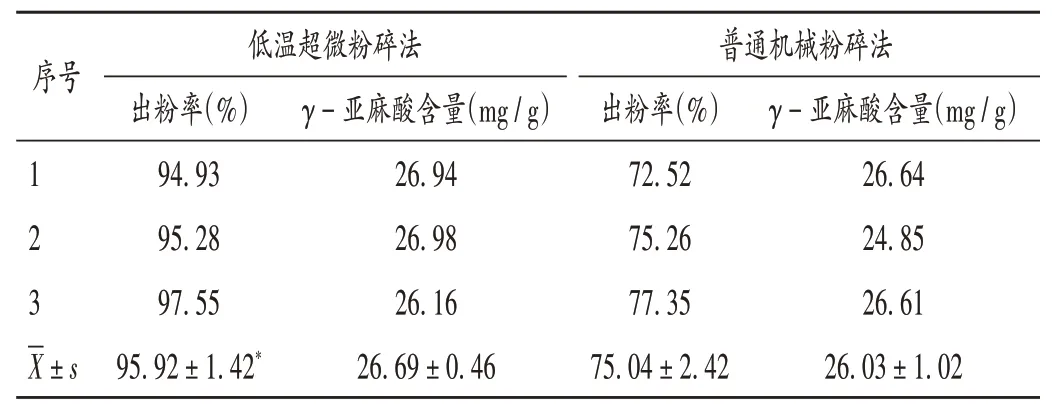
表1 黑加仑籽出粉率和γ-亚麻酸含量测定结果(n=3)Tab.1 Results of flour extraction rate and γ-linolenic acid content of Ribes nigrum seeds(n=3)
2.1.2 山楂提取工艺优选
参照本课题组的前期研究方法[13]。采用L9(34)正交试验,对乙醇体积分数(因素A)、乙醇用量(因素B)和提取时间(因素C)进行考察,因素与水平见表2;以主要调脂成分金丝桃苷含量和醇浸出物含量(权重系数分别为0.7 和0.3)为指标综合评价,筛选最佳醇提条件。正交试验设计与结果见表3,方差分析结果见表4。可见,最佳醇提工艺为A2B2C2,因素A 对结果影响显著(P<0.05),而因素B 和因素C 对结果影响不显著(P>0.05)。为节约成本、节省工时,确定最佳提取工艺为A2B1C1,即加10 倍量70%乙醇,回流提取2 次,每次1.0 h。

表2 山楂提取L9(34)正交试验因素与水平Tab.2 Factors and levels of the L9(34)orthogonal test of Crataegus Fructus
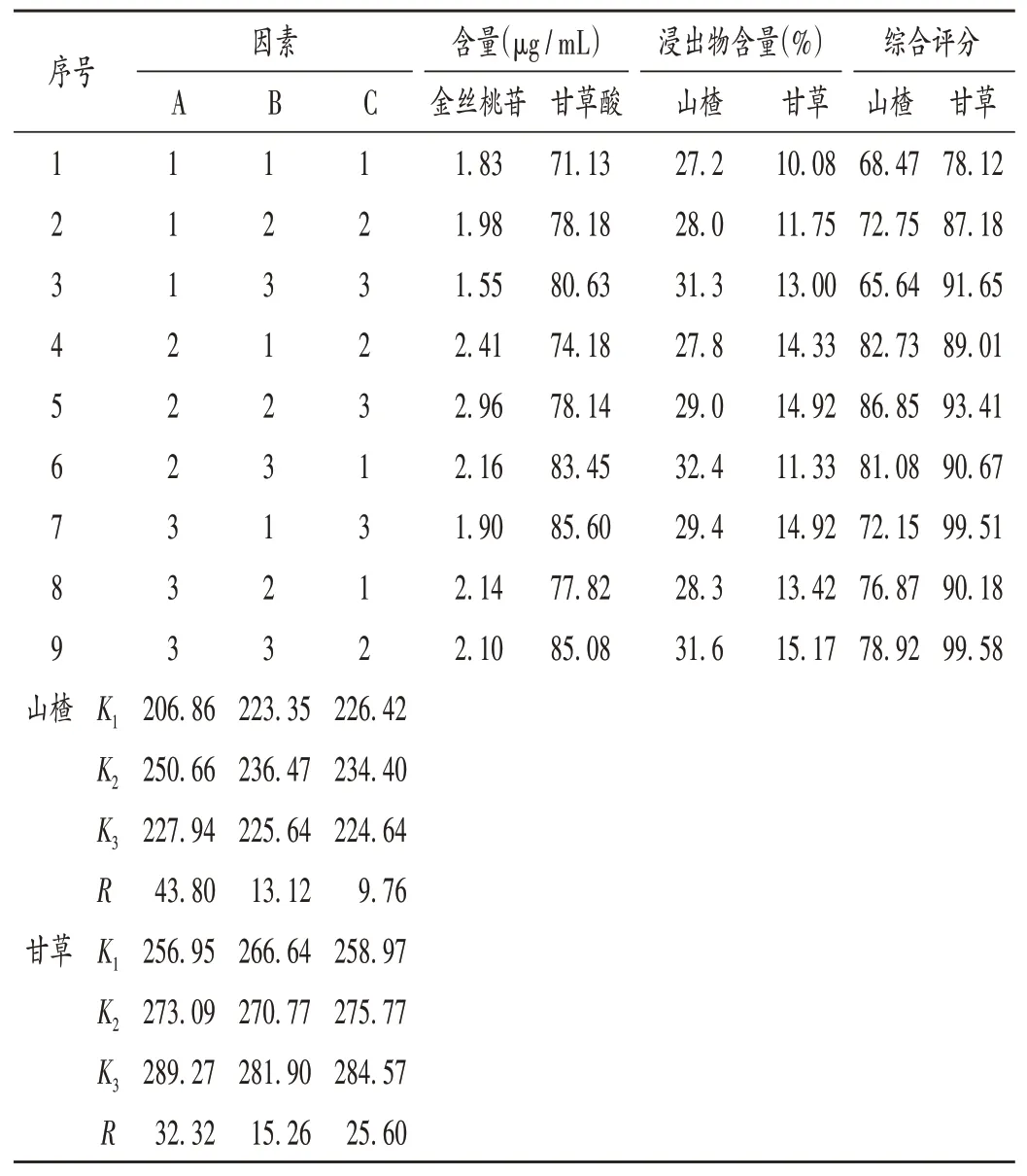
表3 L9(34)正交试验设计与结果Tab.3 Design and results of the L9(34)orthogonal test
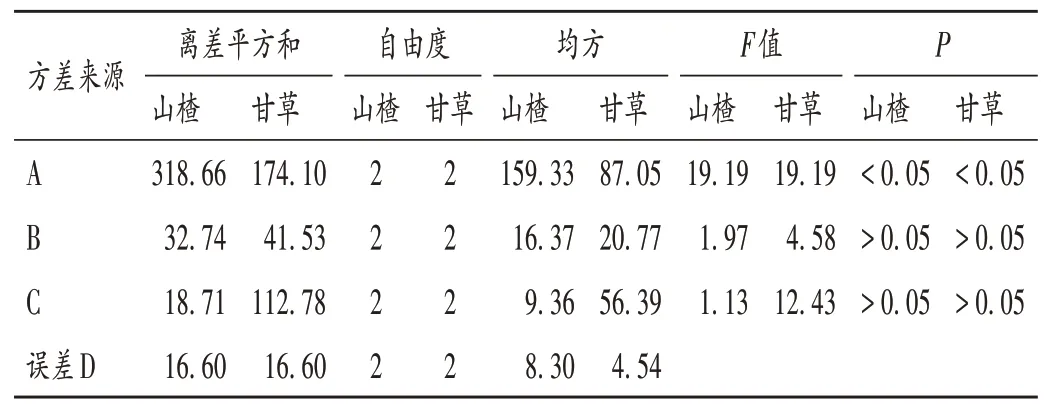
表4 方差分析结果Tab.4 Results of the analysis of variance
2.1.3 甘草水提工艺优选
采用L9(34)正交试验对提取次数(因素A)、加水量(因素B)和提取时间(因素C)进行考察,因素与水平见表5;以甘草酸含量和水浸出物含量(权重系数分别为0.7 和0.3)为指标综合评价,筛选最佳水提条件。正交试验设计与结果见表3,方差分析结果见表4。可见,最佳水提工艺为A3B3C3,因素A对结果影响显著(P<0.05),而因素B 和因素C 对结果影响不显著(P>0.05)。为节约成本、节省工时,确定最佳提取工艺为A3B1C2,即加10倍量水,回流提取4次,每次1.5 h。

表5 甘草提取L9(34)正交试验因素与水平Tab.5 Factors and levels of the L9(34)orthogonal test of Glycyrrhizae Radix
2.1.4 水提液除杂工艺优选
采用单因素试验对除杂方法(离心法、ZTC 1+1-Ⅱ型天然澄清剂法和壳聚糖澄清剂法)进行考察,以甘草酸和水浸出物含量与保留率(权重系数分别为0.5和0.5)为指标综合评价[9],结果见表6。可见,ZTC 1+1-Ⅱ型天然澄清剂法综合评分最高,且ZTC 1+ 1- Ⅱ型天然澄清剂具有无残留、兼具矫味、易工业化等优点[14],故选择ZTC1+1-Ⅱ型天然澄清剂法进行除杂。
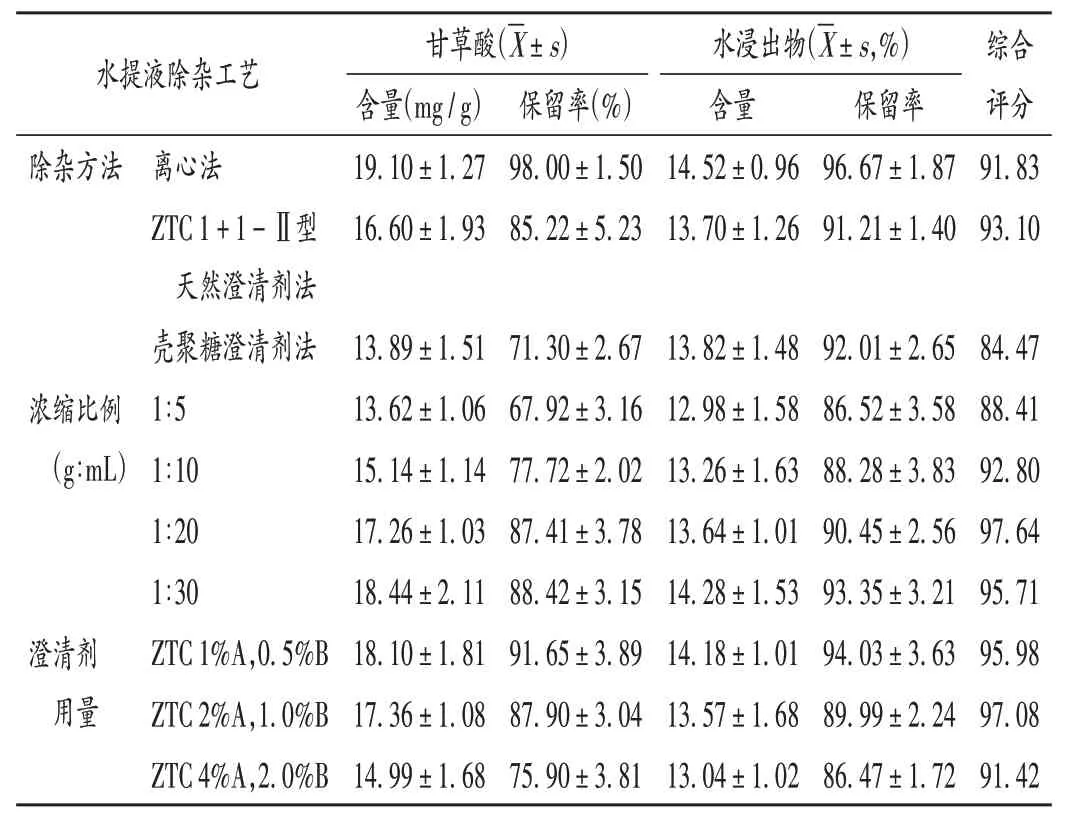
表6 水提液除杂工艺考察结果(n=3)Tab.6 Investigation results of impurity removal process with water extraction liquid(n=3)
筛选出除杂方法后,再对浓缩比例、澄清剂的用量进行考察,由表6 可知,药材与药液浓缩比例为1∶20(m/V)时甘草酸保留率较高,水浸出物保留率较低,综合评分最高,故选择水提液最佳浓缩比例为1∶20(m/V);澄清剂用量为ZTC 2%A 和1.0%B 时甘草酸保留率较高,水浸出物保留率较低,综合评分最高,故选择澄清剂用量为ZTC 2%A和1.0%B。
筛选出的黑加仑平脂胶囊最佳制备工艺为,山楂用10 倍量70%乙醇回流提取2 次,每次1.0 h,滤过,减压浓缩成相对密度为1.10~1.16(60~70 ℃)的清膏;甘草用10 倍量水回流提取4 次,每次1.5 h,滤过,滤液减压浓缩至1∶20(m/V),加入ZTC 1+1-Ⅱ型天然澄清剂除杂,滤过,滤液与山楂清膏合并后浓缩成相对密度为1.14~1.20(60~70 ℃)的浸膏;黑加仑籽低温超微粉碎,过80 目筛后与上述浸膏混合,加入辅料,使用干燥喷雾制粒机一步制粒,整粒,灌装,即得。按此工艺制备3批(批号分别为19060203,19060303,19060403)黑加仑平脂胶囊,备用。
2.2 黑加仑平脂胶囊质量标准研究
2.2.1 黑加仑籽的显微鉴别
分别取黑加仑平脂胶囊内容物和黑加仑籽粉末,研成细粉,取少许置载玻片上,滴加水合氯醛试液,盖上盖玻片,置显微镜下观察[15]。结果二者内种皮厚壁细胞均为椭圆形或多角形,呈棕红色;胚乳细胞均为椭圆形或多角形,内含众多颗粒状物,呈灰白色;石细胞均为类方形或类长方形,胞腔大。详见图1。
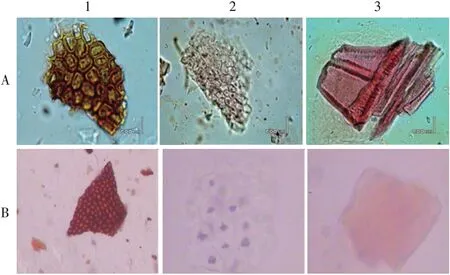
图1 黑加仑籽的显微鉴别图1.Parenchyma cells 2.Endosperm cells 3.Stone cells A.Ribes nigrum seed powder B.Heijialun Pingzhi CapsulesFig.1 Microscopic identification pictures of Ribes nigrum seeds
2.2.2 薄层色谱鉴别
山楂[16]:取胶囊内容物1.0 g,精密称定,加乙酸乙酯4 mL,超声15 min,滤过,滤液浓缩至0.5 mL,作为供试品溶液;另取熊果酸对照品,加甲醇制成质量浓度为1.0 mg/mL的对照品溶液;另取山楂对照药材1.0 g,按供试品溶液制备方法制备对照药材溶液;按处方工艺制备缺山楂的阴性样品,按供试品溶液制备方法制备阴性对照品溶液。分别吸取上述4种溶液点于同一薄层板上,以甲苯-乙酸乙酯-甲酸(20∶4∶0.5,V/V/V)为展开剂,展开。结果供试品溶液色谱图中,在与对照药材溶液和对照品溶液色谱相应位置显相同的紫红色斑点,且阴性对照无干扰。详见图2 A。
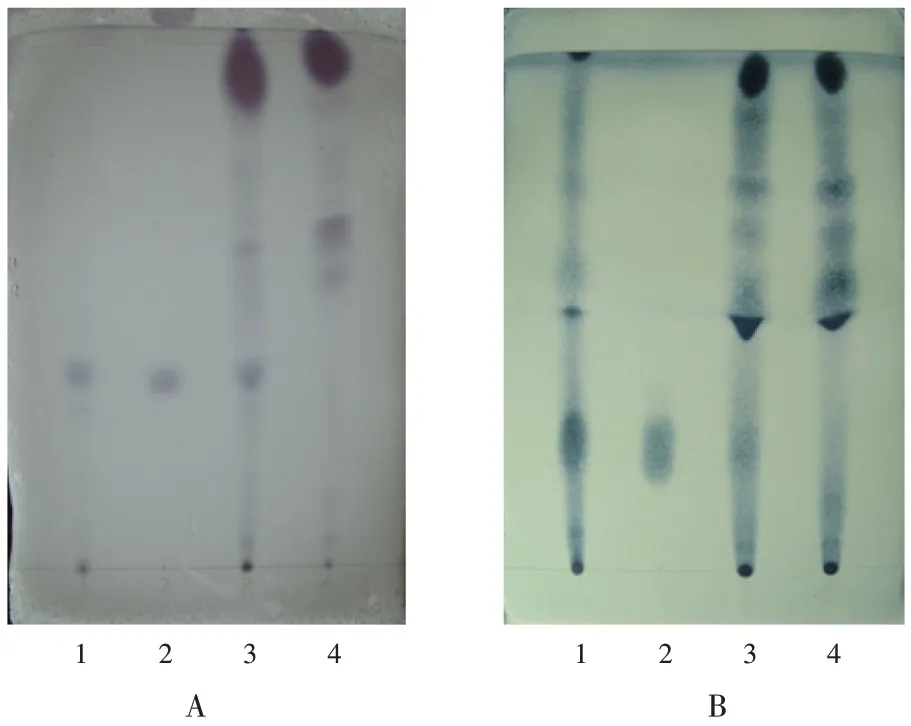
图2 薄层色谱图1.Reference solution 2.Reference medicinal solution 3.Test solution 4.Negative reference solution A.Crataegus Fructus B.Glycyrrhizae Radix(365 nm)Fig.2 TLC chromatograms
甘草[17]:取胶囊内容物1.0 g,精密称定,加盐酸2 mL、氯仿20 mL,超声15 min,滤过,滤液蒸干,残渣加无水乙醇0.5 mL使溶解,作为供试品溶液;另取甘草次酸对照品,加无水乙醇制成质量浓度为1.0 mg/mL 的对照品溶液;另取甘草对照药材1.0 g,按供试品溶液制备方法制备对照药材溶液;按处方工艺制备缺甘草的阴性样品,按供试品溶液制备方法制备阴性对照品溶液。分别吸取上述4 种溶液点于同一薄层板上,以石油醚-苯- 乙酸乙酯- 冰醋酸(10∶20∶7∶0.5,V/V/V/V)为展开剂,展开,取出,晾干,喷以10%磷钼酸乙醇溶液显色,置紫外光灯(365 nm)下检视。结果供试品溶液色谱图中,在与对照药材溶液和对照品溶液色谱相应位置显相同的黑色斑点,且阴性对照无干扰。详见图2 B。
2.2.3 GC 法测定γ-亚麻酸含量
1)色谱条件
色谱柱:SupelcoTM弹性石英毛细管柱(30 m×0.25 mm,0.25 µm);检测器:氢火焰离子化(FID)检测器;载气:氮气;柱温:205 ℃;进样口温度:250 ℃;检测器温度:275 ℃;分流比:30∶1;进样量:1µL。
2)溶液制备
对照品溶液:取γ- 亚麻酸甲酯对照品16.20 mg,精密称定,置10 mL 容量瓶中,加甲醇制成质量浓度为1 620µg/mL的溶液,即得。
内标溶液:取十七烷酸甲酯对照品19.97 mg,精密称定,置10 mL容量瓶中,加甲醇制成质量浓度为1 997µg/mL的溶液,即得。
供试品溶液:取胶囊内容物,研细,过80目筛,精密称定,置索氏提取器中,加乙醚加热回流4 h,挥干乙醚,从残留液中精密称取100 mg,置10 mL 具塞试管中,加0.5 mol/L氢氧化钾甲醇溶液2 mL,60 ℃水浴皂化15 min,待油珠溶解,放冷,加14%三氟化硼甲醇溶液2 mL,60 ℃水浴甲酯化2 min,放冷,精密加入正己烷2 mL,振摇,加饱和氯化钠溶液2 mL,静置分层,从上层液中精密量取0.2 mL,置5 mL容量瓶中,精密加入内标溶液1 mL,加正己烷定容,即得[18]。
阴性对照品溶液:按处方工艺制备不含黑加仑籽的阴性样品,按供试品溶液制备方法制备阴性对照品溶液。
3)方法学考察
专属性试验:分别取上述阴性对照品溶液、对照品溶液和供试品溶液,按上述色谱条件进样测定,记录色谱图。结果供试品溶液和对照品溶液中,γ- 亚麻酸甲酯保留时间一致,样品中其他组分对γ-亚麻酸甲酯无干扰,且阴性对照无干扰,表明方法专属性良好。详见图3。

图3 气相色谱图1.Methyl heptadecanoate(internal standard) 2.γ-linolenic acid methyl ester A.Reference solution B.Test solution C.Negative reference solutionFig.3 GC chromatograms
线性关系考察:分别精密吸取上述对照品溶液0.1,0.5,1.0,1.5,2.0,2.5 mL,分别置5 mL容量瓶中,加内标溶液1 mL,加正己烷定容,按上述色谱条件进样测定。以对照品溶液质量浓度(X,µg/mL)为横坐标、对照品溶液与内标溶液峰面积比值(Y)为纵坐标进行线性回归,得回归方程Y=0.002 4X-0.024 2(r=0.999 9,n= 6)。结果表明,γ- 亚麻酸甲酯质量浓度在32.4~648.0µg/mL 范围内与对照品溶液和内标溶液峰面积比值线性关系良好。
精密度试验:精密吸取上述对照品溶液,按上述色谱条件连续进样测定6 次,记录峰面积。结果的RSD为0.27%(n=6),表明仪器精密度良好。
稳定性试验:取同一批(批号为19060303)黑加仑平脂胶囊内容物适量,精密称定,按上述方法制备供试品溶液,分别于室温下放置0,2,4,8,12,24 h 时按上述色谱条件进样测定,连续测定5 d,计算日内和日间精密度。结果的RSD分别为0.18%(n= 6)和0.29%(n= 30),表明供试品溶液室温下放置24 h 稳定性良好。
重复性试验:取同一批(批号为19060303)黑加仑平脂胶囊内容物6 份,按上述方法制备供试品溶液,按上述色谱条件进样测定,记录峰面积。结果的RSD为1.34%(n=6),表明方法重复性良好。
加样回收试验:取同一批(批号为19060303)黑加仑平脂胶囊内容物(γ-亚麻酸甲酯含量为15.17 mg/g)9份,每份15 g,按上述供试品溶液制备方法制备至“静置分层”,量取上层液0.1 mL,置容量瓶中,分为3组,各3 份,分别精密加入0.40,0.50,0.60 mLγ- 亚麻酸甲酯对照品溶液,加入内标溶液,按上述色谱条件进样测定,计算回收率。结果见表7。
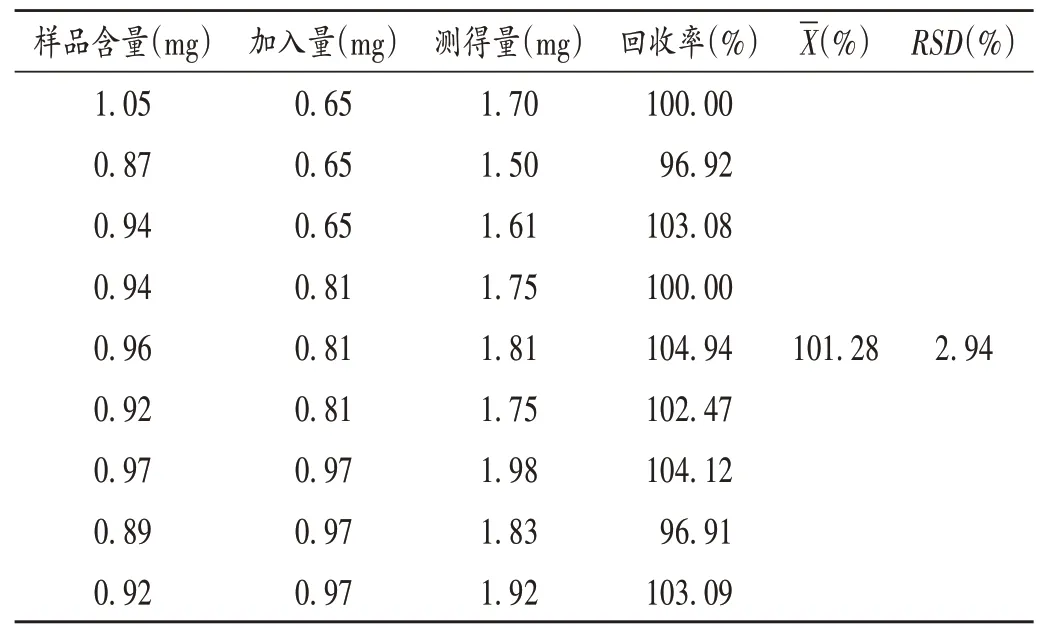
表7 γ-亚麻酸甲酯加样回收试验结果(n=9)Tab.7 Results of the recovery test of γ-linolenic acid methyl ester(n=9)
4)样品中γ-亚麻酸的含量测定
取3批(批号分别为19060203,19060303,19060403)黑加仑平酯胶囊内容物,各平行3 份,按上述方法制备供试品溶液,按上述色谱条件进样测定。结果3 批样品中γ-亚麻酸含量分别为(16.35±0.75)mg/g、(15.13±1.21)mg/g、(16.06±1.03)mg/g,平均为15.84 mg/g,计算得γ- 亚麻酸的含量为15.08 mg/ g。计算公式为γ-亚麻酸含量=γ-亚麻酸甲酯含量×0.952。
3 讨论
3.1 黑加仑平脂胶囊功效
黑加仑为新疆北部地区塔城、伊犁、阿勒泰等地广泛种植的一种浆果植物。黑加仑籽是黑加仑浆果榨汁后的主要副产品,常被丢弃或用作饲料。研究表明,黑加仑籽具有抗氧化、调脂、预防动脉粥样硬化、抗炎、抗肿瘤、抗糖尿病等药理学作用[19]。黑加仑平脂胶囊是从中医理论出发,以黑加仑籽为君药,经典调脂中药山楂为臣药,调脂中药甘草为佐药,组成的调脂复方中药制剂。
3.2 黑加仑籽粉碎方法优化
本研究中选择粉碎后直接入药,原因有以下三点。1)黑加仑籽中含有具有抗动脉粥样硬化作用的超氧化物歧化酶[20],高温提取会破坏这种有效成分。2)籽油易酸败,稳定性远低于籽粉。3)籽粉在胶囊中还具有赋形剂的作用。超低温粉碎不仅可防止因局部过热所致油脂渗出、物料变黏,还可保护黑加仑籽中不稳定有效成分[9]。γ- 亚麻酸是黑加仑籽中主要调脂活性成分[21],出粉率是评价粉碎工艺损耗多少的关键指标,故选择出粉率和γ- 亚麻酸含量综合考察黑加仑籽的粉碎方法。
3.3 山楂、甘草提取工艺指标选择
金丝桃苷为山楂调脂的主要黄酮类成分[22],且为脂溶性成分,故采用醇提取。醇提浸出物量是衡量山楂质量的重要指标,故本研究中以金丝桃苷含量及醇提浸出物含量作为山楂提取工艺的综合评价指标。甘草酸为甘草中发挥调脂及阻止动脉粥样硬化形成的主要活性成分[23-24],其为水溶性成分,故采用水提取。水提浸出物量是衡量药材中有效成分是否提取完全和是否完全转移的重要指标[25]。中药有效成分较复杂,单一指标往往不能衡量工艺的优劣。故选择主要有效成分甘草酸和水提浸出物含量综合评价甘草的提取工艺。由于浸出物量与药理作用强度不呈量效关系,故设定浸出物权重系数为0.3;而有效成分含量与药物的药理学作用具有明显相关性,故设定有效成分权重系数为0.7。
3.4 方法评价
本研究中优选的黑加仑平脂胶囊制备工艺简单稳定,适于工业化生产;所建立的质量标准稳定可靠,可用于黑加仑平脂胶囊的质量控制。本研究为黑加仑平脂胶囊的后续开发和转化应用奠定了基础。
