circ_0092315通过调控微小RNA-1256/高迁移率族蛋白A2促进甲状腺乳头状癌细胞的增殖和侵袭
2023-10-15柯淑红孔彩霞徐瑶彭聪
柯淑红 孔彩霞 徐瑶 彭聪


摘要:目的 研究circ_0092315对甲状腺乳头状癌细胞增殖和侵袭的影响,并探讨其分子机制。方法 采用实时荧光定量PCR方法检测人甲状腺乳头状癌细胞中circ_0092315的表达水平,CCK-8法和Transwell实验检测TPC-1细胞的增殖和侵袭能力,Western blot检测高迁移率族蛋白A2(HMGA2)蛋白表达水平。通过生物信息数据库、双荧光素酶报告基因检测、实时荧光定量PCR、蛋白质印迹法探讨circ_0092315、微小RNA-1256(miR-1256)和HMGA2的靶向调控关系。结果 circ_0092315在人甲状腺乳头状癌细胞中呈现高表达(P均<0.001)。circ_0092315促进TPC-1细胞增殖和侵袭能力(P均<0.001)。转染circ_0092315小干擾RNA可上调miR-1256的表达水平(P<0.001)。miR-1256抑制物上调HMGA2蛋白表达(P<0.001)。结论 circ_0092315在人甲状腺乳头状癌TPC-1细胞中呈高表达,通过调控miR-1256/HMGA2轴促进TPC-1细胞的增殖和侵袭。
关键词:甲状腺乳头状癌;circ_0092315;微小RNA-1256;高迁移率族蛋白A2
中图分类号: R581.9 文献标志码: A 文章编号:1000-503X(2023)01-0016-06
DOI:10.3881/j.issn.1000-503X.15026
circ_0092315 Promotes Proliferation and Invasion of Papillary Thyroid Carcinoma Cells via Regulating microRNA-1256/High Mobility Group A2 axis
KE Shuhong1,KONG Caixia1,XU Yao2,PENG Cong1
1Department of Endocrinology,2Department of Pathology,Wuhan No.1 Hospital,Wuhan 430030,China
Corresponding author:PENG Cong Tel:027-85332130,E-mail:343747430@qq.com
ABSTRACT:Objective To investigate the role and mechanism of circ_0092315 in the proliferation and invasion of papillary thyroid carcinoma cells.Methods The expression of circ_0092315 in papillary thyroid carcinoma cells was examined by real-time fluorescence quantitative PCR.The proliferation and invasion of TPC-1 cells was assessed by CCK-8 and Transwell assays.The protein level of high mobility group A2 (HMGA2) was determined by Western blotting.The regulatory relationship of circ_0092315,microRNA-1256 (miR-1256),and HMGA2 was explored by bioinformatics tools,dual-luciferase reporter assay,real-time fluorescence quantitative PCR,and Western blotting.Results circ_0092315 was overexpressed in papillary thyroid carcinoma cells (all P<0.001).circ_0092315 promoted the proliferation and invasion of TPC-1 cells (all P<0.001).The transfection of si-circ_0092315 up-regulated the expression of miR-1256 (P<0.001),and miR-1256 inhibitor up-regulated the protein level of HMGA2 (P<0.001).Conclusion circ_0092315 is overexpressed in TPC-1 cells and it promotes the proliferation and invasion of TPC-1 cells by regulating the miR-1256/HMGA2 axis.
Key words:papillary thyroid carcinoma;circ_0092315;microRNA-1256;high mobility group A2
Acta Acad Med Sin,2023,45(1):16-21
甲状腺癌是目前最常见的内分泌肿瘤之一,发病率呈逐年上升趋势,占内分泌系统恶性肿瘤的95%[1]。甲状腺乳头状癌是甲状腺癌临床病理分型之一,也是最常见、分化程度高、恶性度小的甲状腺肿瘤[2]。尽管对其已有许多研究,但甲状腺乳头状癌的发生发展是一个涉及多因素的复杂生物学过程,目前具体发病机制不清。环状RNA(circular RNA,circRNA)是一类共价闭合环状的内源性非编码RNA,在正常生理活动以及各种疾病进程中具有重要作用[3]。研究表明circRNA在肿瘤中表达异常且与肿瘤的发生发展密切相关,但circRNA在甲状腺癌中的功能尚不清楚。最近研究发现,hsa_circ_0060060在甲状腺乳头状癌细胞中表达上调,并通过抑制微小RNA(microRNA,miR)-144-3p增加甲状腺癌细胞的顺铂耐药性[4]。本研究通过生物信息学方法研究circ_0092315对甲状腺癌乳头状癌细胞增殖和侵袭的影响,并探究其潜在的分子机制。
材料和方法
材料 人正常甲状腺细胞Nthy-ori3-1、人甲状腺乳头状癌细胞TPC-1、BCPAP、IHH4购自中国科学院上海生命科学研究院细胞库。RPMI 1640培养基、胎牛血清購自美国Hyclone公司,TRIzol试剂盒、脂质体转染试剂LipofectamineTM 2000购自美国Invitrogen公司,反转录和实时荧光定量PCR(real-time fluorescence quantitative PCR,qRT-PCR)试剂盒购自日本Takara公司,circ_0092315小干扰RNA(si-circ_0092315)及小干扰RNA对照(si-对照)、miR-1256模拟物及模拟物对照、miR-1256抑制剂及抑制剂对照、空载质粒、过表达人高迁移率族蛋白A2(high mobility group A2,HMGA2)质粒购自上海吉玛制药技术有限公司,兔抗人HMGA2抗体(货号:ab207301)和GAPDH抗体购自美国Abcam公司,RIPA裂解液和BCA蛋白检测试剂盒购自江苏碧云天生物技术有限公司,CCK-8试剂盒购自南京建成生物工程研究所,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。
细胞培养及转染 人甲状腺乳头状癌TPC-1、BCPAP、IHH4细胞在含10%胎牛血清、1%青霉素-链霉素的RPMI 1640培养基中,37 ℃、5% CO2恒温培养箱中培养。取对数生长期的TPC-1细胞以1×105个/孔的密度接种于六孔板中,按照Lipofectamine TM 2000转染试剂盒说明书进行转染。根据处理情况将细胞分为si-circ_0092315组和si-对照组、miR-1256模拟物组和模拟物对照组、miR-1256抑制剂组及抑制剂对照组、si-circ_0092315+miR-1256抑制物组和si-circ_0092315+抑制物对照组、si-circ_0092315+过表达HMGA2组和si-circ_0092315+空载体组。
qRT-PCR检测 采用Trizol试剂按说明书提取细胞总RNA,通过反转录试剂盒将总RNA反转录为cDNA。在ABI 7500定量PCR仪上完成qRT-PCR扩增,采用2-ΔΔCT法分别计算目标基因的相对表达量。引物序列:circ_0092315上游引物:5′-TGCCAGCATGTAGACCTCAG-3′,下游引物:5′-TTGTGAAAATGCCAAGGACA-3′;miR-1256上游引物:5′-GGCGCGATTTTAGTTTATC-3′,下游引物:5′-TTTAATTACCAACCGAATACG-3′;GAPDH上游引物:5′-GGATTTGGTCGTATTGGGCG-3′,下游引物:5′-CGGTGCCATGGAATTTGCC-3;U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGC TTCACGAATTTGCGT-3′。circ_0092315基因检测以GAPDH作为内参,miR-1256基因检测以U6作为内参。
细胞增殖实验 将转染si-circ_0092315的TPC-1细胞以2×103个/孔的密度接种于96孔板中,分别培养24、48、72 h,每孔加入10 μl CCK-8试剂在37 ℃、5% CO2培养箱中孵育2 h,用酶标仪测定各孔细胞在450 nm处的光密度(optical density,OD)值。
细胞侵袭实验 将10 μl Matrigel基质胶均匀涂在Transwell小室内面,待基质胶凝固。向24孔板中加入600 μl含有10%血清的DMEM高糖培养基,其内放置Transwell(8 μm)小室。向小室内加入转染si-circ_0092315或阴性对照的TPC-1细胞(2.5×104个/孔),置于37 ℃、5% CO2恒温培养箱中培养。24 h后取出小室,用棉签将上室内面的细胞去掉,4%多聚甲醛固定30 min,0.5%结晶紫染色液染色15 min,PBS清洗3次,用棉签擦净膜内面未迁移的细胞和染料,在显微镜下拍照,每个孔随机选5个视野拍照,并分别计数后求出平均值进行比较。
Western blot检测 按照每1.0×106个TPC-1细胞加入100 μl RIPA蛋白裂解液,混匀后置冰上30 min,4 ℃ 12 000 ×g离心30 min,取上清液,采用BCA法测定蛋白含量。将转有蛋白的PVDF膜置于5%脱脂奶粉室温中振荡封闭1 h,TBST缓冲液清洗后,加入兔抗人HMGA2抗体(1∶1000)4 ℃孵育过夜,清洗后加入辣根过氧化物酶标记的二抗室温孵育2 h,电化学发光法显色,凝胶成像系统扫描分析。
双荧光素酶报告基因检测 利用Circular RNA Interactome数据库(https://circinteractome.nia.nih.gov/)预测circ_0092315靶基因。将circ_0092315的互补结合位点突变,构建突变型(circ_0092315突变型)和野生型(circ_0092315野生型)荧光素酶报告载体(广州锐博生物技术有限公司),并与miR-1256模拟物或模拟物阴性对照转染至TPC-1细胞中。转染24 h后,利用双荧光素酶活性检测试剂盒(Promega公司,美国)检测荧光素酶活性。
统计学处理 采用SPSS 21.0统计软件,计量资料以均数±标准差表示,两组间比较采用t检验;多组间比较采用单因素方差分析,并采用LSD检验进行两两比较;多组间不同时间点比较采用重复测量方差分析。P<0.05为差异有统计学意义。
结 果
人甲状腺乳头状癌细胞circ_0092315的表达水平 qRT-PCR检测结果显示,与人正常甲状腺细胞Nthy-ori3-1比较,人甲状腺乳头状癌TPC-1(3.152±0.053比0.989±0.007;t=104.977,P<0.001)、BCPAP(2.257±0.041比0.989±0.007;t=71.930,P<0.001)、IHH4细胞(1.859±0.059比0.989±0.007;t=37.323,P<0.001)中的circ_0092315表达水平显著升高,且在TPC-1细胞中表达最高(F=483.233,P<0.001)。
circ_0092315对TPC-1细胞增殖和侵袭能力的影响 与si-对照组比较,转染si-circ_0092315的TPC-1细胞中circ_0092315表达水平显著降低(0.486±0.046比0.990±0.009;t=30.982,P<0.001)。CCK-8法检测结果显示,si-circ_0092315组的TPC-1细胞在24、48、72 h的细胞增殖能力显著低于si-对照组(F=1896.298,P<0.001),且两组OD值变化趋势差异有统计学意义(F=1320.688,P<0.001)(图1A)。Transwell实验检测结果显示,si-circ_0092315组TPC-1细胞的侵袭能力显著低于si-对照组(37.000±5.121比94.100±4.012;t=27.756,P<0.001)(图1B)。
circ_0092315与miR-1256的关系 利用Circular RNA Interactome数据库分析发现,miR-1256和circ_0092315之间存在结合位点。双荧光素酶报告基因检测结果显示,miR-1256模拟物和circ_0092315野生型共转染后,与模拟物对照组比较,miR-1256模拟物组荧光素酶活性显著降低(0.528±0.048比0.978±0.009;t=27.889,P<0.001)。与si-对照组比较,转染si-circ_0092315的TPC-1细胞miR-1256表达水平显著增加(2.126±0.063比0.986±0.011;t=51.347,P<0.001)。
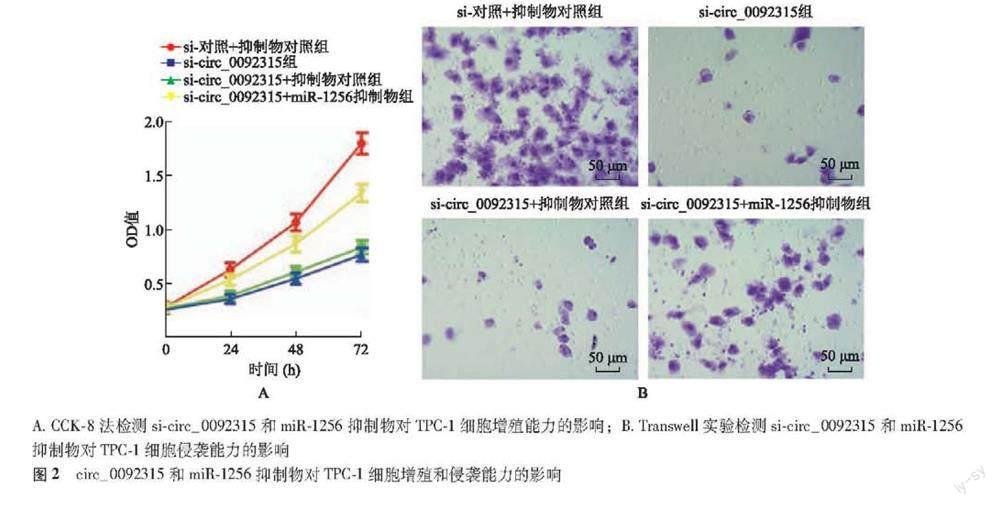
si-circ_0092315和miR-1256抑制物对TPC-1细胞增殖和侵袭能力的影响 CCK-8法检测结果显示,si-circ_0092315+miR-1256抑制物组TPC-1细胞在24、48、72 h的细胞增殖能力显著高于si-circ_0092315+抑制物对照组(F=1690.251,P<0.001),si-对照+抑制物对照组、si-circ_0092315组、si-circ_0092315+抑制物对照组和si-circ_0092315+miR-1256抑制物组OD值变化趋势差异有统计学意义(F=598.694,P<0.001)(图2A)。Transwell实验检测结果显示,与si-对照+抑制物对照组比较,si-circ_0092315组TPC-1细胞迁移能力显著降低(21.100±7.838比98.400±1.265,t=30.789,P<0.001);與si-circ_0092315组比较,si-circ_0092315+抑制物对照组TPC-1细胞迁移能力差异无统计学意义(21.000±2.449比21.100±7.838,t=0.039,P=0.970);与si-circ_0092315+抑制物对照组比较,si-circ_0092315+miR-1256抑制物组TPC-1细胞迁移能力显著升高(55.400±3.098比21.000±2.449,t=27.542,P<0.001)(图2B)。
circ_0092315和miR-1256对HMGA2表达的影响 利用Targetscan数据库预测发现miR-1256与HMGA2之间存在结合位点(图3A)。Western blot检测结果显示,与模拟物对照组比较,miR-1256 模拟物组TPC-1细胞HMGA2蛋白表达水平显著降低(0.267±0.036比0.990±0.007;t=51.946,P<0.001);与抑制物对照组比较,miR-1256抑制物组TPC-1细胞HMGA2蛋白表达水平显著升高(1.587±0.033比0.992±0.007;t=35.866,P<0.001)(图3B)。与si-对照组比较,si-circ_0092315组TPC-1细胞HMGA2表达下降(0.237±0.036比0.990±0.008,t=64.648,P<0.001);与si-circ_0092315组比较,si-circ_0092315+抑制物对照组TPC-1细胞HMGA2表达差异无统计学意义(0.224±0.023比0.237±0.036,t=0.967,P=0.346);与si-circ_0092315+抑制物对照组比较,si-circ_0092315+miR-1256抑制物组TPC-1细胞HMGA2表达显著增加(0.528±0.048比0.224±0.023,t=17.955,P<0.001) (图3C)。
过表达HMGA2和si-circ_0092315对TPC-1细胞增殖和侵袭能力的影响 CCK-8法检测结果显示,si-circ_0092315+过表达HMGA2组TPC-1细胞在24、48、72 h的细胞增殖能力显著高于si-circ_0092315+空载体组(F=3980.506,P<0.001),si-对照+空载体组、si-circ_0092315组、si-circ_0092315+空载体组、si-circ_0092315+过表达HMGA2组OD值变化趋势差异有统计学意义(F=1016.712,P<0.001)(图4A)。Transwell实验检测结果显示,与si-对照+空载体组比较,si-circ_0092315组TPC-1细胞侵袭能力显著下降(35.100±2.079比104.800±1.932,t=77.658,P<0.001);与si-circ_0092315组比较,si-circ_0092315+空载体组TPC-1细胞侵袭能力差异无统计学意义(35.600±2.271比35.100±2.079,t=0.514,P=0.614);与si-circ_0092315+空载体组比较,si-circ_0092315+过表达HMGA2组TPC-1细胞侵袭能力显著升高(82.200±4.614比35.600±2.271,t=28.656,P<0.001)(图4B)。
討 论
近年来越来越多的研究表明circRNA的异常表达与肿瘤的发生发展密切相关。本研究结果发现circ_0092315在甲状腺乳头状癌细胞中呈高表达,且通过调控miR-1256/HMGA2通路促进TPC-1细胞的增殖和侵袭。
circRNA通过分子海绵作用结合miRNA从而调控蛋白表达发挥生物学作用。有文献报道circ_0087862可以竞争性结合miR-1253,通过调控Ras癌基因家族蛋白Rab3D的表达促进非小细胞肺癌的进展[6];circ_0001955吸附miR-516a-5p上调肿瘤坏死因子受体相关因子6/丝裂原激活蛋白激酶11的表达促进肝癌细胞的增殖和迁移[7]。本研究通过生物信息方法预测circ_0092315靶基因,发现circ_0092315与miR-1256存在互补结合位点,干扰circ_0092315可上调miR-1256表达,抑制TPC-1细胞的增殖和侵袭能力。miR-1256已被证实在多种肿瘤中起到肿瘤抑制作用,其表达下调会促进肿瘤的生长和转移。Chang等[8]研究发现circ_0026134通过分子海绵机制下调miR-1256和miR-1287表达促进非小细胞肺癌细胞的增殖和侵袭;Cai等[9]研究显示circHECTD1通过靶向下调miR-1256表达激活β-连环蛋白/c-Myc信号通路促进胃癌的进展。因此,circRNAs可能通过负调控miR-1256的表达发挥促癌作用。
本研究通过Targetscan数据库分析发现HMGA2是miR-1256的靶基因,且miR-1256抑制HMGA2表达。HMGA2在多种恶性肿瘤中存在过表达现象,并通过多种机制促进肿瘤的发生[10]。Dong等[11]研究显示HMGA2参与驱动的FOXL2反式激活可直接调节对化疗耐药胃癌的转移和上皮间质转换。Ma等[12]研究表明miR-302a-5p/367-3p介导HMGA2表达可调控子宫内膜癌细胞的恶性表型。此外,近年来研究发现circRNA可通过调控HMGA2促进肿瘤进展,circ_100565通过miR-506-3p/HMGA2促进非小细胞肺癌细胞增殖、迁移和侵袭[13];circFAM73A调控miR-490-3p/HMGA2增强胃癌细胞干性[14]。本研究结果显示,过表达HMGA2可以逆转si-circ_0092315对TPC-1细胞增殖和侵袭能力的抑制作用,提示HMGA2参与circ_0092315对TPC-1细胞的促增殖和侵袭作用。
综上,本研究结果发现,circ_0092315在人甲状腺乳头状癌TPC-1细胞中呈高表达,通过内源竞争RNA机制调控miR-1256/HMGA2通路,促进TPC-1细胞的增殖和侵袭能力。但本研究缺乏体内实验的验证;此外,miR-1256/HMGA2下游的分子机制还有待进一步研究。
参 考 文 献
[1]韩婧,康骅.甲状腺癌的发病现状及影响因素[J].实用预防医学,2018,25(7):894-896.DOI:10.3969/j.issn.1006-3110.2018.07.037.
[2]中华人民共和国国家卫生健康委员会.甲状腺癌诊疗规范(2018年版)[J].中华普通外科学文献(电子版),2019,13(1):1-15.DOI:10.3877/cma.j.issn.1674-0793.2019.01.001.
[3]Chen L,Huang C,Shan G.Circular RNAs in physiology and non-immunological diseases [J].Trends Biochem Sci,2022,47(3):250-264.DOI:10.1016/j.tibs.2021.11.004.
[4]Liu F,Zhang J,Qin L,et al.Circular RNA EIF6 (Hsa_circ_0060060) sponges miR-144-3p to promote the cisplatin-resistance of human thyroid carcinoma cells by autophagy regulation [J].Aging (Albany NY),2018,10(12):3806-3820.DOI:10.18632/aging.101674.
[5]Peng N,Shi L,Zhang Q,et al.Microarray profiling of circular RNAs in human papillary thyroid carcinoma [J].PLoS One,2017,12(3):e0170287.DOI:10.1371/journal.pone.0170287.
[6]Li L,Wan K,Xiong L,et al.CircRNA hsa_circ_0087862 acts as an oncogene in non-small cell Lung cancer by targeting miR-1253/RAB3D axis [J].Onco Targets Ther,2020,13:2873-2886.DOI:10.2147/OTT.S243533.
[7]Yao Z,Xu R,Yuan L,et al.Circ_0001955 facilitates hepatocellular carcinoma (HCC) tumorigenesis by sponging miR-516a-5p to release TRAF6 and MAPK11 [J].Cell Death Dis,2019,10(12):945.DOI:10.1038/s41419-019-2176-y.
[8]Chang H,Qu J,Wang J,et al.Circular RNA circ_0026134 regulates non-small cell lung cancer cell proliferation and invasion via sponging miR-1256 and miR-1287 [J].Biomed Pharmacother,2019,112:108743.DOI:10.1016/j.biopha.2019.108743.
[9]Cai J,Chen Z,Wang J,et al.circHECTD1 facilitates glutaminolysis to promote gastric cancer progression by targeting miR-1256 and activating β-catenin/c-Myc signaling [J].Cell Death Dis,2019,10(8):576.DOI:10.1038/s41419-019-1814-8.
[10]Mansoori B,Mohammadi A,Ditzel HJ,et al.HMGA2 as a critical regulator in cancer development [J].Genes (Basel),2021,12(2):269.DOI:10.3390/genes12020269.
[11]Dong J,Wang R,Ren G,et al.HMGA2-FOXL2 axis regulates metastases and epithelial-to-mesenchymal transition of chemoresistant gastric cancer [J].Clin Cancer Res,2017,23(13):3461-3473.DOI:10.1158/1078-0432.CCR-16-2180.
[12]Ma J,Li D,Kong FF,et al.miR-302a-5p/367-3p-HMGA2 axis regulates malignant processes during endometrial cancer development [J].J Exp Clin Cancer Res,2018,37(1):19.DOI:10.1186/s13046-01 8-0686-6.
[13]Li L,Wei H,Zhang H,et al.Circ_100565 promotes proliferation,migration and invasion in non-small cell lung cancer through upregulating HMGA2 via sponging miR-506-3p [J].Cancer Cell Int,2020,20:1 60.DOI:10.1186/s12935-020-01241-8.
[14]Xia Y,Lv J,Jiang T,et al.CircFAM73A promotes the cancer stem cell-like properties of gastric cancer through the miR-490-3p/HMGA2 positive feedback loop and HNRNPK-mediated β-catenin stabilization [J].J Exp Clin Cancer Res,2021,40(1):103.DOI:10.1186/s13046-021-01896-9.
(收稿日期:2022-04-01)
