CircACTR2调节miR-23a-3p/TBL1X轴对高糖诱导的滋养层细胞损伤的影响
2023-10-15黄春艳向汨费志医高琴
黄春艳,向汨,费志医,高琴
妊娠糖尿病是女性妊娠过程中发生或首次发现的糖耐量异常疾病,高龄、肥胖是其主要致病因素[1]。妊娠糖尿病易导致胎儿畸形、早产、流产等,增加妊娠女性发生2 型糖尿病和心血管疾病的风险[2]。滋养层细胞在胚胎早期着床、排除代谢物和母胎物质交换等方面发挥重要作用,其异常易引起早产、流产等[3]。因此,深入探究滋养层细胞损伤机制对治疗妊娠糖尿病有重要意义。环状RNA(circular RNA,circRNA)对包括妊娠期糖尿病在内的多种代谢类疾病的增殖、凋亡和迁移等生物学进程具有调控作用[4]。有研究表明,环状RNA 肌动蛋白相关蛋白2(circular RNA actin related protein 2,circACTR2)在妊娠糖尿病患者中过表达[5]。circRNA 可充当微小RNA(miRNA)的“海绵”来调节基因的表达。miR-23a-3p在糖尿病患者中低表达,抑制miR-23a-3p 表达可抵消白藜芦醇对妊娠糖尿病小鼠和脂肪细胞的葡萄糖摄取和脂质代谢的改善作用[6]。还有研究表明,转导素β1X 连锁蛋白(TBL1X)的异常高表达与胎盘质量增加显著相关[7]。而circACTR2 通过调控miR-23a-3p/TBL1X轴对高糖诱导的滋养层细胞的影响尚不明确。因此,本研究主要探究circACTR2 对高糖诱导的滋养层细胞的影响及可能的分子机制。
1 材料与方法
1.1 实验材料 人绒毛膜滋养层细胞HTR-8/Svneo 购自美国ATCC公司。CCK-8试剂盒(R2704)购自北京康瑞纳生物科技有限公司;丙二醛(MDA)检测试剂盒、乳酸脱氢酶(LDH)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒购自上海江莱生物科技有限公司;兔源一抗TBL1X、增殖细胞核抗原(PCNA)、基质金属蛋白酶(MMP)-2、MMP-9、胱天蛋白酶3(caspase-3)以及辣根过氧化物酶标记的羊抗兔二抗均购自英国Abcam 公司;LipofectamineTM2000 Reagent 购自美国Invitrogen 公司;circACTR2 敲低质粒(si-circACTR2)及对照(si-NC),miR-23a-3p 抑制剂(miR-23a-3p inhibitor)及对照(inhibitor-NC)、miR-23a-3p 模拟物(miR-23a-3p mimics)及对照(mimics-NC)、circACTR2 及miR-23a-3p 引物购自广州RiboBio公司。
1.2 方法
1.2.1 细胞培养 将HTR-8/Svneo 细胞置于含10%胎牛血清、1%青-链霉素的DMEM 培养基中,在37 ℃、5%CO2的稳定环境下常规培养,定期观察,每2 d更换1次培养基,当细胞融合度达到80%以上时,消化传代,收集对数生长期的细胞进行实验。
1.2.2 细胞转染 将对数生长期的HTR-8/Svneo 细胞分为NG 组(5.5 mmol/L 葡萄糖处理)、HG 组[8](25 mmol/L 葡萄糖处理)、si-NC 组(25 mmol/L 葡萄糖+转染si-NC)、sicircACTR2 组(25 mmol/L 葡萄糖+转染si-circACTR2)、sicircACTR2+inhibitor-NC 组(25 mmol/L 葡萄糖+si-circACTR2和inhibitor-NC 共转染)、si-circACTR2+miR-23a-3p inhibitor组(25 mmol/L 葡萄糖+si-circACTR2 和miR-23a-3p inhibitor共转染)。转染严格按照Lipofectamine™2000 Transfection Reagent操作步骤进行。
1.2.3 实时荧光定量PCR(qPCR)法检测circACTR2、miR-23a-3p表达 使用Trizol 试剂提取细胞中的总RNA,将RNA逆转录为cDNA 后,以cDNA 为模板进行扩增。引物序列:circACTR2 上游5'-TGTGCTTTCTGGAGGTACT-3',下游5'-TGCCTCATCACCAACCATA-3' ;miR-23a-3p 上 游 5'-CAGTCTTGTCCAGTTTTC-3' ,下游5'-TATGCTTGTTCTCGTCTCTGTG-3' ;GAPDH 上游5'-CTGGGCTACACTGAGCACC-3',下游5'-AAGTGGTCGTGTGTGAGGAGCAATG-3';U6 上游5'-AACGCTTCACGAATTGCGT-3',下游5'-CTCGCTTCGGCACACA-3'。分别以GAPDH、U6 为内参,采用2-ΔΔCt法计算细胞中circACTR2、miR-23a-3p的相对表达量。
1.2.4 CCK-8 法检测细胞增殖 各组细胞以1×104个/孔接种到96孔板中。分别将细胞培养24、48、72 h后,弃去细胞上清液,向每个孔中加入含有10 μL CCK-8溶液的100 μL完全培养基。孵育2 h 后,使用酶标仪检测450 nm 处光密度(OD)值。
1.2.5 流式细胞仪检测细胞凋亡 收集各组HTR-8/Svneo细胞,以预冷的PBS 洗涤2 次,添加100 μL 结合缓冲液悬浮细胞,再分别添加Annexin V-FITC 和PI 染液5 μL,充分混匀,于室温下避光染色15 min,使用流式细胞仪检测细胞凋亡情况。
1.2.6 划痕实验检测细胞迁移 取各组细胞,置于37 ℃、5%CO2培养箱中培养24 h 后,采用20 μL 移液器枪头进行划痕,显微镜下记0 h 时细胞的划痕宽度为W0,记24 h 时细胞的划痕宽度为W24。划痕愈合率(%)=(W0-W24)/W0×100%。
1.2.7 MDA 水平以及LDH、SOD 活性检测 取各组HTR-8/Svneo细胞,加入提取液,超声破碎细胞,收集上清液,采用酶联免疫吸附试验检测MDA含量和LDH、SOD活性。
1.2.8 Western blot检测蛋白表达 利用RIPA裂解缓冲液冰上裂解30 min提取HTR-8/Svneo 细胞总蛋白。BCA 法定量,蛋白样品变性后每孔50 μg加载到10%聚丙烯酰胺凝胶中进行电泳分离,100 V 恒压转移蛋白至PVDF 膜上,用5%的脱脂奶粉封闭2 h,将膜与一抗TBL1X、PCNA、MMP-2、MMP-9、caspase-3、GAPDH(1∶1 000)在4 ℃孵育过夜,再将膜与HRP偶联的羊抗兔二抗(1∶5 000)在室温下孵育2 h,弃去液体,洗涤3 次,加入ECL 试剂观察蛋白质印迹,Image J 软件评估蛋白的灰度值。通过目的蛋白与GAPDH 的灰度值比,得出其蛋白相对表达量,GAPDH为内参蛋白。
1.2.9 双萤光素酶报告基因实验 分别构建circACTR2野生型质粒(circACTR2-WT)和突变型质粒(circACTR2-MUT),TBL1X 野生型质粒(TBL1X-WT)和突变型质粒(TBL1XMUT),将其分别与mimics-NC 或miR-23a-3p mimics 共转染于HTR-8/Svneo细胞,48 h后检测萤光素酶活性。
1.3 统计学方法 Graphpad Prism 7.0 软件用于数据分析。正态分布计量资料采用均值±标准差()表示。多组间均数比较采用单因素方差分析,组间多重比较采用SNK-q检验。所有实验重复6次。P<0.05为差异有统计学意义。
2 结果
2.1 各组HTR-8/Svneo 细胞中circACTR2、miR-23a-3p 表达比较 与NG 组相比,HG 组HTR-8/Svneo细胞中circACTR2表达升高,miR-23a-3p表达降低(P<0.05);与HG 组、si-NC 组相比,sicircACTR2组细胞中circACTR2表达降低,miR-23a-3p 表达升高(P<0.05);与si-circACTR2 组、sicircACTR2+inhibitor-NC 组相比,si-circACTR2+miR-23a-3p inhibitor 组细胞中circACTR2 表达变化差异无统计学意义(P>0.05),miR-23a-3p 表达降低(P<0.05),见表1。
Tab.1 Comparison of expression of circACTR2 and miR-23a-3p in HTR-8/Svneo cells between the six groups表1 各组HTR-8/Svneo细胞中circACTR2、miR-23a-3p表达比较(n=6,)
**P<0.01;a与NG 组比较,b与HG 组比较,c与si-NC 组比较,d与si-circACTR2 组比较,e 与si-circACTR2+inhibitor-NC 组比较,P<0.05;表2—4同。
?
2.2 各组HTR-8/Svneo 细胞增殖能力比较 培养24、48、72 h后,与NG组相比,HG组HTR-8/Svneo细胞OD450值降低(P<0.05);与HG 组、si-NC 组相比,si-circACTR2 组HTR-8/Svneo 细胞OD450值升高(P<0.05);与si-circACTR2 组、si-circACTR2+inhibitor-NC 组相比,si-circACTR2+miR-23a-3p inhibitor 组HTR-8/Svneo 细胞OD450值降低(P<0.05),见表2。
Tab.2 Comparison of proliferative ability of HTR-8/Svneo cells between the six groups表2 各组HTR-8/Svneo细胞增殖能力比较(n=6,OD450值,)
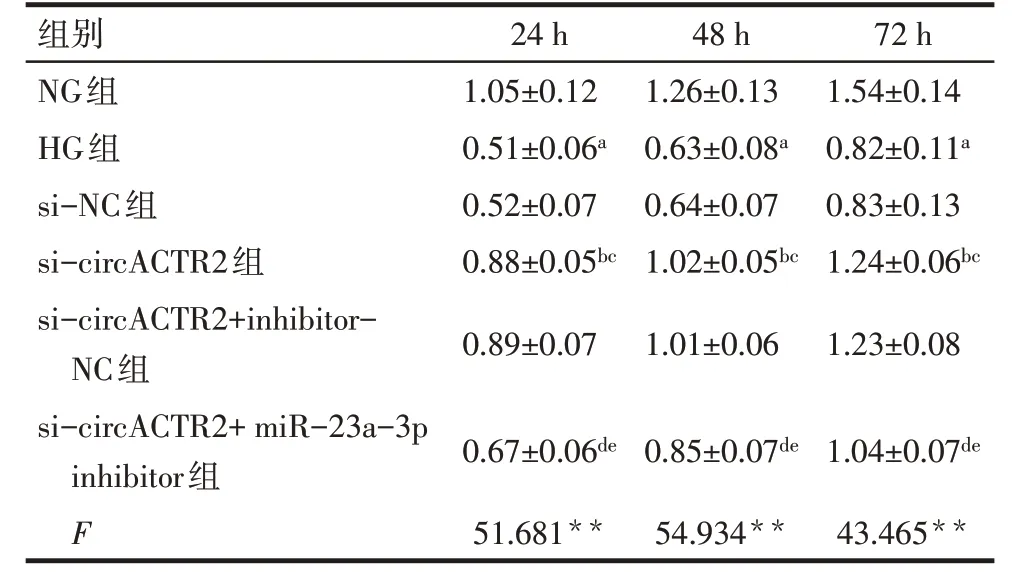
Tab.2 Comparison of proliferative ability of HTR-8/Svneo cells between the six groups表2 各组HTR-8/Svneo细胞增殖能力比较(n=6,OD450值,)
?
2.3 各组HTR-8/Svneo 细胞凋亡情况比较 与NG组相比,HG 组HTR-8/Svneo 细胞凋亡率升高(P<0.05);与HG 组、si-NC 组相比,si-circACTR2 组HTR-8/Svneo 细胞凋亡率降低(P<0.05);与sicircACTR2 组、si-circACTR2+inhibitor-NC 组相比,si-circACTR2+miR-23a-3p inhibitor 组HTR-8/Svneo细胞凋亡率升高(P<0.05),见图1。
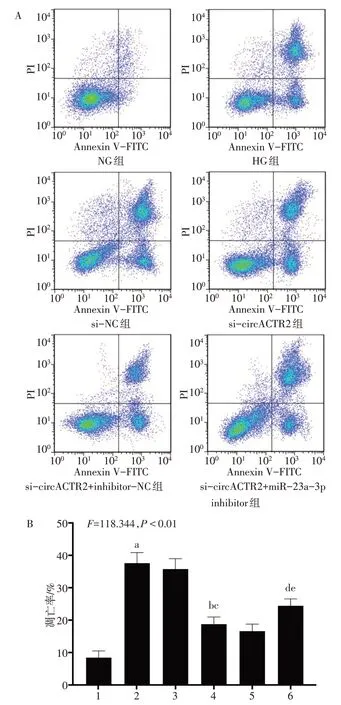
Fig.1 Comparison of HTR-8/Svneo cell apoptosis and apoptosis rate between the six groups图1 各组HTR-8/Svneo细胞凋亡情况及凋亡率比较
2.4 各组HTR-8/Svneo 细胞迁移能力比较 与NG组相比,HG 组细胞划痕愈合率降低(P<0.05);与HG组、si-NC组相比,si-circACTR2组细胞划痕愈合率升高(P<0.05);与 si-circACTR2 组、sicircACTR2+inhibitor-NC 组相比,si-circNFATC3+miR-183-5p inhibitor 组细胞划痕愈合率降低(P<0.05),见图2。

Fig.2 Comparison of HTR-8/Svneo cell migration and scratch healing rate between the six groups图2 各组HTR-8/Svneo细胞迁移情况及其划痕愈合率比较
2.5 各组HTR-8/Svneo 细胞MDA 水平以及LDH、SOD 活性比较 与NG 组相比,HG 组HTR-8/Svneo细胞中MDA 水平升高,LDH 活性增强,SOD 活性减弱(P<0.05);与HG组、si-NC 组相比,si-circACTR2组HTR-8/Svneo 细胞MDA 水平降低,LDH 活性减弱,SOD活性增强(P<0.05);与si-circACTR2组、sicircACTR2+inhibitor-NC 组相比,si-circNFATC3+miR-183-5p inhibitor组细胞MDA水平升高,LDH活性增强,SOD活性减弱(P<0.05),见表3。
Tab.3 Comparison of MDA level,LDH,SOD activities of HTR-8/Svneo cells between the six groups表3 各组HTR-8/Svneo细胞MDA水平以及LDH、SOD活性比较(n=6,)
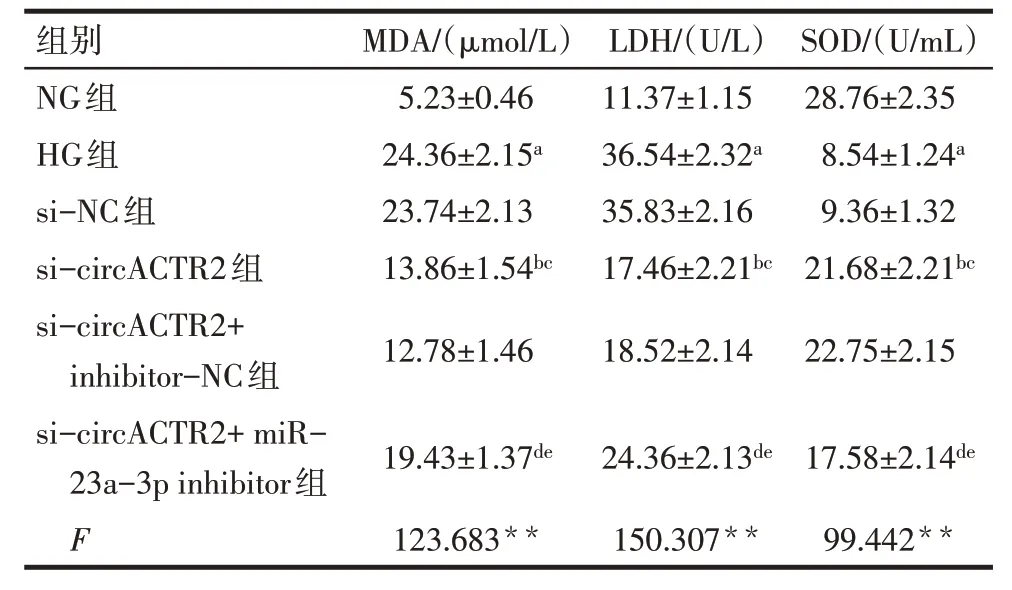
Tab.3 Comparison of MDA level,LDH,SOD activities of HTR-8/Svneo cells between the six groups表3 各组HTR-8/Svneo细胞MDA水平以及LDH、SOD活性比较(n=6,)
?
2.6 各组TBL1X、PCNA、MMP-2、MMP-9、caspase-3 蛋白表达水平比较 与NG 组相比,HG 组HTR-8/Svneo细胞中PCNA、MMP-2、MMP-9蛋白表达降低,TBL1X、caspase-3表达升高(P<0.05);与HG组、si-NC 组相比,si-circACTR2 组HTR-8/Svneo 细胞PCNA、MMP-2、MMP-9 蛋白表达升高,TBL1X、caspase-3 表达降低(P<0.05);与si-circACTR2 组、si-circACTR2+inhibitor-NC 组相比,si-circACTR2+miR-23a-3p inhibitor 组HTR-8/Svneo 细胞PCNA、MMP-2、MMP-9蛋白表达降低,TBL1X、caspase-3表达升高(P<0.05),见图3、表4。

Fig.3 Western blot detection of TBL1X,PCNA,MMP-2,MMP-9 and caspase-3 protein expression in HTR-8/Svneo cells图3 Western blot检测HTR-8/Svneo细胞中TBL1X、PCNA、MMP-2、MMP-9、caspase-3蛋白表达
Tab.4 Comparison of protein expression of TBL1X,PCNA,MMP-2,MMP-9 and caspase-3 in HTR-8/Svneo cells between the six groups表4 各组HTR-8/Svneo细胞中TBL1X、PCNA、MMP-2、MMP-9、caspase-3蛋白表达比较 (n=6,)
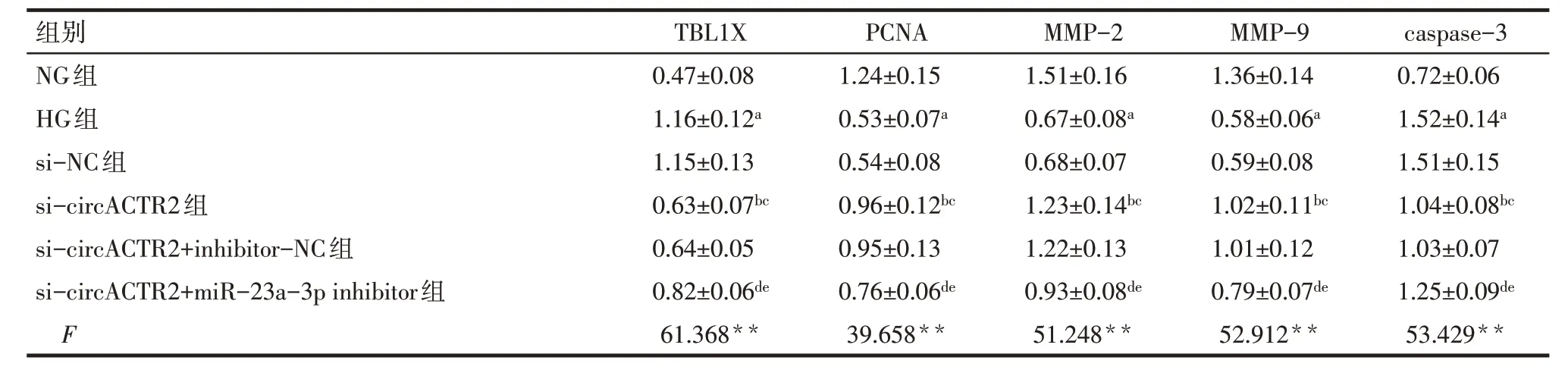
Tab.4 Comparison of protein expression of TBL1X,PCNA,MMP-2,MMP-9 and caspase-3 in HTR-8/Svneo cells between the six groups表4 各组HTR-8/Svneo细胞中TBL1X、PCNA、MMP-2、MMP-9、caspase-3蛋白表达比较 (n=6,)
?
2.7 双萤光素酶报告基因检测结果 Starbase 网站预测circACTR2与miR-23a-3p的结合位点见图4A,miR-23a-3p 与TBL1X 的结合位点见图5A。在circACTR2-WT 中,与转染mimics-NC 相比,转染miR-23a-3p mimics 后细胞萤光素酶活性降低(P<0.05),在circACTR2-MUT的细胞中萤光素酶活性差异无统计学意义(P>0.05),见图4B。与转染mimics-NC 相比,转染miR-23a-3p mimics 后,同时转染TBL1X-WT 的细胞萤光素酶活性降低(P<0.05),而同时转染TBL1X-MUT 的细胞萤光素酶活性变化无统计学意义(P>0.05),见图5B。
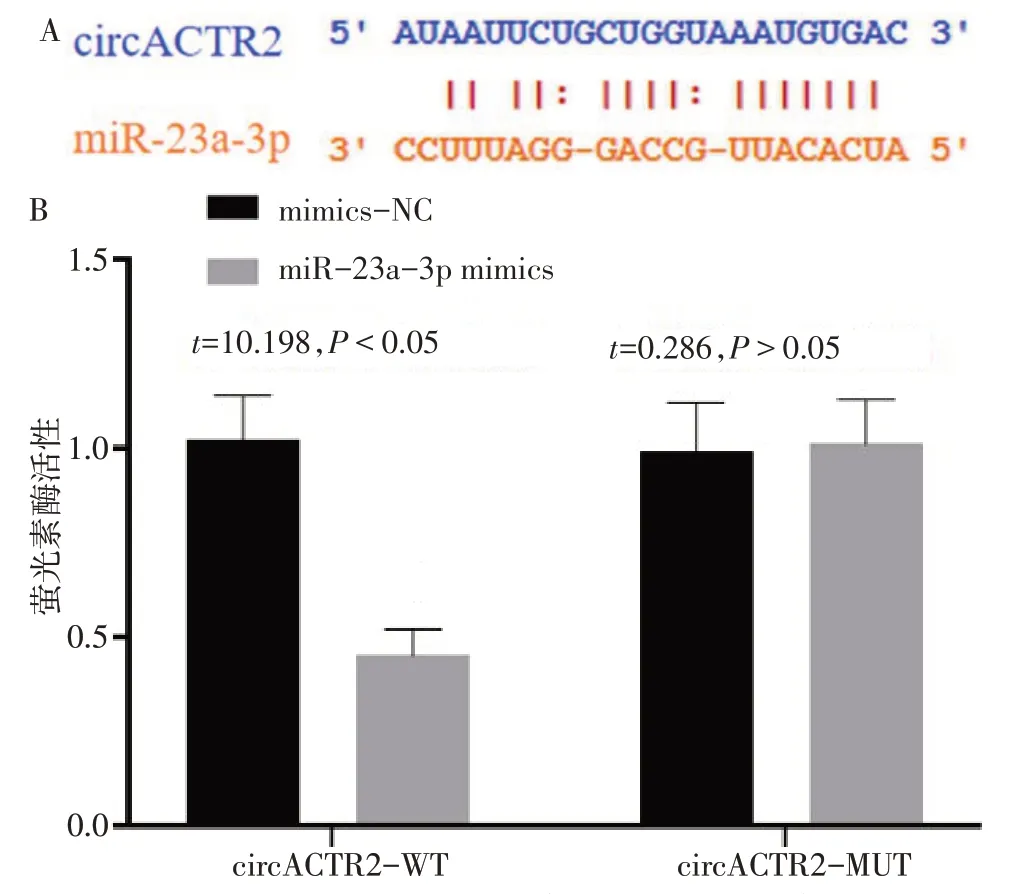
Fig.4 Binding sites of circACTR2 to miR-23a-3p and Results of dualluciferase assay图4 circACTR2与miR-23a-3p的结合位点及双萤光素酶检测结果
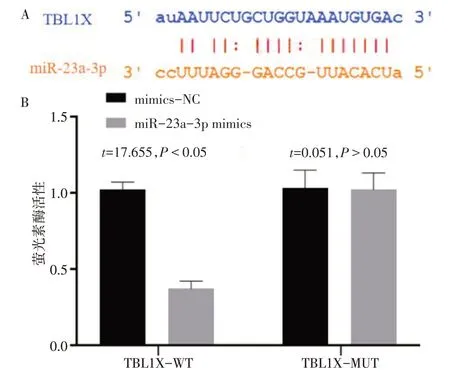
Fig.5 Binding sites of miR-23a-3p to TBL1X and Results of dualluciferase assay图5 miR-23a-3p与TBL1X的结合位点及双萤光素酶检测结果
3 讨论
3.1 高糖可诱导HTR-8/Svneo 细胞损伤 妊娠糖尿病是妊娠期发生的一种严重危害母婴健康的疾病[9]。妊娠糖尿病发生的主要原因是糖代谢异常,高糖处理能使滋养层细胞的微绒毛排列紊乱,出现疏密不均等现象,促进滋养层细胞凋亡和氧化应激,抑制细胞增殖和迁移[10]。本研究用25 mmol/L 葡萄糖处理HTR-8/Svneo 细胞,结果表明细胞增殖和迁移能力、SOD 活性减弱,MDA 含量升高,LDH 活性、凋亡能力增强。
3.2 敲低circACTR2 可抑制高糖诱导的HTR-8/Svneo 细胞损伤 circRNA 是一类具有稳定结构、表达丰富、内源性竞争等特点的非编码RNA,其可参与到妊娠糖尿病的多种生物学过程中[11]。有研究表明,circ_0008285 在妊娠糖尿病患者中表达显著上调,敲低circ_0008285 促进了高糖诱导的HTR-8/Svneo细胞的增殖、侵袭和迁移[12]。而在妊娠糖尿病患者的胎盘和血浆中circ_0005243 表达显著降低,敲低circ_0005243可抑制滋养层细胞的增殖和迁移能力[13]。circACTR2 在高糖诱导的HK-2 细胞中表达上调,可参与炎症反应和细胞焦亡[14],而孕妇血浆中circACTR2 水平升高可预测妊娠糖尿病,妊娠糖尿病患者血浆circACTR2 水平升高可预测宫内死亡、胎儿畸形等多种不良事件[5]。本研究结果显示,敲低circACTR2 可使HTR-8/Svneo 细胞增殖能力、PCNA、MMP-2、MMP-9 表达、SOD 活性升高,circACTR2 和caxpase-3 表达、凋亡率、MDA 含量、LDH 活性明显降低,提示敲低circACTR2 可促进高糖诱导的HTR-8/Svneo 细胞增殖和迁移能力,抑制细胞凋亡和氧化应激。
3.3 敲低circACTR2 可通过靶向miR-23a-3p 抑制HTR-8/Svneo细胞损伤 miRNA在妊娠糖尿病进展中发挥重要作用[15]。与健康妊娠者相比,妊娠糖尿病患者血清中的miR-195-5p 表达显著增加,miR-195-5p 可作为妊娠糖尿病的诊断生物标志物[16]。circRNA 可靶向miRNA 对妊娠糖尿病起调控作用,如circ-PNPT1 可通过直接吸附miR-889-3p 调节高糖诱导的滋养层细胞功能障碍[17]。本研究结果显示,敲低circACTR2 可靶向上调miR-23a-3p 表达,且抑制miR-23a-3p减弱了敲低circACTR2对HTR-8/Svneo细胞增殖和迁移能力的促进作用,增强了细胞凋亡和氧化应激。故提示敲低circACTR2可能通过上调miR-23a-3p 促进HTR-8/Svneo 细胞增殖和迁移,抑制细胞凋亡和氧化应激。
3.4 敲低circACTR2 可通过调控miR-23a-3p/TBL1X轴抑制HTR-8/Svneo细胞损伤 miRNA可通过靶向抑制其特定mRNA翻译或促进降解来调控基因表达,从而参与细胞增殖、凋亡和迁移等多种生物学过程。有研究表明,miR-345-3p 通过靶向BAK1抑制滋养层细胞凋亡,促进细胞增殖和迁移[18]。本研究表明,miR-23a-3p 可靶向负调控TBL1X 表达,下调miR-23a-3p 减弱了敲低circACTR2 对TBL1X蛋白表达的抑制作用。
综上所述,敲低circACTR2 可通过调控miR-23a-3p/TBL1X轴,进而抑制高糖诱导的滋养层细胞损伤,从而发挥保护作用。circACTR2/miR-23a-3p/TBL1X 轴可能成为治疗妊娠糖尿病的一个新的靶点。然而本研究尚存在不足之处,仅在细胞水平上验证了circACTR2/miR-23a-3p/TBL1X 轴对HTR-8/Svneo细胞增殖、凋亡、迁移和氧化应激的影响,后续研究将会在动物体内进一步探索。
