羧甲基-β-环糊精共价偶联10-羟基喜树碱的合成与性能
2023-10-13申春晓
张 艺,张 瑞,周 婧,王 璐,申春晓
(信阳学院 理工学院,河南信阳 464000)
目前癌症仍然是世界上最具破坏性的疾病之一。近年来随着对肿瘤生物学的进一步研究,以及诊断设备和治疗方法的进一步完善,癌症的死亡率明显下降[1-2]。然而,临床上常用的化疗治疗因抗癌药物的低溶解性及癌细胞的抗多药耐药性都使化疗治疗效率低,并且常伴有严重的毒副作用[3]。因此迫切需要解决药物的溶解性和生物相容性问题,提高抗癌药物的利用率。
β-环糊精(β-CD)是由7个α-葡萄糖重复单元,通过α-1, 4-糖苷键偶联而形成的,具有亲水性的表面和疏水性的空腔,具有低毒性和良好的生物相容性[4],但是天然环糊精低的溶解度和单一的功能基团,限制了它在功能超分子中的应用,通过化学改性的方法将一些羟基改变成其他各种特定功能基团后,其性能常发生较大改变[5]。近年来,在环糊精的改性方面有了大量的研究成果。如利用环糊精分子洞外表面的醇羟基发生酰化、酯化、交联、醚化等化学反应[6],增加其他的功能基团以改性合成具有相应性能的环糊精衍生物,满足了不同领域研究人员的需求。从而改变了环糊精的应用范围,如医学、生物学、化工生产、食品、信息技术、环保等领域[7]。在众多的β-环糊精衍生物中,羧甲基-β-环糊精(CM-β-CD)为阴离子型β-CD 衍生物,有较好的溶解性能,对脂质的溶解性较小,比HP-β-CD 溶血作用小。
羟基喜树碱(HCPT)是一类具有细胞毒性的生物碱。但是由于HCPT 在水中的溶解度较差,结构不稳定,半衰期短并且能够损伤正常组织细胞,限制了HCPT 在化疗治疗中的应用。所以选用CM-β-CD 通过酯化反应共价偶联HCPT,可改善HCPT 的疏水性和生物相容性,在肿瘤组织中酯化酶的作用下可以有效控制药物释放,同时该合成工艺比较简单。
1 实验部分
1.1 实验仪器与试剂
β-CD(分析纯),上海阿拉丁生化科技股份有限公司;氯乙酸(分析纯),天津博迪化工股份有限公司;4-二甲氨基吡啶(分析纯),1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐(分析纯),上海阿拉丁生化科技股份有限公司,傅里叶红外光谱仪(INVENIOS 型);双光束紫外可见分光光度计(TU-19型);真空离心冻干机(Pilot10-15M 型)。
1.2 羧甲基-β-环糊精的合成
根据文献报道方法制备羧甲基-β-环糊精如图1所示。取9.08 g 的β-环糊精溶解在25%的氢氧化钠溶液中,控制水浴温度 在40~60℃,得到澄清透明的溶液。向其中滴加配制好的1 mol/L的氯乙酸水溶液(含氯乙酸6.426 g),水浴升温至60℃,持续反应4 h,反应结束后先测定溶液的pH,加入适量的稀盐酸调节pH为7左右,加入甲醇使其沉淀,直到不再生成沉淀为止,静置,离心,干燥,得白色粉末5.3 g,产率为40.7%。
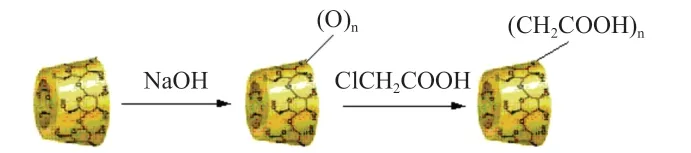
图1 羧甲基-β-环糊精的合成
1.3 羧甲基-β-环糊精共价偶联10-羟基喜树碱的合成
取羧甲基-β-环糊精(0.162 mmol,250 mg)和10-羟 基 喜 碱(0.321 mol,117 mg)溶 解 在2 mL 的DMSO 中,在室温下避光搅拌,随后向其中加入EDC×HCl(18.8 mg,0.098 mmol),DMAP(12 mg,0.098 mmol),和 10 μL 的三乙胺,继续搅拌24 h 后停止反应,将反应液装入1 KD 的透析袋中,透析,离心。收集透析袋里的水溶液,冻干,最后收集淡黄色产物,质量为15.5 mg,产率为13.6%。
1.4 HCPT/CM-β-CD的体外模拟释药实验
将HCPT/CM-β-CD(50 μg HCPT/2 mL)装入到1 KD 透析袋中,分别放入10 mL pH 为5.0、6.5、7.4的PBS 缓冲溶液中,放置在37℃恒温水浴振荡器中释放72 h。在释药过程中,分别在 0.25 h、0.5 h、1 h、2 h、4 h、8 h、12 h、24 h、48 h、72 h 时 取 样5 mL,随后加入同等体积的对应pH 的缓冲溶液。释药结束后利用紫外分光光度计检测样品中HCPT 的含量,并根据建立的标准曲线测定HCPT 在不同 pH 的 PBS 中的释放量。
式中:C为所取样品的浓度(μg/mL);W0为最初载药量(μg);n为取样次数。
2 结果与讨论
2.1 羧甲基-β-环糊精的结构表征
由图2可知,β-CD 单体在3 420 cm-1处的吸收峰为β-CD 的醇羟基吸收峰,而CM-β-CD 在1 610 cm-1和1 400 cm-1处出现了额外的-COO-的吸收峰,证实了羧甲基-β-环糊精的合成。

图2 β-CD和CM-β-CD的红外光谱
2.2 HCPT/CM-β-CD的结构表征
CM-β-CD 和HCPT/CM-β-CD 的 红 外 光 谱 图 如图3 所示。CM-β-CD 在3 450 cm-1处出现明显的-OH的伸缩振动,在 1 050 cm-1处出现强烈的C-O 键的伸展,在1 600 cm-1处出现碳氧双键的吸收峰。但是在3 450 cm-1、1 050 cm-1两 处,HCPT/CM-β-CD 的 吸 收峰明显减弱。HCPT/CM-β-CD 在1 600 cm-1处没有出现任何吸收峰。
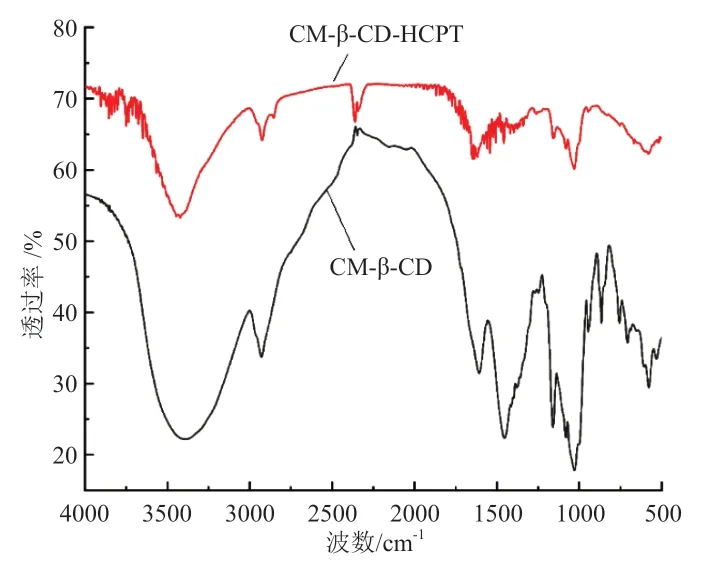
图3 CM-β-CD与HCPT/CM-β-CD的红外光谱
为了测定HCPT/CM-β-CD 的载药量,选用紫外分光光度计对10-羟基喜树碱的含量进行分析和测定。首先建立 10-羟基喜树碱的标准曲线,取10-羟基喜树碱溶解在DMSO 中,配制成100 μg/mL 的HCPT溶液作为母液。然后加蒸馏水分别稀释成0.5,2.5,5,10,15,20 μg/mL 的一系列标准液,用紫外-可见分光光度计分别测试这一系列标准液在 379 nm 处的吸光度,建立10-羟基喜树碱的标准曲线,如图4所示。此标准曲线方程为A=0000533c–0.00395(R2=0.9994)
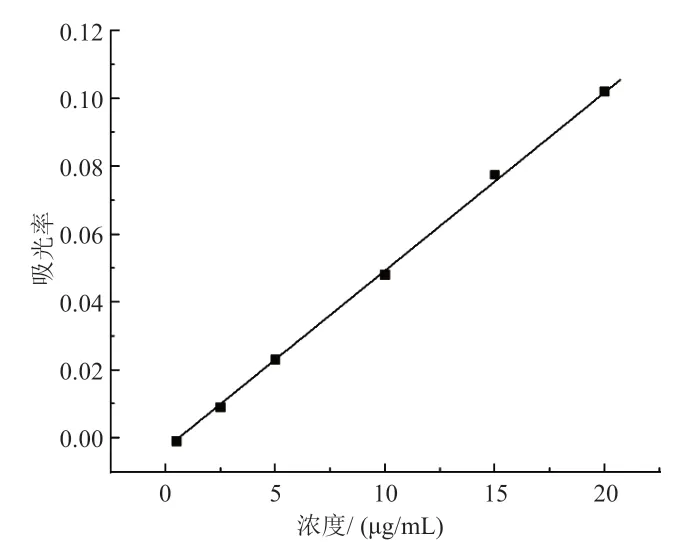
图4 10-羟基喜树碱的标准曲线
通过检测透析液中10-羟基喜树碱的含量计算该载药聚轮烷的载药量为20.7%。
2.3 HCPT/CM-β-CD的体外模拟释药分析
HCPT 和CM-β-CD 的共价偶联是通过环糊精上的羟基和d-HCPT 的羧基酯化反应来实现。而酯键在酯化酶的存在下不稳定容易发生酶解,因此可以通过断裂酯键来实现药物的释放,如图5所示。

图5 37℃时HCPT/CM-β-CD的体外释药曲线
由图5 可知,当pH=5.0 时,HCPT 释放速率相对较快,pH=6.5 时HCPT 的药物释放速率适中,在pH=7.4时累积释放量较小。当 pH=5.0时释放量达到79%,据文献报[8],在催化酶的作用下酯键更容易断裂。由于肿瘤环境的 pH 在5.0左右且有酶的存在,因此在肿瘤组织中药物可以更有效地释放。
3 结论与展望
利用氯乙酸对β-CD 进行改性合成水溶性较好的CM-β-CD。通过酯化反应共价偶联10-羟基喜树碱,并对其进行结构表征和生物性能研究。红外光谱显示HCPT/CM-β-CD 成功合成,载药量为20.7%。结合体外模拟释药实验对其生物性能进行了探究,研究表明HCPT/CM-β-CD 可以有效提高HCPT 的稳定性,并且可以有效控制药物在肿瘤组织中的释放,释放量达到79%。采用CM-β-CD 共价偶联10-羟基喜树碱可以提高药物的溶解性和稳定性,并且能够在肿瘤组织中得到有效释放,在医学领域具有较好的应用前景。
本文只是通过体外模拟释药对HCPT/CM-β-CD进行了生物性能研究,而且只研究了一种抗癌药物,以后会选用择更多地抗癌药物对其进行共价偶联,提高抗癌药物的溶解性和稳定性,并进一步通过体外细胞毒性实验和体内动物实验对HCPT/CM-β-CD 进行生物性能的研究。
