司库奇尤单抗治疗中重度斑块状银屑病疗效及安全性的真实世界研究
2023-10-13袁瑾黄悦周昆丽赵小燕吴泳张启国蔡良奇
袁瑾,黄悦,周昆丽,赵小燕,吴泳,张启国,蔡良奇
银屑病是一种由免疫介导的慢性复发性炎症性系统性疾病,严重危害患者的身心健康。现随着银屑病发病机制研究的逐渐深入,白细胞介素(IL)-17A已被确定为银屑病发病机制中的一个关键效应细胞因子[1]。司库奇尤单抗是首个全人源特异性靶向IL-17A的单克隆抗体,由2019年在中国获批用于治疗符合系统治疗或光疗指征的成人中重度斑块状银屑病患者,并于2021年纳入医保目录,治疗费用明显降低,惠及了更多银屑病患者。尽管已有较多的随机对照试验证实了其在银屑病治疗的疗效和安全性,但国内真实世界的研究数据尚少,为更多地了解其有效性和安全性,本研究回顾性分析本科2021年9月—2022年4月采用司库奇尤单抗治疗的45例中重度斑块状银屑病患者,并评价其疗效及安全性。
1 资料和方法
1.1研究对象 纳入2021年9月—2022年4月就诊于厦门大学附属第一医院皮肤科门诊的45例使用司库奇尤单抗治疗的中重度斑块状银屑病患者。纳入标准:①年满18周岁;②符合斑块状银屑病诊断标准[2];③符合中重度银屑病评分标准:银屑病皮损面积及严重程度指数(Psoriasis Area and Severity Index,PASI) ≥3分或体表受累面积(Body Surface Area,BSA)≥3%[2]。排除标准:①妊娠或哺乳期妇女;②结核(含潜伏结核)、乙型肝炎(含乙肝抗原携带)、丙型肝炎、HIV 感染患者;③合并恶性肿瘤患者;④患炎症性肠病及其他免疫功能严重低下者;⑤对司库奇尤单抗或其辅料过敏的患者。45例患者中,16例接受司库奇尤单抗150 mg治疗,男10例,女6例,平均年龄(42.1±11.6)岁,平均病程(13.4±10.7)年,平均体重(57.5±3.2)kg;29例接受司库奇尤单抗300 mg治疗,男20例,女9例,平均年龄(39.6±10.1)岁,平均病程(12.4±7.4)年,平均体重(66.9±10.2)kg,两组除体重有差异外,在性别、年龄、病程上差异均无统计学意义。所有患者均曾经传统手段(如口服阿维A、甲氨蝶呤、环孢素、中药、外用药物及紫外线光疗等)治疗无效或不耐受,治疗前均签署知情同意书。
1.2方法 根据药品说明书,患者分别于第0、1、2、3、4周皮下注射司库奇尤单抗150 mg(体重低于60 kg的部分患者根据意愿选择,n=16)或300 mg(n=29),随后维持该剂量每4周给药1次,所有患者均完成至少24周的治疗疗程。
1.3疗效和安全性评估 于第4、12、24周复诊时予以复查血常规、血生化。通过PASI评分,BSA评分(%),皮肤病生活质量指数(Dermatology Life Quality Index, DLQI)的变化对患者进行疗效评估,PASI改善率=(治疗前总分-治疗后总分)/治疗前总分×100%,PASI改善75%、90%和100%分别标记为PASI75、PASI90和PASI100,DLQI 0/1代表皮肤病对生活质量无影响[3]。并详细记录观察期间发生的不良反应。

2 结果
2.1PASI评分变化及PASI75、PASI90、PASI100应答率 所有患者基线时PASI评分为10.2±3.9,治疗第4、12、24周后PASI评分较基线均明显下降,P<0.001(表1)。使用司库奇尤单抗150 mg患者基线时PASI评分均值为8.5±2.5,而使用300 mg的患者基线时PASI评分均值为11.2±4.2,两组PASI评分差异有统计学意义,P=0.009。其中两组PASI75、PASI90、PASI100应答率见表2。
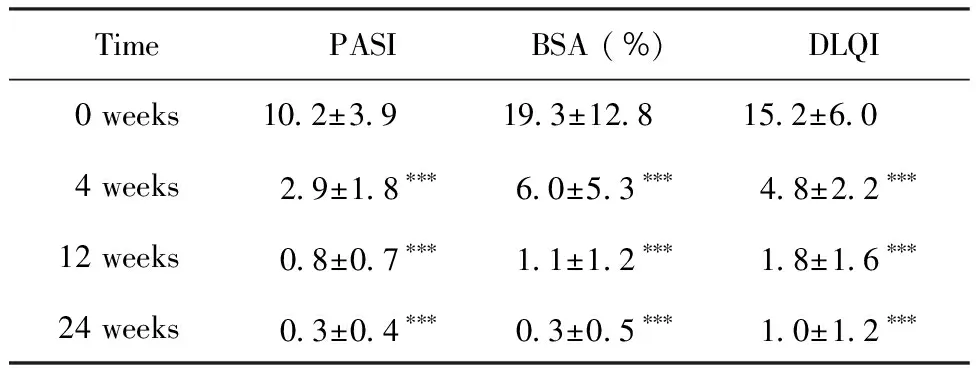
表1 所有患者治疗前后PASI、BSA、DLQI评分变化
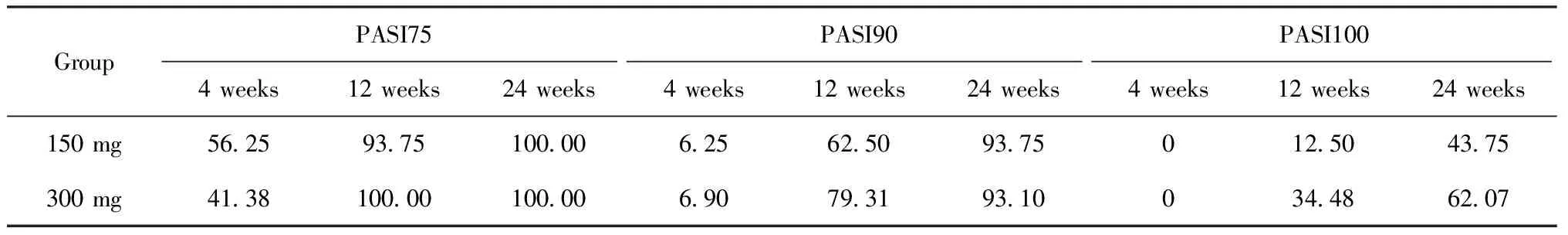
表2 150 mg、300 mg治疗组患者PASI75、PASI90、PASI100应答率 (%)
2.2BSA评分变化 所有患者基线时BSA评分为(19.3±12.8)%,治疗第4、12、24周后BSA评分较基线均明显下降,P<0.001(表1)。使用司库奇尤单抗抗150 mg患者基线时BSA评分均值为(13.3±7.5)%,而使用300 mg的患者基线时BSA评分均值为(22.7±14.0)%,两组BSA评分差异有统计学意义(P=0.018)。
2.3DLQI评分变化及DLQI 0/1应答率 所有患者基线时DLQI评分为15.2±6.0,治疗第4、12、24周后DLQI评分较基线均明显下降,P<0.001(表1)。使用司库奇尤单抗150 mg的患者基线时DLQI评分均值为13.6±6.1,而使用300 mg的患者基线时DLQI评分均值为16.2±5.8,两组DLQI评分差异无统计学意义(P=0.162)。150 mg患者组第4、12、24周DLQI 0/1的应答率分别为6.25%、50.00%和75.00%。而300 mg患者组第4、12、24周DLQI 0/1的应答率分别为3.45%、51.72%和79.31%(图1)。
2.4不良反应记录及安全性评价 总体而言,28.89%的患者在观察期间经历了1次或多次不良事件。在接受司库奇尤单抗150 mg和300 mg治疗的患者中,不良事件的发生率分别为25.00%和31.03%。常见的不良反应是上呼吸道感染(n=4)、多发雀斑样痣(n=3)、肝功能异常(n=2)、皮肤真菌感染(n=2,足癣和股癣各1例)、皮肤干燥(n=2)、食欲减退(n=2)和带状疱疹(n=1)。大多数不良反应都是轻度的,对症处理后均可改善或缓解。所有患者均没有发现肝炎或结核病的激活,未观察到炎症性肠病、中性粒细胞减少、注射部位疼痛或严重感染、过敏等,没有发现任何死亡或危及生命的疾病。
3 讨论
因司库奇尤单抗获批进入中国的时间并不长,其在国内有效性和安全性的真实世界研究并不多。在为期52周的中国Ⅲ期临床试验中,司库奇尤单抗已被证实在中国中重度斑块状银屑病患者中具有良好的疗效和安全性,在第52周时司库奇尤单抗300 mg和150 mg两组PASI75应答率分别为 95.4%和85%,PASI90为 82.1%和66.7%,PASI100为42.1%和31.5%[3]。Huang等[4]报道的真实世界研究中显示司库奇尤单抗300 mg在第16周时PASI75、PASI90、PASI100分别分别为91.1%、73.0%和38.3%。Zhao等[5]报道的另一项真实世界研究中,发现使用司库奇尤单抗150 mg的患者在12周时PASI75、PASI90、PASI100的应答率分别为100%、97.8%和95.7%,且该应答率持续到第24周,而300 mg患者组在12周时PASI75、PASI90、PASI100应答率分别为91.5%、86.4%和79.9%,24周时PASI75、PASI90、PASI100应答率分别为93.2%、81.4%和76.3%。该文章中使用司库奇尤单抗150 mg的患者显示出更高的PASI应答率,考虑可能与150 mg组患者较低的基线PASI评分和体重有关,既往研究表明患者的体重和基线时的PASI评分是影响疗效的两个重要因素[6-7]。本文中观察到150 mg患者组第12周时PASI75、PASI90、PASI100应答率分别为93.75%、62.50%和12.50%,在第24周时PASI75、PASI90、PASI100应答率分别为100%、93.75%和43.75%。而300 mg患组第12周时PASI75、PASI90、PASI100应答率分别为100%、79.31%和34.48%,第24周时PASI75、PASI90、PASI100应答率分别为100%、93.10%和62.07%。本文观察到与150 mg组相比,使用300 mg的患者在第12周(34.48%vs. 12.50%)和24周(62.07%vs. 43.75%)均可获得更高的PASI100应答率,尽管150 mg患者组有更低的基线PASI评分[(8.5±2.5)vs.(11.2±4.2)]、BSA评分[(13.3±7.5)%vs.(22.7±14.0)%]及更低的体重[(57.5±3.2)kgvs.(66.9±10.2)kg],但两组基线PASI评分均值及体重差异并不大,既往多项研究表明司库奇尤单抗的治疗具有一定剂量反应性[3,6],表明提高司库奇尤单抗的治疗剂量可进一步提高PASI100应答率。
除了PASI评分的快速改善外,患者BSA评分也在治疗后迅速降低。尽管目前PASI75、PASI90、PASI100的应答率是主要的评估指标,笔者认为,BSA评分的测量在某种程度上相对PASI评分更为客观便捷,有研究显示经过BSA标准化操作步骤(SOP)培训后,BSA评分可保持相当高的一致性,可为开展多中心合作的临床研究提供可靠的参考[7]。而本文观察到当BSA≤0.5%时,患者均已达到PASI90、PASI100,同样可认为疗效非常显著。
另一方面,在改善患者生活质量上,150 mg组患者第12周DLQI 0/1的应答率为50.00%,在第24周DLQI 0/1的应答率为75.00%。而300 mg组患者第12、24周DLQI 0/1的应答率分别为51.72%和79.31%,两组在改善患者生活质量上差异无统计学意义。虽然在中国Ⅲ期临床试验中[3],第12周150 mg组与300 mg组DLQI 0/1的应答率分别为28.2%和41.6%,差异有统计学意义,而第24周时150 mg组与300 mg组DLQI 0/1的应答率47.3%和52.9%。本文中观察到150 mg组与300 mg组均可达到更高的DLQI 0/1的应答率,其原因可能是本文纳入的观察对象基线时PASI评分[(10.2±3.9)vs.(26.8±10.4)]、BSA评分[(19.3±12.8)%vs.(45.4±20.1)%]比中国Ⅲ期临床试验更低,对患者生活质量影响更小,故更易获得较高的DLQI 0/1应答率,另一方面,本文为真实世界回顾性评价,比起严格的随机对照试验,患者给药方式及周期相对更灵活,这可能也是影响DLQI评分的一个因素。在另一项Zhang等[8]报道的真实世界司库奇尤单抗治疗银屑病患者中,第36周有75.0%的患者达到DLQI为0/1,与本文结果相近。
此外,本文进一步证实了司库奇尤单抗治疗中重度斑块状银屑病安全性良好,大多数不良反应与之前的报道相似[3, 9]。有2例患者在使用司库奇尤单抗300 mg治疗期间出现较明显的食欲减退,其中1例伴肝功能轻度受损,予口服多烯磷脂酰胆碱后肝功能恢复正常,后2例患者均调整为150 mg治疗,食欲减退逐渐恢复。1例患者治疗至第4个月时出现腰背部带状疱疹,经抗病毒、止痛等治疗后恢复良好,未遗留明显后遗症。此外还观察到3例患者在原有银屑病皮损部位消退后出现多发雀斑样痣,这在既往的不良反应中较少报道。近年来有一些病例报告,包括使用TNF-α抑制剂、IL-12/23抑制剂以及IL-17抑制剂(包括依奇珠单抗、司库奇尤单抗)后银屑病皮损消退区域出现多发雀斑样痣的表现[10-14]。其具体机制尚不清楚,可能与生物制剂介导的免疫抑制导致黑素细胞活化,进而引起色素沉着有关[13-14]。整个观察期间,没有发现结核分枝杆菌和乙肝的激活,也没有遇到中性粒细胞减少或炎症性肠病的病例。
生物制剂治疗银屑病显现了良好的疗效和安全性,但其昂贵的价格和较高的治疗成本对临床决策仍是一大挑战。司库奇尤单抗于2019年在我国国内获批用于治疗符合系统治疗或光疗指征的成人中重度斑块状银屑病患者,但最初价格高昂,很多患者表示经济负担太重,无法接受。在2021年3月,该药纳入国家医保目录后,治疗费用大大降低,显著减轻了患者的治疗负担。而且本文观察到体重低于60 kg,PASI评分相对较低的部分患者选择使用150 mg治疗同样获得了较高的PASI90应答率,尽管PASI100应答率低于300 mg组,但其生活质量改善程度两组差异无统计学意义。因此对于低体重(<60 kg)、低PASI评分(<10分)以及经济负担较重的患者选择150 mg治疗方案不失为一种性价比更高的选择。值得注意的是,本研究样本量较小,观察时间较短,未来需要更长的随访时间和更大规模的研究来得出更明确的结论。
