血管外膜细胞钙化及其钙化机制研究
2023-10-13谭小青张旭升樊小容黄战军
谭小青,张旭升,樊小容,黄战军
血管钙化常见于动脉粥样硬化、血脂异常、高血压、糖尿病、慢性肾病及衰老等人群[1],血管钙化引起血管硬度增加、顺应性降低,导致心肌缺血、心力衰竭、血栓形成等,增加脑卒中、心脏病、动脉粥样硬化斑块破裂等的风险,被认为是影响心血管疾病的重要因素之一[2-4]。目前关于血管内膜、中膜和心脏瓣膜钙化的关注和研究相对较多。临床工作中发现,血管外膜也可发生钙化,然而调查发现,现阶段对血管外膜钙化的关注较少,因此,需要更多的研究来阐明血管钙化的致病机制。最初血管钙化被认为是被动和退行性病变,标志着血管老化,但是越来越多研究表明血管钙化是类似于胚胎骨形成的病理生物学过程[5-6]。Boström等[7-8]研究发现,钙化过程中大鼠血管中膜细胞由原有收缩表型转变成为成骨样细胞表型,原有的收缩标志物如平滑肌肌动蛋白α(α-SMA)等表达减少,并表达核心结合因子α1(Runx2)、骨形态生成蛋白2(BMP2)等多种成骨样标志物,从而介导骨基质在血管中沉积。细胞凋亡与自噬为2种细胞死亡的方式,与血管钙化息息相关,研究表明,血管中膜细胞在细胞凋亡过程中释放凋亡小体,促进细胞钙化,而细胞自噬通过多种机制调控细胞钙化[9-10]。本研究对大鼠血管外膜细胞进行体外诱导钙化,建立大鼠血管外膜细胞钙化模型,并检测钙化过程中成骨相关指标及凋亡、自噬相关蛋白的表达变化,旨在为心血管疾病模型提供更精确的细胞模型,并初步探讨其钙化机制。
1 材料与方法
1.1 试剂
胎牛血清(FBS,Gibco),青霉素,链霉素(Gibco,美国),茜素红S溶液,β-甘油磷酸,抗坏血酸,地塞米松(Sigma,美国),抗GAPDH抗体(Bioworld),抗Bcl-2,Bax, Bcelin1和微血管相关蛋白(LC3)抗体(CST), 碱性磷酸酶检测试剂盒、钙(Ca)检测试剂盒(南京建城生物工程研究所)。
1.2 大鼠血管外膜细胞分离与培养
取10只4~6周龄雄性Wistar-Kyoto大鼠(体质量120~180 g)胸主动脉分离血管外膜,采用组织黏附法培养。使用添加10%胎牛血清的高糖DMEM培养基(Gibco dmem) 在37 ℃、5%二氧化碳条件下培养细胞。当细胞增殖至80%~90%融合时,用0.25%胰酶消化传代。使用第3代至第6代的细胞进行后续实验。
1.3 体外钙化模型的建立
钙化诱导培养基为含10%胎牛血清,10 mmol/L β-甘油磷酸钠,0.05 mmol/L 抗坏血酸和100 mmol/L 地塞米松的高糖DMEM 培养液。将第3代至第6代细胞分为对照组和钙化组,待细胞长至50%融合时,使用钙化诱导培养基培养,每3 d更换1次培养基,连续培养15 d。
1.4 碱性磷酸酶(ALP)酶活测定
细胞钙化诱导后,弃去培养基, 1×磷酸缓冲盐溶液(PBS)洗细胞3次, 加入裂解液 500 μL(1%TritonX-100),冰上裂解 40 min后,离心,取上清液。使用上清液根据试剂盒说明书检测ALP活性及总蛋白含量。
1.5 细胞内钙含量检测
细胞钙化诱导后,弃去培养基, 1×PBS洗细胞3次,每孔加入500 μL 0.6 mol/L的盐酸4 ℃脱钙过夜,取上清,根据钙测试试剂盒说明书检测钙含量。将脱钙后的细胞用 4 ℃ PBS 洗 3 次,每孔加入 500 μL NaOH/0.1%SDS 裂解细胞,取上清,用二喹啉甲酸法(BCA)测定细胞蛋白含量。
1.6 茜素红S染色
细胞钙化诱导15 d,弃去培养基, 1×PBS洗细胞3次,加入0.5 mL 4%多聚甲醛室温固定15 min, 用双蒸水洗3次, 加入1 mL 0.1%茜素红室温孵育15 min, 吸去染液, 双蒸水洗3次,在倒置显微镜下观察。
1.7 实时定量聚合酶链式反应(RT-PCR)检测
细胞钙化诱导后,弃去培养基, 1×PBS洗细胞3次,使用TaKaRa MiniBEST Universal RNA Extraction Kit提取总RNA,使用PrimeScripTMRT reagent Kit 将所提取的RNA逆转录合成 cDNA,以cDNA为模板, 通过SYBR Green I嵌合荧光定量RT-PCR检测BMP-2、Runx2和GAPDH的表达量。引物序列见表1。

表1 引物序列
1.8 蛋白免疫印迹法(Western Blot)检测
细胞钙化诱导15 d,弃去培养基,1×PBS洗细胞3次,提取细胞总蛋白。使用12% SDS-PAGE胶电泳分离,并转移到聚偏二氟乙烯膜(PVDF)上,封闭后,加入一抗(Bax 1∶1 000,Bcl-2 1∶1 000,Beclin1 1∶1 000,LC3 1∶1 000,GAPDH 1:1 000)稀释液,4 ℃孵育过夜;加入二抗稀释液(1∶10 000)室温孵育1 h后,使用ECL发光试剂盒显影并计算灰度值。
1.9 统计学处理
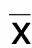
2 结 果
2.1 大鼠血管外膜细胞可在体外被诱导钙化
为验证高磷是否能诱导大鼠血管外膜细胞钙化,使用钙化诱导培养基培养细胞,在不同时间点检测ALP活性和胞内钙含量。随着培养时间延长,ALP活性逐渐上升,在培养第12天达到峰值,与对照组比较差异有统计学意义(P<0.05);诱导第3天开始所测得的胞内钙含量与对照组比较升高(P<0.05),ALP活性和钙含量升高具有时间依赖性。详见图1、图2。诱导15 d所测得钙含量最高,因此,后续实验选择的诱导时间为15 d。对钙化诱导15 d的细胞进行茜素红S染色,结果显示,对照组细胞呈长梭形,而钙化组细胞变成菱形。茜素红S染色后,钙化组可观察到大量的橘红色钙结节(见图3),而对照组完全没有。这也证明大鼠血管外膜细胞可在体外被钙化培养基诱导钙化。
图1 钙化诱导培养基诱导外膜细胞后ALP含量

图2 钙化诱导培养基诱导外膜细胞后胞内钙含量

图3 培养15 d时细胞经茜素S红染色切片图(×100)
2.2 血管外膜细胞钙化与细胞向成骨样表型转化有关
血管钙化的增加与成骨细胞特异性标志物如BMP2、和Runx2的增加有关[11]。RT-PCR结果显示,与对照组比较,钙化组的成骨细胞特异性标志物BMP2和Runx2 mRNA表达量增加,与对照组比较差异有统计学意义(P<0.05)。详见图4。

图4 外膜细胞钙化过程中BMP2和Runx2 mRNA表达量
2.3 血管外膜细胞钙化过程涉及细胞自噬及凋亡调控
通过Western Blot检测凋亡和自噬相关蛋白的表达量变化。与对照组比较,钙化组促凋亡蛋白Bax表达上调,抑凋亡蛋白Bcl-2表达下调(P<0.05)。详见图5。钙化组自噬相关蛋白Beclin1表达上调,LC3-Ⅱ/LC3-Ⅰ比例上调(P<0.05),说明钙化诱导培养后细胞内凋亡水平上调、自噬水平升高。详见图6。
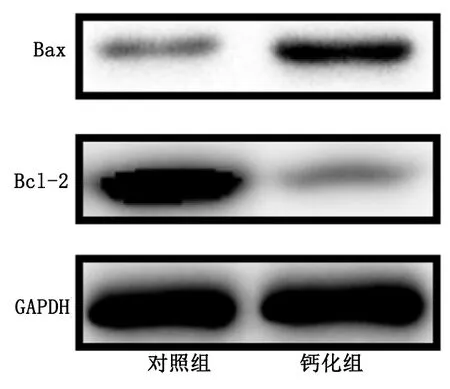
图5 诱导钙化后促凋亡蛋白及抑凋亡蛋白表达变化
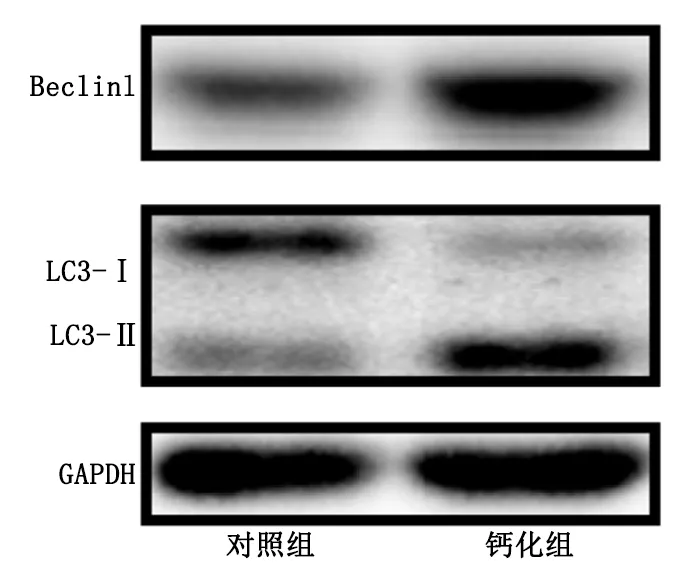
图6 诱导钙化后凋亡及自噬蛋白Beclin1等表达变化
3 讨 论
血管钙化作为心血管疾病病人的并发症之一,其发病率与严重程度逐年增高及加重,是导致心血管疾病病人高死亡率的重要因素。血管钙化缺乏有效的治疗药物。因此,探究血管钙化发病机制,在分子水平寻找有效的诊断和防治靶点是急需开展的基础研究工作。本研究证明,使用10 mmol/L β-甘油磷酸+0.05 mmol/L 抗坏血酸+100 mmol/L 地塞米松培养外膜细胞即可诱导大鼠血管外膜细胞在体外发生钙化,这是通过茜素红S染色、ALP活性检测及胞内钙含量检测结果得以确定的。
血管钙化过程中,血管中膜细胞向成骨样细胞表型转变并表达相关成骨标志物,从而引起骨基质的沉积,是血管钙化的重要特点及机制[5]。本实验所用的血管外膜细胞钙化条件与血管中膜细胞钙化条件一致,说明血管外膜细胞钙化的机制可能与中膜细胞钙化的机制部分一致。血管中膜细胞钙化过程中,细胞表达成骨相关的转录因子如Runx2等,进而促进下游表达骨相关蛋白如骨形态发生蛋白BMP2等的表达,从而促使细胞向成骨样细胞主动分化[12-13],本研究也观察到类似的机制。通过PT-PCR检测,发现钙化培养基培养大鼠血管外膜细胞15 d后,BMP2和Runx2的mRNA表达水平升高。本研究通过对钙盐沉积与成骨样细胞表型转变2个维度的探讨,证明血管外膜细胞可在体外被诱导钙化,丰富了血管钙化的分型。
血管钙化的发生机制复杂,涉及多种信号通路,如细胞自噬和凋亡、Wnt/β-catenin信号通路激活、内质网应激等均参与调控血管钙化的过程。自噬作为一种细胞应激的适应性反应,在维持血管结构与功能中十分关键。研究表明,血管钙化过程中自噬水平增高[14-15]。在体外实验中,高磷可提高大鼠血管中膜细胞的自噬水平,增加细胞内自噬体数量,从而抑制凋亡与钙化[16]。还有研究表明,自噬可通过抑制大鼠血管中膜细胞氧化应激,抑制血管内皮细胞的炎症反应,对三酰甘油等脂代谢进行调控,从而减轻血管钙化[17-18]。LC3和Beclin1是2种典型的自噬标志物,Western Blot 实验结果表明,用钙化培养基诱导大鼠血管外膜细胞15 d, LC3-Ⅱ/LC3-Ⅰ比率升高, Beclin1蛋白水平表达升高,说明细胞内自噬水平升高。
多项研究表明,细胞凋亡参与促进血管钙化的发生,抑制细胞凋亡和抑制钙化[16 -17]。在对大鼠的体内研究发现,成纤维细胞生长因子21通过内质网应激调控Caspase-12 信号通路来减少血管内中膜细胞凋亡,从而抑制血管钙化[18]。另外,提高培养基中的Pi或Ca2+浓度,可诱导细胞质膜形成并释放基质囊泡(如凋亡小体),从而导致细胞外基质钙化,这种基质钙化可能成为血管钙化的成核位点[19]。Bax和Bcl-2是2种典型的凋亡和抑制凋亡蛋白,本实验结果证明,利用钙化培养基对血管外膜细胞诱导钙化过程中,细胞内凋亡水平升高。同时细胞内自噬水平也升高,这可能是细胞自我调控以对抗钙化的结果。
本研究证实血管外膜细胞可在体外被诱导钙化,且外膜钙化过程与骨组织钙化过程类似,为主动可调控的过程。血管钙化是一个复杂的过程,涉及细胞凋亡和自噬等调控通路,仍需进一步研究。
