脓毒症诱导大鼠延髓内脏带胆碱能神经元凋亡及其对系统性炎症和行为学的影响
2023-10-13李红兵
黄 伟,李红兵,张 程
脓毒症诱导的失控系统性炎症与高死亡率密切相关[1],对脓毒症诱导的系统性炎症进行神经调控是近年的研究热点。既往研究证实延髓内脏带(medullary visceral zone,MVZ)参与应激反应,是重要的自主神经及免疫调节的整合中枢[2]。MVZ通过胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)释放乙酰胆碱,作用于免疫细胞的α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR),从而抑制系统性炎症与免疫[3-4];GTS-21作为α7nAchRs特异性激动剂,可显著抑制脓毒症导致的系统性炎症,同样,MLA作为α7nAchRs特异性拮抗剂,可增强系统性炎症反应,表明干预CAP对系统性炎症具有明显影响。已知脓毒症能诱导MVZ等区域的神经炎症并导致神经功能的异常[5-7]。另一方面,脓毒症诱导的脑损伤可导致血脑屏障的破坏[8],促进GTS-21和MLA通过血脑屏障进入中枢。中枢神经元及小胶质细胞均能表达α7nAChRs[9],且激活小胶质细胞上的α7nAChRs能抑制中枢炎症[10],干预CAP 对MVZ神经病理及神经功能的影响目前尚不清楚。此外,脓毒症病人往往表现为精神萎靡、情绪低落、活动减少、呼吸异常等病态行为,与部分中枢的神经炎症相关[11]。已知MVZ通过杏仁核及前脑等高级中枢参与调控脓毒症病人的情绪与行为[12],抑制神经炎症是治疗脓毒症抑郁症的重要的策略[13]。干预CAP对脓毒症病态行为的影响及其机制,需要进一步的探索。
1 材料与方法
1.1 实验动物
无特定病原体(specific pathogen free,SPF)级Sprague Dawley(SD)大鼠64只,周龄6周,许可证号:SYXK(鄂)2018-0104;购自三峡大学实验动物中心[出售许可证号:SCXK(鄂)2017-0012]。大鼠实验干预严格按照实验动物关爱和使用协定指南(IACUC)执行,并经过贵阳市第一人民医院医学伦理委员会批准(审批号:2019007)。
1.2 主要试剂
GTS-21,货号:29834(dihydrochloride MCE);甲基牛扁亭(methyllycaconitine,MLA),货号:HY-N2332A/CS-0021211 (MCE);荧光(FITC)标记羊抗兔IgG,武汉博斯特,货号:BA1105;荧光(Cy3)标记羊抗小鼠IgG,武汉博斯特,货号:BA1031;DAPI,武汉三鹰,货号:C1002; CHAT,武汉博斯特,货号:bs-2423R;TH,武汉博斯特,批号:BM4568;Caspase-3,武汉三鹰,货号:66470-2-IG。
1.3 主要仪器
脱水机,型号:武汉俊杰JT-12J电脑生物组织脱水机;病理切片机,型号:德国Leica RM 2016轮转式切片机;抗原修复用电陶炉,型号:SKG;显微镜,型号:奥林巴斯BX53型生物显微镜。
1.4 研究方法
1.4.1 动物及分组、处理方法
大鼠适应性喂养7 d后按照随机数字表分为3组,并进行相应的干预。对照组8只:正常饲养,不做任何处理。假手术组8只:大鼠剖腹但不进行盲肠穿刺结扎法(cecum ligation and puncture,CLP)进行脓毒症制备[14],并予哌拉西林(50 mg/kg)腹腔注射,每日3次,连续3 d。脓毒症组48只,采用CLP制备脓毒症模型,成功后随机再分为3组,每组16只,哌拉西林使用同假手术组;模型组给予生理盐水(1 mL/100 g)腹腔注射,每日3次,连续3d;GTS-21组以GTS-21(4 mg/kg[15])腹腔注射,每日1次,连续3 d进行干预;MLA组以MLA(4.8 mg/kg)[16-17]腹腔注射,每日1次,连续3 d进行干预。3 d后处死大鼠进行延髓的免疫荧光检测。
1.4.2 大鼠行为学评分
采用脓毒症严重程度评分(Murine Sepsis Score,MSS)进行评分[18],记录大鼠外观、意识水平、行为表现、对刺激的反应、睁眼反应、呼吸频率、呼吸质量等分值。由3名实验人员进行单独评分,取平均值评价各组大鼠在造模后1、2、3 d的病情严重程度。
1.4.3 免疫荧光双标检测
采用灌注取脑的方式,制备大鼠延髓中尾段的石蜡包埋切片,分别用于标记 Caspase-3及胆碱乙酰转移酶(choline acetyltransferase,CHAT)的一抗混合物中孵育24 h,然后将切片与荧光标记的二抗(Cy3,FITC标记的山羊抗兔IgG)中孵育4 h,最后将切片用带有 DAPI 媒介对切片中所有细胞进行核染色,使用奥林巴斯 BX53 生物显微镜拍摄,用Image pro(ipp6.0)软件分析每组3幅图像,计算平均光密度。
1.5 统计学处理
2 结 果
2.1 各组大鼠MSS评分比较
对照组MSS评分为0,脓毒症模型组、GTS-21组及MLA组评分高于对照组,且MLA组评分高于GTS-21组(P<0.05),GTS-21组在第1天第2天评分低于模型组;同组大鼠评分差异无统计学意义。详见图1。
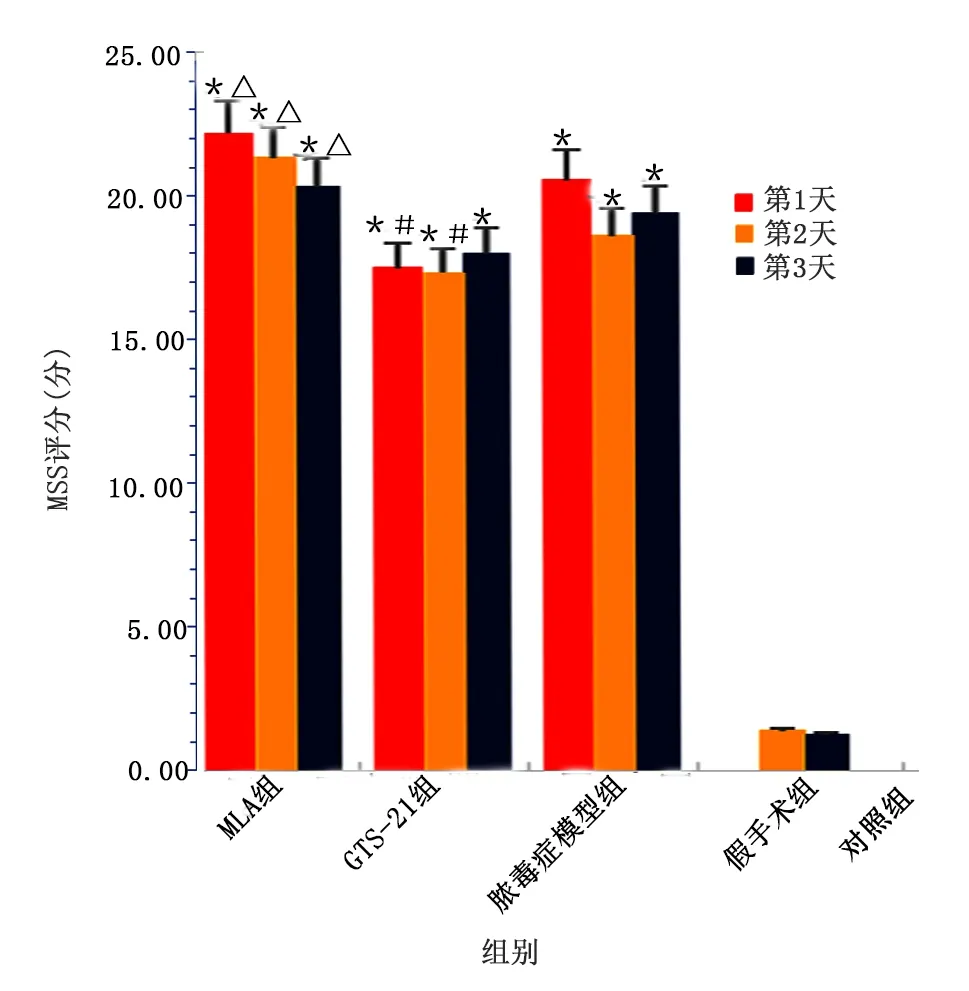
图1 各组大鼠MSS评分比较
2.2 各组大鼠行为学分类评分比较
分类评分中,脓毒症各组外观、意识水平、行为表现、对刺激反应、睁眼反应、呼吸频率、呼吸质量评分均高于对照组和假手术组(P<0.05),3组间分类评分差异无统计学意义(P>0.05)。详见图2。
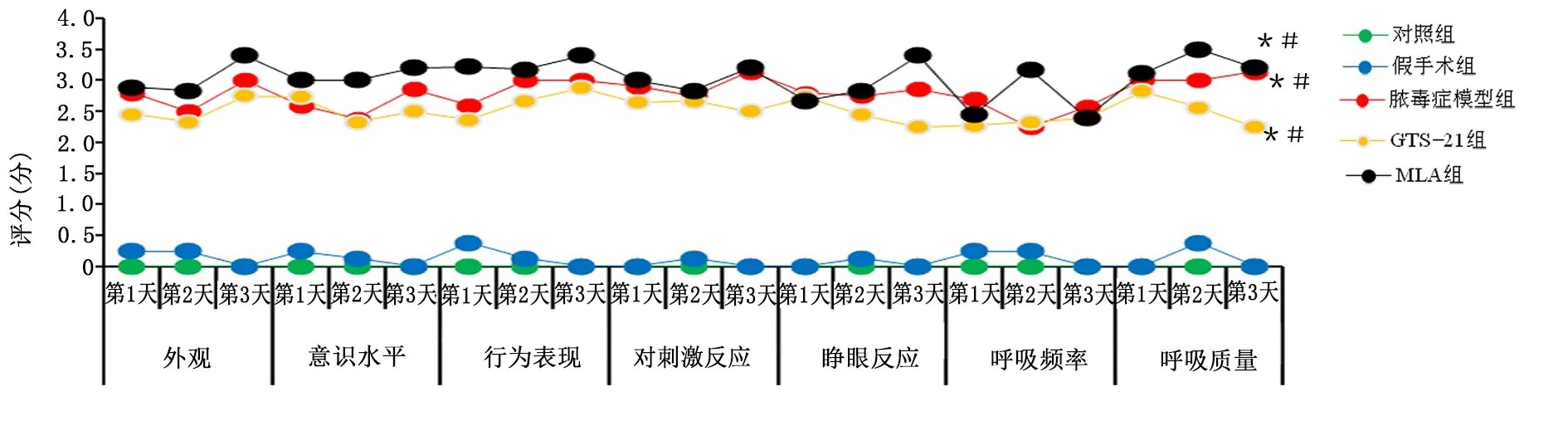
图2 各组大鼠MSS分类评分散点图(与对照组同时间比较,* P<0.05;与假手术组同时间比较,#P<0.05)
2.3 延髓中尾段胆碱能神经元的分布
免疫荧光可以看出胆碱能神经元主要集中在孤束核(solitary nucleus,NTS)、迷走神经背侧运动核(dorsal vagus motor nucleus,DVMN)和腹外侧网状核(rostral ventrolateral medulla,RVLM)。详见图3。
2.4 各组大鼠MVZ中CHAT/Caspase-3免疫荧光双标表达情况
与对照组比较,脓毒症各组CHAT表达有降低的趋势,与MLA组比较,GTS-21组有升高CHAT表达的趋势;脓毒症各组Caspase-3表达升高。提示炎症可使胆碱能神经元凋亡,但对CHAT表达无明显影响,恶化的炎症可导致CHAT表达降低。详见图4。各组CHAT/Caspase-3 表达比较见图5。
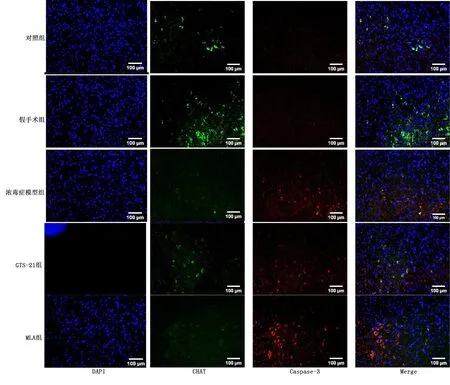
图4 各组代表性的荧光双标图像及融合图(200倍)
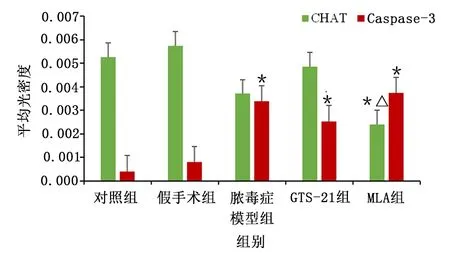
图5 各组CHAT/Caspase-3 表达比较的柱状图
3 讨 论
系统性炎症及免疫的紊乱与异常行为学之间具有复杂的交互关系,如抑郁症病人可表现出不同特征的免疫表型,抗抑郁药具有抗炎作用,而抗炎药物也显示出抗抑郁作用[19]。此外,研究证实:系统性炎症除导致血清细胞因子升高外,还导致延髓背侧炎症标志物升高,提示延髓胶质细胞的激活,并与较高的MSS评分有关[20-21]。表明脓毒症诱发的炎症风暴影响了大鼠行为学,MSS评分的升高可能与MVZ神经炎症具有密切的关系。
MVZ中胆碱能神经元主要位于孤束核及迷走背侧运动核,分别是迷走神经的传入和传出的初级中枢,感受并调节系统性炎症强度。研究证实:外周迷走神经的刺激能抑制神经炎症,促进神经功能的恢复[22]。经皮迷走神经刺激有效降低脂多糖诱导的血清TNF-α水平,同时促进MVZ的重要核团如孤束核和迷走神经背侧运动核中CHAT表达,阻碍小胶质细胞的激活,改善认知功能[23],表明CAP的激活除可抑制系统性炎症外,还可通过改善MVZ的病理和功能而增强认知功能。
脓毒症可导致中枢促炎细胞因子的升高及小胶质细胞的激活[24],通过激活线粒体凋亡途径,导致Caspase-3 表达增高和功能神经元的凋亡[25-26];研究证实:激活α7nAChRs可减少促炎性M1表型的小胶质细胞数量,增加抗炎M2表型的细胞数量[27]、减轻神经元的凋亡和脑组织损伤[28]。本研究中,模型组大鼠MVZ的胆碱能神经元明显凋亡,但CHAT表达并未明显减少,表明胆碱能神经元与神经环路具有一定的补偿机制[29-30],从而在脓毒症中维持对炎症的稳定调节。GTS-21通过激活中枢α7nAChRs而抑制了神经炎症,减少了胆碱能神经元的凋亡;MLA则相反。上述研究表明,脓毒症导致MVZ胆碱能神经元凋亡,功能水平低下,并进一步导致 CAP对系统性炎症的负向调控作用减弱,可能是系统性炎症失控的中枢机制,干预CAP对MVZ神经炎症和系统性炎症具有重要的影响。
神经炎症对行为学具有显著影响[31]。脓毒症呼吸功能损坏与延髓的早期炎症反应有关,与脂多糖的浓度和损害时长具有一定的关系[32],无菌性炎症诱导的叹息样呼吸与孤束核的星形胶质细胞的激活与IL-1表达增加有关[33]。作为低位中枢的MVZ神经炎症对高级行为学的影响,可能在于:1)中枢胆碱能系统和杏仁核对于动机和记忆等行为具有重要的调节作用,脑干内胆碱能神经元的激活可导致中央外侧杏仁核活动的短暂增加,从而调整情绪记忆等相关行为[34]。2)MVZ儿茶酚胺能神经元能将炎症信息传递给中央杏仁核,神经炎症可诱导基底外侧杏仁核投射神经元的突触和非突触传递的失调,从而导致焦虑和抑郁样行为[35],杏仁核的功能改变可能与脓毒症诱导的大鼠情绪低下、恐惧、躁动、反应迟钝等有关。3)MVZ神经元也投射到基底前脑,基底前脑胆碱能系统广泛地投射到整个皮层,调节皮层功能、行为唤醒和注意力[36-37]。这些神经元可划分为爆发性放电胆碱能神经元和常态化放电的胆碱能神经元,前者与激励和惩罚机制相关,后者与行为后果相关,两种基底前脑胆碱能神经元类型的差异化募集会产生行为特异性的皮质激活[38],从而导致不同的高级智能行为反应。可见,MVZ的功能和结构的改变,势必通过杏仁核、基底前脑-前脑等神经投射从而影响意识状态及行为反应等高级神经功能。
前脑M1型胆碱能神经元也可激活MVZ的胆碱能神经元,通过CAP进一步抑制系统性炎症[39]。因此,MVZ的炎症及胆碱能神经元的凋亡,通过MVZ-基底前脑-前脑-MVZ等神经环路的影响,将进一步加剧系统性炎症风暴,与脓毒症早期失控的炎症有关,因此,阻断MVZ的神经炎症,恢复MVZ胆碱能神经元对系统性炎症调控功能和向杏仁核,基底前脑等投射功能的正常,及时打断炎症的初级中枢和高级调控的异常环路调节,对于控制系统性炎症风暴和异常行为学具有重要的理论意义。
MVZ是CAP的调控中心,其胆碱能神经元在调控系统性炎症中具有重要作用;同时,MVZ通过杏仁核、基底前脑-前脑的胆碱能系统调控脓毒症的行为学反应,是脓毒症病态行为发生的重要机制之一;通过CAP的干预来调控MVZ神经炎症可能成为控制系统性炎症风暴、恢复脓毒症异常行为学表现的重要靶点。
