MAO-A通过激活ROS/JNK通路加重心肌细胞脂质沉积
2023-10-12代地林包明威
代地林 吴 园 包明威
肥胖是影响心肌肥大和心力衰竭的独立危险因素,减重可以逆转部分心脏重构。2016年WHO报道,全球有超过19亿成年人(≥18岁)超重,超过6.5亿人肥胖[1]。预计到2030年,将有21.6亿人超重,11.2亿人肥胖[2]。研究显示,交感神经系统过度激活是肥胖的早期改变,表现为全身去甲肾上腺素(norepinephrine,NE)溢出增加以及心率变异性降低[3]。除了交感神经系统的表现外,肥胖还表现为血脂异常、胰岛素抵抗、脂肪积累等病理生理改变,这些改变是促进心血管疾病发生的危险因素[4]。
单胺氧化酶A(monoamine oxidase A,MAO-A)是一种定位于线粒体外膜的酶,它通过分解代谢NE等神经胺产生活性氧簇(reactive oxygen species,ROS)[5]。大量的ROS生成和随后的氧化应激可能通过靶向线粒体功能来影响心肌细胞的存活和功能,从而促进心血管疾病的发生与发展[6, 7]。虽然MAO-A发挥作用的具体机制尚不清楚,但在几种模型的心脏中,已发现MAO-A水平增加对心脏功能有损害作用[7, 8]。基于MAO-A对神经胺的降解作用,MAO-A抑制剂在临床上已用于抑郁症患者的治疗以及作为治疗压力负荷性心力衰竭等心脏病的工具药而被广泛研究[9~11]。本研究旨在探讨MAO-A对高脂环境培养的心肌细胞脂质沉积的影响及其机制。
材料与方法
1.实验仪器与试剂:微量分光光度计(中国杭州奥盛仪器有限公司)、DG-3022A酶标仪(美国ThermoFisher公司)、实时荧光定量PCR仪(美国ABI公司)、光学正置显微镜(日本Olympus公司)。3T3-L1前脂肪细胞购自中国拜意尔生物技术有限公司,Ⅱ型胶原酶购自德国Biofroxx公司,胰酶、胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,DMEM培养基购自美国HyClone公司,100U/ml青霉素-链霉素(PS)购自美国Genom公司,溴脱氧尿苷(Brdu)、过氧化氢(hydrogen peroxide,H2O2)、油红O染液、Mayer苏木精、胰岛素(10μg/ml)、地塞米松(0.25μmol/L)和3-异丁基-1-的诱导剂Ⅰ甲基黄嘌呤 (IBMX, 0.5mmol/L)购自美国Sigma公司,Transwell 小室(孔径为 0.4μm)购自美国Corning公司,DAPI购自上海碧云天生物技术有限公司,Fluoromount-G®封片液购自美国southernbiotech公司,棕榈酸(palmitic acid,PA)购自西安鲲创科技有限公司,NE、氯吉兰(clogyline,CLG)购自美国MCE公司,Trizol试剂购自英国Ambion公司,甲醛、60%异丙醇购自国药集团化学试剂有限公司,α-横纹肌肌动蛋白(α-sarcomeric actin,α-SCA)购自北京博奥森生物技术有限公司,JNK购自武汉三鹰生物技术有限公司,p-JNK购自美国Cell Signaling Technology公司。
2.心肌细胞的分离与培养:40只出生1~3天的SD大鼠由武汉大学动物实验中心提供。将整个心脏无菌取出后,用预冷的PBS洗涤液清洗数次,除去残留的血液和多余的组织。将心脏组织剪成约1cm3的组织碎块并转移至含有Ⅱ型胶原酶和0.25%胰酶的消化液中,在37℃的水浴锅中消化5min,收取上清于装有等体积含有10%胎牛血清的终止液中终止消化。反复重复以上消化步骤,直至心脏组织消化完全。收取的上清11000×g离心10min,弃上清,加入等体积含有10%胎牛血清的培养液,吹打混匀,用0.22μm的细胞滤器过滤后均匀地种在培养皿中,放于37℃、5% CO2的培养箱中差速贴壁1.5h。吸取上清于离心管中,11000×g离心5min,弃上清。用含有10%胎牛血清的培养液悬浮细胞、计数、均匀地种在6孔板和装有爬片的12孔板中。避光环境下加入Brdu溶液(终浓度为0.1mmol/L)抑制非肌细胞的生长。将孔板置于37℃、5% CO2的培养箱中培养,根据细胞的生长情况定期更换培养液。所有实验方案均经武汉大学人民医院医学伦理学委员会批准(伦理学审批号:WDRM 20210814)。
3.心肌细胞鉴定及细胞面积测定:细胞爬片经4%甲醛固定、0.5% Triton X-100室温通透、山羊血清封闭后,加入α-SCA(1∶100)一抗稀释液并放入湿盒,4℃孵育过夜。弃去一抗稀释液,加入Cy3标记的羊抗兔二抗稀释液,39℃孵育1h。滴加DAPI避光孵育5min,对标本进行染核,PBS清洗多余的DAPI,用吸水纸吸干爬片上的液体,用Fluoromount-G®封片液封片,镜下观察心肌细胞形态并采集图像。自加入二抗开始,所有操作于暗室进行。使用Image-Pro Plus软件分析平均心肌细胞面积。
4.NRCM/3T3-L1共培养体系的建立、细胞处理与分组:将3T3-L1前脂肪细胞种植在Transwell小室中诱导成熟,诱导方法如文献[12]所述。简单来说,将 3T3-L1 前脂肪细胞接种在Transwell小室的上室,密度为5×105个细胞/平方厘米,并在含有添加10% FBS 和1% PS的基础培养基中培养。48h后,将基础培养基更换为含有DMEM、10% FBS、1% PS、胰岛素(10μg/ml)、地塞米松(0.25μmol/L)和IBMX(0.5mmol/L)的诱导剂Ⅰ。48h后,将诱导剂Ⅰ更换为含有DMEM、10% FBS、1% PS和胰岛素(10μg/ml)的诱导剂Ⅱ。48h后,再次将诱导剂Ⅱ换成基础培养基,每2天更换1次基础培养基。3T3-L1前脂肪细胞诱导成熟(3T3-L1脂肪细胞)后,将Transwell小室移至种有心肌细胞的孔板上,并加入含有PA(400μmol/L)的培养液孵育18h构建NRCM/3T3-L1共培养体系。接下来,在共培养体系中分别加入含有NE(1μmol/L)、H2O2(200μmol/L)和CLG(MAO-A特异性抑制剂,1μmol/L)的培养液孵育,将细胞分为对照组(心肌细胞单独培养)、PA组(心肌细胞与3T3-L1脂肪细胞共培养,并加入PA)、NE组(心肌细胞与3T3-L1脂肪细胞共培养,并加入PA、NE)、H2O2组(心肌细胞与3T3-L1脂肪细胞共培养,并加入PA、H2O2)、NE+CLG组(心肌细胞与3T3-L1脂肪细胞共培养,并加入PA、NE、CLG)、CLG组(心肌细胞与3T3-L1脂肪细胞共培养,并加入PA、CLG),48h后收取心肌细胞进行后续的检测。药物作用浓度和时间的选择基于既往研究[13~16]。
5.实时荧光定量PCR(real-time quantitative PCR,RT-qPCR):取心肌细胞,加入Trizol试剂提取RNA。用微量分光光度计测定A260、A280以及A260/A280,计算RNA的纯度和浓度。根据测得的浓度取适量RNA进行反转录获得cDNA。将cDNA于50℃ 2min,95℃ 10min;95℃ 30s,60℃ 30s,40个循环的反应参数下进行实时RT-qPCR检测。绘制溶解曲线,获得的测定数据以2-△△Ct进行分析。使用GAPDH作为内参基因对目的基因的表达量进行校正。心房利钠肽(atrial natriuretic peptide,ANP)上游引物: 5′-GCCGGTAGAAGATGAGGTCA-3′, 下游引物: 5′-GCAGATCTATCGGAGGGGTC-3′。
6.心肌细胞内ROS水平测定:细胞爬片经DHE染料染色、4%甲醛固定后,在细胞爬片上滴加hoechst33342染液,室温孵育5min。吸水纸吸去爬片上多余的液体,用含抗荧光淬灭剂的封片液封片后,镜下观察心肌细胞荧光染色情况并采集图像。以上操作均在暗室中进行。使用Image-Pro Plus软件分析心肌细胞DHE染色的荧光强度。
7.油红O染色:细胞爬片经4%甲醛固定、60%异丙醇浸洗后,用油红O染液染色10min。再用60%异丙醇分色至背景无色后,使用Mayer苏木精复染、PBS浸洗蓝化、蒸馏水洗后,使用Fluoromount-G®封片液封片。镜下观察心肌细胞脂滴染色情况并采集图像。使用Image-Pro Plus软件分析心肌细胞内脂滴含量。
8.Western blot法检测:取心肌细胞,经漂洗、裂解、离心后,收集细胞蛋白。取适量蛋白上清稀释,使用DG-3022A酶标仪测定A568,计算样品蛋白浓度。配制分离胶和浓缩胶,制备好的蛋白样品经电泳、转膜、封闭后,加入一抗稀释液,4℃孵育过夜。洗去多余的一抗,用二抗稀释液室温孵育2h。洗去多余的二抗,增强化学发光显影。条带灰度值用Image-Pro Plus软件测量。将目的条带与内参GAPDH的比值作为半定量指标。

结 果
1.原代心肌细胞的鉴定:免疫荧光染色显示,大于95%的细胞为心肌细胞(图1)。
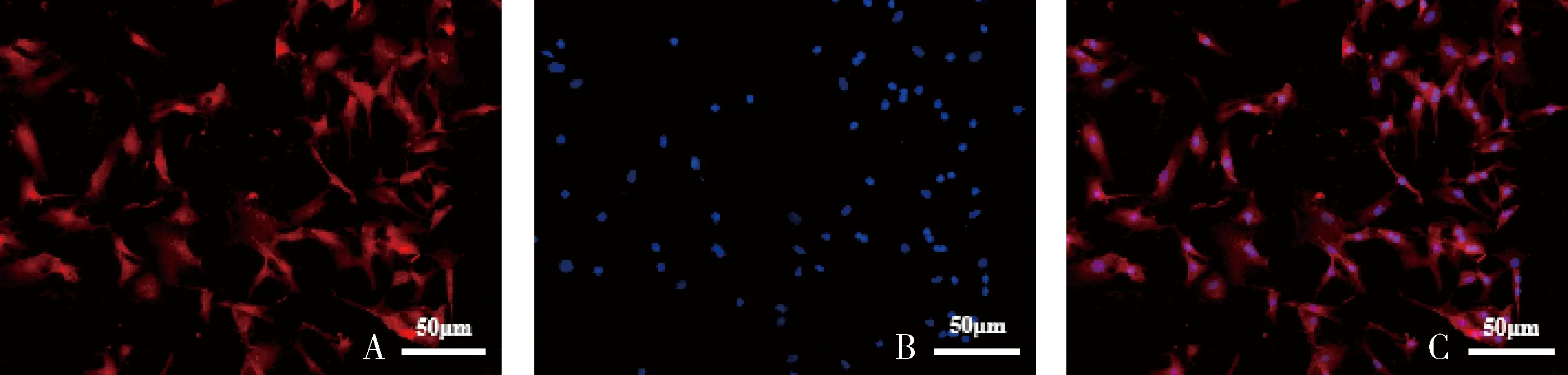
图1 原代心肌细胞鉴定(免疫荧光染色)A.α-SCA;B.DAPI;C.Merge。红色代表原代心肌细胞胞质,蓝色代表细胞核
2.3T3-L1共培养体系加PA刺激能诱导心肌细胞肥大表型:与对照组比较,PA组中的心肌细胞面积(14.681±0.481μm2vs 19.932±0.220μm2,P<0.01)明显增大,且心肌细胞肥大标志物ANP的相对mRNA水平(1.006±0.017 vs 1.914±0.152,P<0.01)也明显增加,说明3T3-L1共培养体系加PA能诱导心肌细胞肥大表型(图2)。

图2 3T3-L1共培养体系加PA能诱导心肌细胞肥大表型A.-SCA染色的荧光显微照片。红色代表α-SCA染色的原代心肌细胞胞质,蓝色代表细胞核;B.α-SCA染色观察心肌细胞面积变化的半定量统计结果;C.心肌细胞肥大标志物ANP的相对mRNA水平
3.氯吉兰抑制心肌细胞内单胺氧化酶A的蛋白水平:与对照组比较,PA组心肌细胞内MAO-A相对蛋白水平(0.117±0.022 vs 0.430±0.092,P<0.01)增加;与PA组比较,NE明显增加心肌细胞中MAO-A的相对蛋白水平(0.430±0.092 vs 1.114±0.091,P<0.01),CLG降低心肌细胞中MAO-A相对蛋白水平(0.430±0.092 vs 0.251±0.054,P<0.05);与NE组比较,NE+CLG组的MAO-A相对蛋白水平明显降低(1.114±0.091 vs 0.599±0.062,P<0.01,图3)。

图3 氯吉兰抑制单胺氧化酶A的蛋白水平A.MAO-A的Western blot法条带图;B.MAO-A相对蛋白水平的定量分析。*P<0.05,**P<0.01
4.抑制MAO-A降低心肌细胞内ROS水平:与对照组比较,PA组心肌细胞内ROS水平(0.001±0.001 vs 0.004±0.002,P<0.01)增加;与PA组比较,NE明显增加心肌细胞内ROS水平(0.004±0.002 vs 0.013±0.001,P<0.01);与NE组比较,NE+CLG组心肌细胞内ROS水平(0.013±0.001 vs 0.006±0.001,P<0.01)明显降低,说明抑制MAO-A的相对蛋白水平可减少心肌细胞内的氧化应激(图4)。
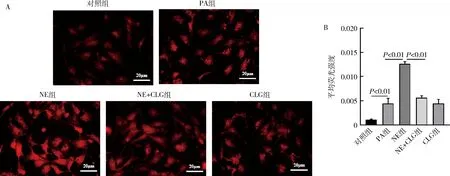
图4 抑制MAO-A对心肌细胞内ROS的影响A.原代心肌细胞DHE免疫荧光染色代表图。红色代表DHE荧光;B.DHE免疫荧光染色观察心肌细胞内ROS水平的半定量统计结果
5.抑制MAO-A改善心肌细胞内脂质沉积:与对照组比较,PA组心肌细胞的脂滴面积比(0.001±0.001 vs 0.054±0.002,P<0.01)增加;与PA组比较,NE和H2O2均明显增加心肌细胞的脂滴面积比(0.054±0.002 vs 0.106±0.005,P<0.05;0.054±0.002 vs 0.092±0.002,P<0.01);与NE组比较,NE+CLG组心肌细胞的脂滴面积比(0.106±0.005 vs 0.072±0.001,P<0.01)明显减少,说明抑制MAO-A的相对蛋白水平可部分减少心肌细胞内的脂质沉积(图5)。

图5 抑制MAO-A对心肌细胞内脂滴含量的影响A.原代心肌细胞油红O染色代表图。红色代表脂滴,紫色代表细胞核;B.油红O染色观察心肌细胞内脂滴含量的半定量统计结果。*P<0.05,**P<0.01
6.抑制MAO-A降低心肌细胞内JNK信号通路蛋白的磷酸化水平:Western blot法检测结果显示,各组心肌细胞内JNK总蛋白水平比较,差异无统计学意义;与对照组比较,PA组心肌细胞内p-JNK的相对蛋白水平(0.032±0.007 vs 0.263±0.119,P<0.05)增加;与PA组比较,NE和H2O2明显增加心肌细胞内p-JNK的相对蛋白水平(0.263±0.119 vs 0.969±0.082,P<0.05; 0.263±0.119 vs 0.640±0.101,P<0.05),CLG可明显降低NE引起的异常改变,说明抑制MAO-A可以下调JNK信号通路(图6)。

图6 抑制MAO-A对心肌细胞内JNK信号通路的影响A.JNK、p-JNK的Western blot法条带图;B.JNK、p-JNK相对蛋白水平的定量分析。*P<0.05,**P<0.01
讨 论
肥胖导致全身交感神经过度激活和许多代谢性病理变化,如血脂异常、胰岛素抵抗、脂肪细胞的增殖和肥大等[3,4,17]。本研究使用3T3-L1脂肪细胞与原代心肌细胞在含有PA的培养基中共培养来模拟肥胖大鼠心肌细胞脂肪浸润的内环境。通过在共培养体系中加入NE和H2O2来探索MAO-A对高脂培养的心肌细胞内脂质沉积的影响及机制。NE和H2O2分别用于模拟肥胖大鼠交感过度激活及氧化应激的状态。众所周知,MAO-A可通过降解底物去甲肾上腺素、血清素等神经胺产生ROS[6,7]。MAO-A驱动的H2O2产生已被证实会引起不同类型的细胞反应,如肥大和死亡等[7,18]。近年来,MAO-A介导的氧化应激在心血管疾病中的作用逐渐成为研究热点[19,20]。
本研究评估了MAO-A是否可以被外源性MAO-A底物NE激活及其对心肌细胞的影响。在共培养体系中,笔者使用NE和CLG处理细胞,发现NE处理细胞不仅增加了心肌细胞内MAO-A的相对蛋白水平,还增加了心肌细胞内ROS水平和脂滴含量,这些变化可被CLG抑制。另外,笔者发现,CLG组心肌细胞内ROS水平与PA组比较差异无统计学意义,说明MAO-A以依赖NE的方式引起心肌细胞内的氧化应激。这与Manzella等[20]的研究一致,即用NE处理H9c2细胞会增加MAO-A介导的氧化应激水平。
为了评估MAO-A诱导的氧化应激是否增加JNK信号通路蛋白的磷酸化以及脂质沉积,笔者在NRCM/3T3-L1共培养体系中用H2O2孵育来诱导心肌细胞氧化应激损伤。结果显示,与PA组比较,H2O2组的心肌细胞中JNK的磷酸化水平和脂质沉积明显增加。Imam等[18]研究也显示,使用H2O2处理的心肌细胞表现出JNK磷酸化增加,这与本研究结果一致。以上结果说明,MAO-A引起的氧化应激是引起心肌细胞内脂质沉积的一个重要原因。JNK是一种应激活化蛋白激酶,属于有丝分裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)超家族,可由肥胖和过量饮食糖激活,从而介导炎症、异常脂质沉积和胰岛素抵抗[21,22]。本研究中虽然没有评估JNK信号通路在脂质沉积中的作用,但前期有大量研究表明,使用JNK抑制剂或siRNA介导的JNK敲低均可明显改善心肌细胞中脂质沉积[23,24]。
综上所述,MAO-A相对蛋白水平增加是导致高脂培养的心肌细胞内ROS水平、以及JNK磷酸化水平和脂质沉积增加的重要原因,其机制可能与ROS/JNK信号级联反应激活有关。本研究为肥胖相关心脏损害的体内研究和临床研究提供了新的干预靶点。
