NtJAZ1基因敲除对烤烟Y2001烟碱合成和腺毛发育的影响
2023-10-12侯子航朱文奇季盈彤时兴铭闫筱筱
侯子航,罗 锐,朱文奇,季盈彤,时兴铭,闫筱筱,崔 红
河南农业大学烟草学院,郑州市郑东新区平安大道218 号 450046
烟碱占烟草生物碱含量的90%~95%[1],其在烟株中的作用主要是调节烟叶品质和抵御害虫侵食[2-3]。烟草植株表面覆盖着大量表皮毛,其分泌物主要成分为西柏烷类二萜和蔗糖酯化合物,这些成分不仅是重要的香气前体物质,而且对蚜虫具有明显的趋避作用[4-6]。因此,提高烟叶烟碱含量及叶面化学成分含量对改善烟叶品质和增强蚜虫抗性具有重要意义。茉莉酸(Jasmonate acid,JA)是调控植物生长发育、应答多种胁迫反应的重要信号分子[7],茉莉酸ZIM 结构域(Jasmonate zim domain,JAZ)蛋白是JA信号途径中关键的转录抑制因子[8],可以响应JA 的刺激,在SCFCOI1 复合物作用下被26S 蛋白酶体降解,释放结合的MYC2 转录因子,从而启动JA 应答基因的转录[9-10]。在野生烟草中,JAZ沉默株系上调JA 响应基因,可增强对烟草天蛾的抗性[11]。拟南芥JAZ1基因在低温条件下能激活植株的次生代谢,提高植株的耐寒性,维持植株正常的生长发育和物质代谢[12-13]。Zhang 等[14-15]的研究表明,NtJAZ1基因可调控烟草中烟碱的生物合成,为通过敲除NtJAZ1基因来提高烟草中烟碱含量提供了可能。郑淑心等[16]对K326 品种NtJAZ1基因进行编辑,发现NtJAZ1基因敲除后烟株烟碱含量显著提高,但叶面腺毛密度及叶面化学成分含量有所降低。说明NtJAZ1的功能缺失可促进烟碱生物合成,同时对腺毛发生也有一定影响。Y2001 作为高分泌型突变品系,具有产量高、生育期短、易烘烤的特点,且长柄腺毛密度及分泌物含量也较高[17],在豫中烟区颇受青睐。为进一步提高Y2001 的品质和抗性,彰显其浓香型风格特色,利用基因编辑技术对Y2001 中的烟碱负调控基因NtJAZ1进行敲除,研究了NtJAZ1敲除对烟株发育、烟碱生物合成、腺毛发育和腺毛分泌物积累以及蚜虫抗性的影响,旨在为Y2001 品系的品质改良奠定基础。
1 材料与方法
1.1 材料
供试材料为Y2001,幼苗培养于光照培养箱中,培养条件为25 ℃、相对湿度60%,光暗交替,16 h光照、8 h黑暗。
1.2 方法
1.2.1NtJAZ1基因载体构建
根据茄科基因组网站(https://solgenomics.net/)已发表的烟草NtJAZ1基因序列Nitab4.5_0000073g0270.1(NtJAZ1a)、Nitab4.5_0004234g0080.1(NtJAZ1b),利用CRISPR2 在线软件(http://crispr.hzau.edu.cn/CRISPR2/)设计靶位点序列(Targeting Sequence):5'-CCTCAAGAAGTTATTTCTACTGC-3'(253~272 bp,下划线标注为PAM 区),合成二聚体后构建NtJAZ1基因敲除载体(pCBSG012-JAZ1)(图1)。
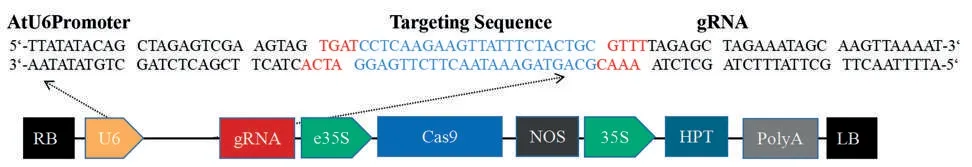
图1 NtJAZ1基因敲除载体示意图Fig.1 Diagram of NtJAZ1 knockout Vector
1.2.2 遗传转化
采用叶盘转化法[18]进行烟草遗传转化。将载体转化到大肠杆菌DH5α感受态细胞中,涂布于抗性培养基上,挑选单菌落进行菌液PCR检测,检测后提取质粒将其转化到根癌农杆菌EHA105 中,于YEB 培养基上培养至菌液OD600值为0.4~0.6时用于共培养转化。将Y2001 的无菌叶片剪成0.8 cm×0.8 cm 的小片,置于MS 培养基上进行暗培养,48 h 后将其转移至活化的含有农杆菌菌液的YEB培养基中侵染8 min,并及时吸干叶片表面残留的菌液,放置于含有潮霉素的筛选培养基(MS+Cef 0.500 00 g/L+Hyg 0.006 00 g/L + 6-BA 0.001 00 g/L + NAA 0.000 15 g/L)中,未用农杆菌侵染的叶片分别置于含有潮霉素和不含潮霉素的培养基上作为对照1和对照2,待经农杆菌侵染的叶片长出不定芽后转入生根培养基(MS+Hyg 0.008 00 g/L+NAA 0.000 10 g/L)中继续培养,待长出较为茂密的根系时移栽至室内基质土中继续培养获得转基因植株,并将其命名为HN。
1.2.3 分子鉴定
通过CTAB 法提取所得转基因植株的基因组DNA,提取的DNA 用NtJAZ1特异性引物(F1:5’-CTAGGAAAGGCTAAAAAGAAACAGT-3’;R1:5’-CTGATATGGTGCAGTTGAAGTA-3’)进行PCR 扩增。PCR 反应条件:94 ℃预变性5 min;94 ℃变性30 s,56.5 ℃退火30 s,72℃延伸30 s,35 个循环;72 ℃延伸10 min,最后4 ℃保存。PCR 产物经1%琼脂糖凝胶电泳检测后送至深圳华大基因股份有限公司进行序列测定,将测序结果与茄科基因组网站中的NtJAZ1基因序列进行比对,筛选出纯合突变单株。将测定出来的纯合突变单株进行自交并收获得到T1代烟草种子。
1.2.4 烟碱含量测定
选取六叶一心期烟苗叶片和根系进行总生物碱含量测定。将烟叶和根系放入105 ℃烘箱中烘30 min 进行杀青处理,于60 ℃烘至恒质量。烘干后用碾子研磨粉碎,过直径为0.25 mm 的过滤筛。准确称取0.2 g粉末倒入15 mL试管中,加入100 μL烟碱内标,1.5 mL10% NaOH 溶液和3 mL 甲基叔丁基醚,密封后充分振荡5 min。室温放置(24 ±2)h后,取上清溶液进行GC-FID分析。
1.2.5 烟碱合成相关基因表达量测定
利用植物总RNA 提取试剂盒(DP4332,天根生化科技有限公司)分别提取Y2001 和HN 的根系总RNA,利用反转录试剂盒(NovoScript®II Reverse Transcriptase,上海近岸科技有限公司)反转录为cDNA。根据NCBI GenBank 中的烟碱合成相关基因(NtMYC2a、NtMYC2b、NtPMT、NtQPT、NtODC和NtA622)序列,利用Primer Premier 5.0软件设计荧光定量PCR 引物,上、下游引物见表1,以NtL25(L18908)为内参基因。RT-PCR 反应程序:95 ℃预变性10 min;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环;熔解曲线:95 ℃15 s,58 ℃15 s,20 min 内升至95 ℃,95 ℃15 s。采用2-△△CT法计算相关基因的相对表达量,设置3次重复。
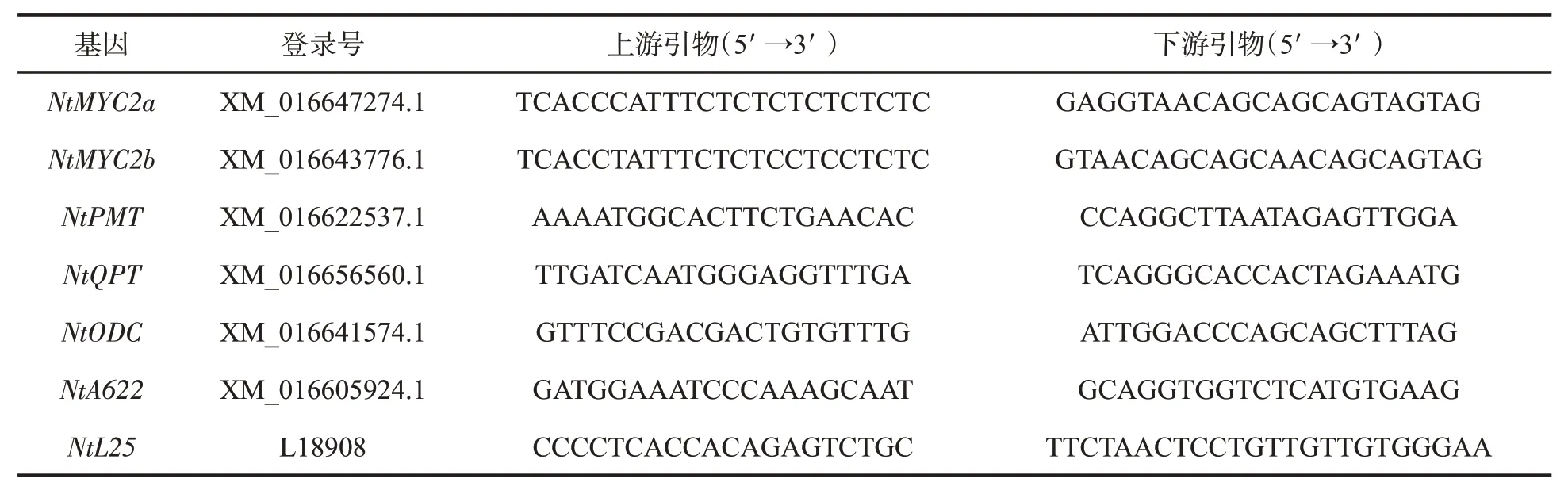
表1 引物序列Tab.1 Primer sequences used in this study
1.2.6 腺毛形态观察
于烟苗十叶一心期分别取Y2001 和HN 长度约为10 cm 的叶片用于腺毛观察,试验操作参考娄亚楠等[19]的方法,将叶片置于0.2%的罗丹明B水溶液中浸染30 min,染色结束后用蒸馏水漂洗干净,冲洗叶片表面未结合的染料。用滤纸轻轻吸干叶片表面水分后置于超景深显微镜(VHR-5000,日本基恩士公司)下进行腺毛观察,并在观察时随机选择3个视野对长柄分泌型腺毛、短柄分泌型腺毛及非分泌型表皮毛的密度进行统计。
1.2.7 叶面化学成分分析
于烟苗十叶一心期分别挑选Y2001 和HN 各5株长势良好的烟苗,用直径5 cm 打孔器打取20 个叶圆片,用二氯甲烷进行浸提。浸提时向浸提液中加入1 mL 内标(2.020 mg/mL 的蔗糖八乙酸酯和2.542 mg/mL 的正十七烷醇),然后加入10 g 左右无水硫酸钠除水,定量滤纸过滤。将过滤后的溶液进行旋转蒸发,得到浓缩液后用氮气吹干。加入500 μL[V(DMF)∶V(BSTFA)=1∶1]的溶液,于75 ℃水浴中进行衍生化反应60 min,然后加入N,O-双乙酰胺和吡啶各125 μL。得到的样品通过GC/MS 分析仪(色谱仪型号HP-5890,质谱仪型号vc-70SE,美国Agilent 公司)进行叶面化学成分的定性和定量分析,色谱参数检测参考王霄龙等[20]的方法。
1.2.8 蚜虫抗性分析
活体植株蚜虫选择试验:参考孙计平等[21]的方法并稍加修改。分别选取六叶一心期长势一致的烟苗Y2001 和HN 各3 株,均匀放置于蚜虫培养箱内,每天20∶00 时调查并记录烟苗上蚜虫的数量,连续调查7 d。
离体叶片蚜虫选择试验:采用叶碟法[22]分别选取六叶一心期长势一致的Y2001 和HN 烟苗叶片各3片,均匀放置于直径约25 cm的培养皿中。并在培养皿底部铺设一层带水的脱脂棉,以保持叶片活性。在培养皿中间放置100只饥饿2 h的蚜虫,每隔2 h 统计不同株系叶片上蚜虫的数量,计数5 次,共10 h。
1.2.9 数据处理
试验均设置3 次生物学重复,所获得的数据采用SPSS17 软件进行独立样本T检验和显著性检验,使用GraphPad Prism 8.4.3 软件进行图表绘制。
2 结果与分析
2.1 NtJAZ1基因敲除材料的创制与分子鉴定
采用农杆菌介导法,将构建好的NtJAZ1基因敲除载体转化Y2001,获得了56 株耐受潮霉素的阳性植株(图2)。提取阳性植株叶片的总DNA,利用NtJAZ1特异性引物进行PCR扩增并测序,有12株在gRNA 区域检测到序列突变,基因编辑效率为21.43%。其中有1株烟苗的NtJAZ1基因序列发生碱基纯合突变,NtJAZ1a和NtJAZ1b均在253~254 bp处插入1个A碱基,导致NtJAZ1基因功能缺失,并将其命名为HN(图3)。
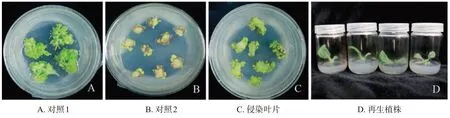
图2 NtJAZ1基因敲除载体的遗传转化Fig.2 Genetic transformation of NtJAZ1 knockout vector
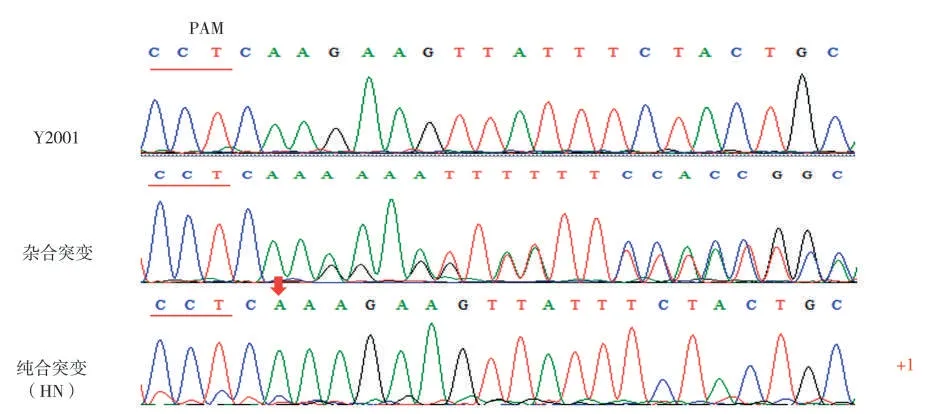
图3 Y2001和部分突变株系测序峰图Fig.3 Sequencing peak maps of Y2001 and the mutant plants
2.2 NtJAZ1基因敲除对腺毛发育的影响
对敲除植株苗期形态及腺毛发育进行观察,结果如图4A、4B 所示。从图4 中可以发现,HN 和Y2001 在苗期形态上差异并不显著,说明NtJAZ1基因敲除不会影响植株苗期的正常生长发育。与Y2001 相比,HN 腺毛密度显著降低,其中腺毛总密度降低14.92%,长柄分泌型腺毛密度降低19.46%,但长柄分泌型腺毛腺头更加饱满且着色更深。非分泌型保护毛密度略有下降但变化不显著,短柄分泌型腺毛密度基本不变。说明NtJAZ1基因敲除显著降低了植株叶面腺毛密度,尤其是长柄分泌型腺毛的密度。
2.3 NtJAZ1基因敲除对叶面化学成分的影响
分别对Y2001 和HN 进行叶面化学成分测定,结果如图5A、5B 所示。与Y2001 相比,HN 分泌物组分无明显改变,均含西柏烷类、烷烃和蔗糖酯等物质。另外,HN 分泌物总量以及各组分含量与Y2001 间差异均不显著。说明NtJAZ1基因敲除不会影响植株叶面化学成分的组分和含量。虽然NtJAZ1基因敲除降低了叶面的腺毛密度,但同时也提高了腺毛的分泌能力,导致叶面化学成分含量无显著变化。
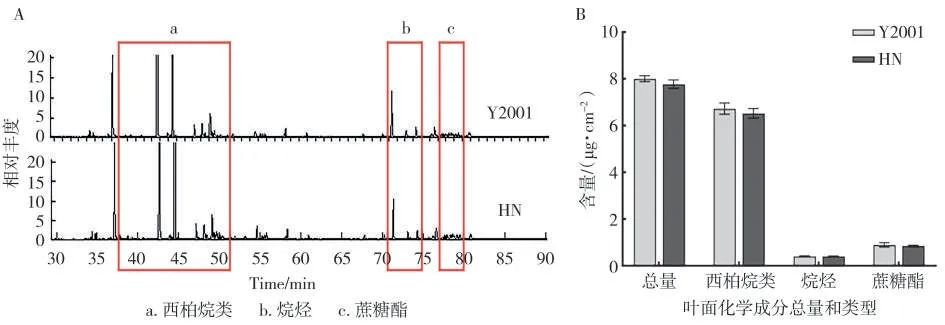
图5 Y2001和HN叶面化学成分分析Fig.5 Analysis of leaf surface chemical composition of Y2001 and HN
2.4 NtJAZ1基因敲除对烟苗生物碱合成的影响
分别选取六叶一心期的烟苗叶片与根系进行生物碱含量测量,结果如图6A 所示。与Y2001 相比,HN 叶片中生物碱总量和烟碱含量分别提高20.54%和19.38%,变化达到极显著水平,其余物质变化不显著;根系中HN 生物碱总量和烟碱含量分别提高30.94%和30.85%,变化达到极显著水平,其余物质变化不显著。说明NtJAZ1基因敲除可促进植株烟碱的合成,且在根系中表现更为明显。
根系烟碱相关合成基因表达量分析结果如图6B所示。与Y2001相比,HN中NtMYC2a、NtMYC2b、NtPMT和NtQPT的相对表达量均极显著提高,而NtODC和NtA622的相对表达量无显著变化。说明在敲除NtJAZ1基因后影响了JA 途径中烟碱合成相关基因的表达,进而影响植株烟碱的合成。
2.5 NtJAZ1基因敲除对植株蚜虫抗性的影响
活体植株蚜虫选择试验结果如图7A 和7B 所示。Y2001叶片下表面上的蚜虫密度明显高于HN,在7 d 内Y2001 叶片上的蚜虫数量极显著高于HN,第7 天时Y2001 叶片上的蚜虫数量达到最大值,HN的平均蚜虫数量比Y2001减少28.25%。
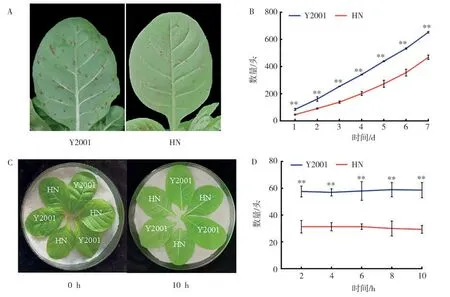
图7 Y2001和HN的蚜虫抗性分析Fig.7 Analysis of aphid resistance of Y2001 and HN
离体叶片蚜虫选择试验结果如图7C、7D 所示。在接种2、4、6、8、10 h 时,Y2001 上的蚜虫数量均极显著高于HN,HN 的平均蚜虫数量比对照减少47.19%。表明HN 在不同处理条件下蚜虫数量均极显著低于Y2001,说明NtJAZ1基因敲除后可显著提高植株对蚜虫的抗性。
3 讨论
烟草生物碱对烟叶品质和烟株抗性有重要影响[23]。通过对烤烟品种K326 中NtJAZ1基因进行编辑,创制了高烟碱K326 材料,明确了NtJAZ1基因敲除可显著提高烟株烟碱含量,虽对植株形态没有明显影响,但其腺毛密度有所下降,暗示NtJAZ1对腺毛发生具有一定影响[16]。烟草腺毛发育受茉莉酸信号的诱导[24],但NtJAZ1基因在其中的作用尚不明确。本试验中采用CRISPR/Cas9技术对Y2001中NtJAZ1基因进行敲除,经过遗传转化和分子鉴定后,获得了纯合突变株系HN。发现Y2001和HN在苗期植株表型上并无明显差异,说明NtJAZ1基因敲除不会影响植株苗期的正常生长发育,这与荆叶醒[25]对小麦TaJAZ1基因编辑后植株生长发育状况良好的结果一致。对烟草Y2001和HN幼苗的叶片和根系进行烟碱含量检测,发现叶片中HN烟碱含量提高19.38%,根系中HN烟碱含量提高30.85%。对NtJAZ1基因敲除后根系中烟碱相关基因的表达分析发现,烟碱合成相关基因NtMYC2a、NtMYC2b、NtPMT和NtQPT等的表达量均极显著增加,说明NtJAZ1基因敲除后影响了植株根系的JA信号转导途径,使JA信号下游烟碱合成基因表达量提高,从而导致HN植株中烟碱含量显著增加,且根系中烟碱含量明显高于叶片,这与胡国松等[26]的研究结果一致。
对Y2001 与HN 腺毛密度及叶面化学成分分析表明,与Y2001相比HN的总腺毛密度和长柄分泌型腺毛密度均有所降低,这与郑淑心等[16]的研究结果一致。但其腺头明显变大且染色更深,叶面化学成分组分与含量与Y2001间差异不明显。说明NtJAZ1基因敲除后会降低腺毛密度,但会使腺毛的分泌能力有所提高,导致叶面化学成分含量不受基因缺失的影响。由此推测,NtJAZ1对腺毛的物质代谢具有一定的促进作用,但其中的分子机制还有待进一步研究。
另外,在本研究中通过蚜虫接种试验发现,HN在蚜虫抗性方面明显优于Y2001。其中,活体植株蚜虫选择试验中接种蚜虫7 d 后HN 上的平均蚜虫数量比Y2001 减少28.25%,离体叶片蚜虫选择试验中HN 上的平均蚜虫数量比Y2001 减少47.19%,均达极显著水平。说明NtJAZ1基因敲除后可明显提高烟草幼苗对蚜虫的抗性,但其对田间蚜虫及其他病虫害的抗性如何还有待进一步试验验证。
4 结论
通过CRISPR/Cas9技术敲除高分泌型烤烟品种Y2001 中的NtJAZ1基因获得了纯合株系HN。对HN株系进行室内研究发现,NtJAZ1基因敲除后植株腺毛密度显著降低,分泌物含量无显著变化,说明NtJAZ1基因敲除对腺毛发生有一定的抑制作用,但显著提高了腺毛的分泌能力。同时对植株的烟碱合成能力有明显促进作用,使根系中烟碱含量显著提高,植株对蚜虫的抗性也显著增强。因此NtJAZ1基因是进行烟草品质和抗性改良的重要靶点之一。
