PRMT5及ASF1B在宫颈癌组织中的表达及临床意义*
2023-10-11李业盛谭学贤
李业盛,孙 斌,刘 皓,谭学贤△
广州医科大学附属第三医院:1.病理科;2.妇科,广东广州 510150
宫颈癌是常见的妇科恶性肿瘤,全球每年新发病例达52.9万例,死亡达27.5万例[1]。宫颈癌的治疗包括手术、放化疗等,但晚期患者目前缺乏有效治疗手段,死亡率较高[2]。蛋白精氨酸甲基转移酶5(PRMT5)属于甲基转移酶家族成员,参与催化甲基转移到精氨酸,能够甲基化修饰组蛋白、转录延伸因子和肿瘤抑制因子p53等多种靶蛋白[3]。LIU等[4]研究发现,胃癌中PRMT5作为一种促癌因子,通过抑制磷酸酶张力蛋白同源物基因的表达,促进肿瘤侵袭和转移。组蛋白伴侣抗沉默功能蛋白1B(ASF1B)属于H3/H4组蛋白伴侣家族成员,是细胞周期调节激酶的底物,参与调节染色质核小体结构,与胰腺癌等恶性肿瘤的发生发展密切相关[5-6]。本研究通过检测宫颈癌组织中PRMT5、ASF1B蛋白表达,分析二者与宫颈癌临床病理特征及预后的关系,报道如下。
1 资料与方法
1.1一般资料 选择2018年1月至2019年1月在本院就诊的96例宫颈癌患者作为研究对象。纳入标准:(1)均行宫颈癌根治手术治疗,经术后病理确诊为宫颈癌;(2)临床病理资料完整;(3)首次诊治,术前未接受放化疗等。排除标准:(1)重度肝、肾功能障碍;(2)合并其他恶性肿瘤;(3)失访或随访结局不明确;(4)术前半年有心脑血管疾病病史。96例宫颈癌患者年龄21~79岁,平均(53.27±6.31)岁;参考国际妇产科联盟(FIGO)分期标准进行肿瘤分期[7]:ⅠA~ⅠB1期66例,ⅠB2~ⅡA期30例;肿瘤最大径:<4 cm者72例,≥4 cm者24例;肿瘤浸润深度:<1/2全层77例,≥1/2全层19例;肿瘤分化程度:低分化37例,中分化33例,高分化26例;病理类型:鳞癌75例,腺癌21例;淋巴结转移23例;人乳头瘤病毒(HPV)感染阳性76例。本研究经过医院伦理委员会审核通过,所有患者及家属对本研究知情同意,并签署知情同意书。
1.2方法
1.2.1免疫组织化学(免疫组化)染色及结果判定 取宫颈癌及癌旁组织(距肿瘤组织>3 cm)样本,经常规10%中性甲醛固定,梯度脱水后,组织包埋后常规进行免疫组化染色。步骤包括:二甲苯脱蜡2次,每次10 min,梯度乙醇水化(100%、95%、70%、50%,每次5 min),柠檬酸盐抗原热修复(微波炉法,100 ℃ 10 min),3%过氧化氢阻断内源性过氧化物酶15 min,3%羊血清封闭2 h。一抗4 ℃孵育过夜(兔抗人PRMT5、ASF1B抗体购自美国Abcam公司,货号:ab151321、ab235358,稀释比例均为1∶100),辣根过氧化物酶标记的山羊抗兔二抗室温孵育2 h,DAB显色后苏木素复染,梯度乙醇脱水(50%、70%、95%、100%,每次5 min),中性树脂固定,镜下观察染色情况。结果判定:免疫组化评分为阳性细胞数评分乘以染色强度评分。阳性细胞数评分:阳性细胞比例≤5%为0分,5%<阳性比例<25%为1分,25%≤阳性比例<50%为2分,50%≤阳性比例<75%为3分,阳性比例≥75%为4分。染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。免疫组化评分[8]:0~4分为阴性,5~12分阳性。根据免疫组化评分将宫颈癌患者分为阳性表达组和阴性表达组。
1.2.2随访 所有患者出院后每6个月进行电话或门诊随访,随访内容主要包括收集患者的术后恢复情况、肿瘤复发进展及生存情况等。门诊复查项目主要包括:常规妇科检查、液基薄层细胞检测(TCT)、HPV筛查、盆腔超声检查及盆腔核磁共振检查等。随访截止时间为2022年2月1日。计算患者的无进展生存期(PFS)和总生存期(OS)。PFS定义为自宫颈癌确诊时间至术后复发或转移的时间,OS定义为自宫颈癌确诊时间到死亡的时间。
1.3统计学处理 采用SPSS22.0统计软件进行数据分析。计数资料以率或构成比表示,组间比较采用χ2检验。Spearman秩相关分析宫颈癌组织中PRMT5与ASF1B蛋白表达的相关性。生存分析采用Kaplan-Meier生存曲线,生存预后差异比较采用Log-rank检验。单因素及多因素COX比例风险回归分析影响宫颈癌患者预后的因素。以P<0.05为差异有统计学意义。
2 结 果
2.1宫颈癌组织及癌旁组织中PRMT5及ASF1B蛋白表达 免疫组化结果显示,PRMT5、ASF1B定位于细胞膜和细胞质,棕黄色染色。宫颈癌组织中PRMT5蛋白阳性率[75%(66/96)]明显高于癌旁组织[12.50%(12/96)],差异有统计学意义(χ2=7.714,P=0.005)。宫颈癌组织中ASF1B蛋白阳性率[70.83%(68/96)]明显高于癌旁组织[10.42%(10/96)],差异有统计学意义(χ2=8.526,P=0.004)。见图1。Spearman秩相关分析结果,宫颈癌组织中PRMT5与ASF1B蛋白表达呈正相关(r=0.712,P<0.001)。
2.2不同临床参数患者PRMT5及ASF1B蛋白表达比较 FIGO分期ⅠB2~ⅡA期、伴淋巴结转移患者癌组织PRMT5、ASF1B蛋白阳性率分别高于FIGO分期ⅠA~ⅠB1期、无淋巴结转移患者,差异有统计学意义(P<0.05)。不同年龄、病理类型、肿瘤最大径、肿瘤浸润深度、HPV感染和肿瘤分化程度患者癌组织PRMT5、ASF1B蛋白阳性率比较,差异均无统计学意义(P>0.05)。见表1。
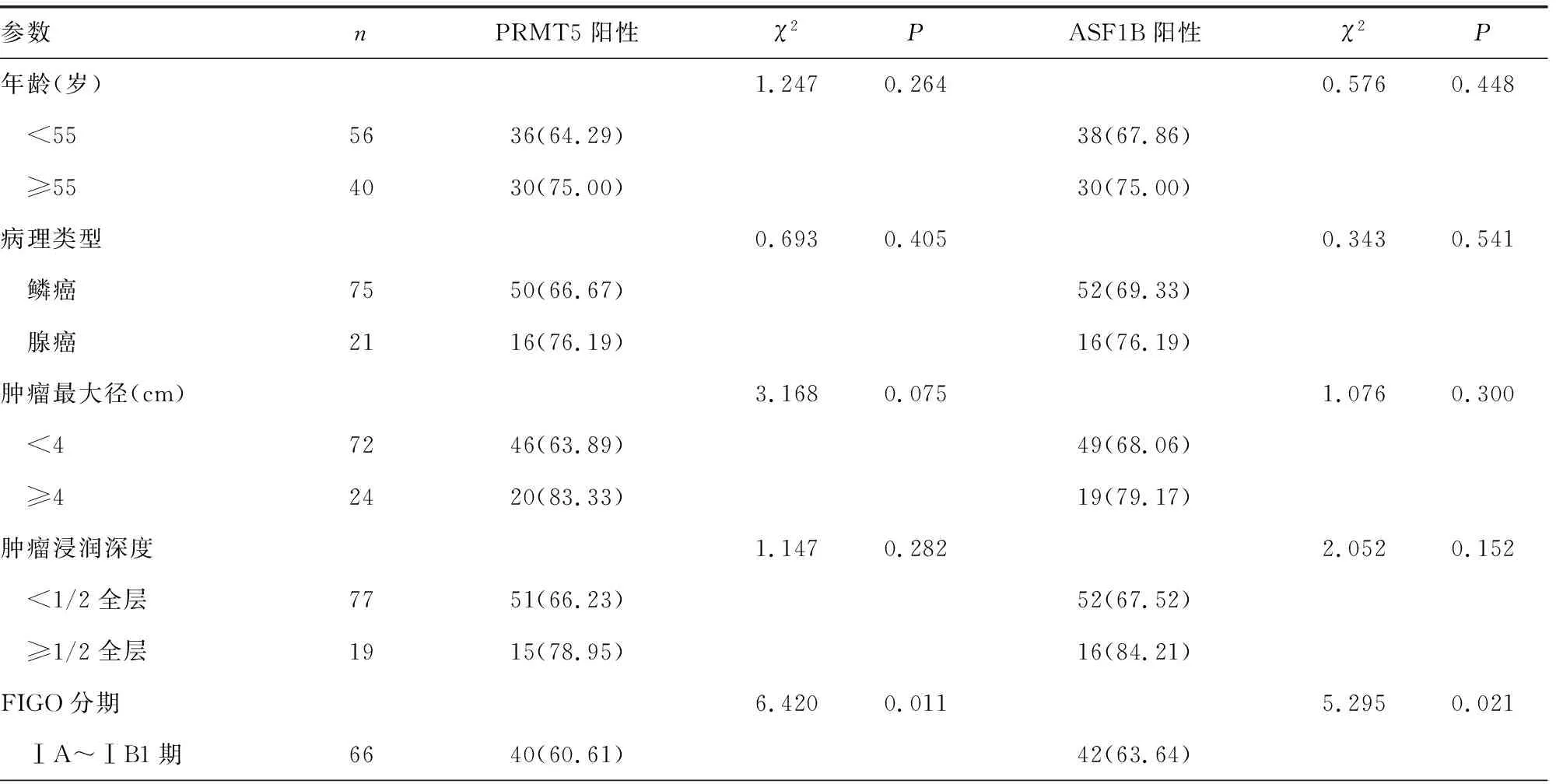
表1 不同临床病理参数患者PRMT5、ASF1B表达比较[n(%)]
2.3宫颈癌组织中PRMT5、ASF1B蛋白表达与预后的关系 96例患者随访过程中,失访2例,失访率2.08%(2/90),死亡10例,复发18例,3年总生存率和3年无进展生存率分别为89.58%(86/96)、81.25%(78/96)。PRMT5阳性表达组及阴性表达组患者的3年总生存率分别为87.88%(58/66)、93.33%(28/30),差异无统计学意义(χ2=1.386,P=0.247)。PRMT5阳性及阴性表达组患者的3年无进展生存率分别为77.27%(51/66)、90.00%(27/30),PRMT5阳性表达组3年无进展生存率明显低于PRMT5阴性表达组,差异有统计学意义(χ2=4.386,P<0.001)。
ASF1B阳性及阴性表达组患者的3年总生存率分别为88.24%(60/68)、92.86%(26/28),差异无统计学意义(χ2=1.587,P=0.189)。ASF1B阳性及阴性表达组患者的3年无进展生存率分别为76.47%(52/68)、92.86%(26/28),ASF1B阳性表达组3年无进展生存率明显低于ASF1B阴性表达组,差异有统计学意义(χ2=5.117,P<0.001)。见图2。
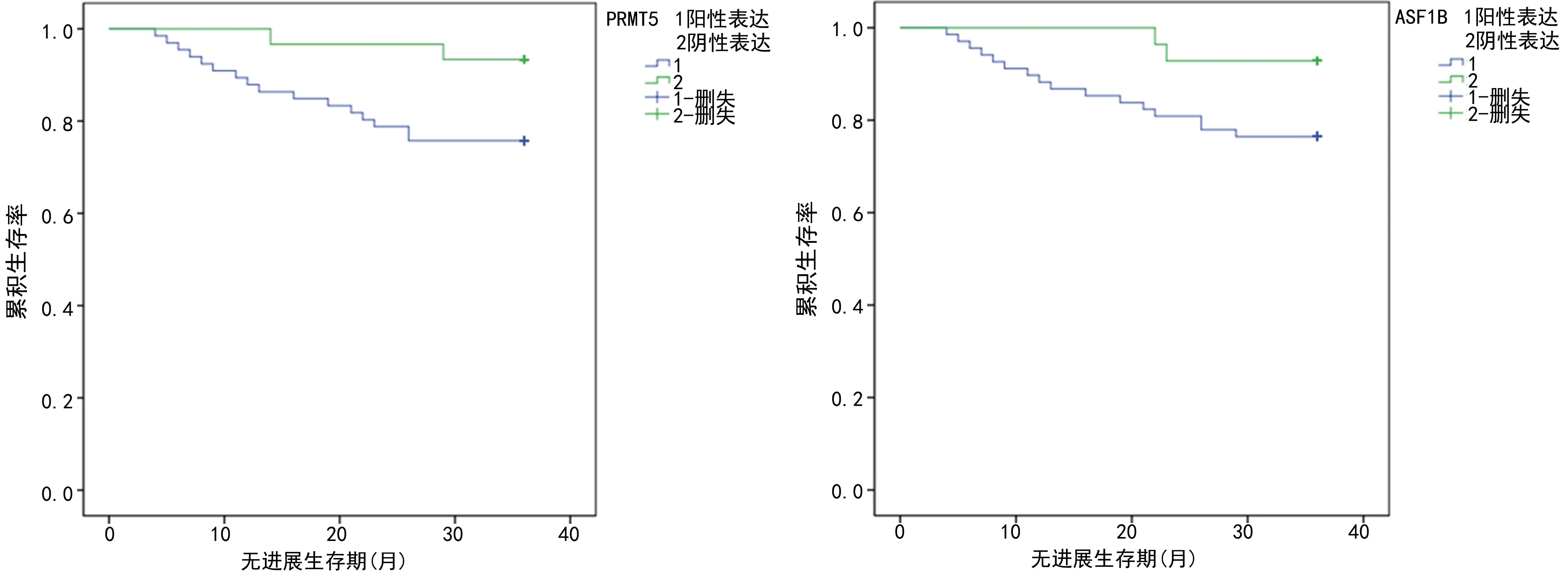
图2 宫颈癌组织PRMT5、ASF1B蛋白表达与患者预后的关系
2.4宫颈癌患者预后的COX比例风险回归分析 以患者是否发生肿瘤进展作为因变量(赋值:0=进展,1=无进展,t=无进展生存期),单因素COX比例风险回归分析结果显示,FIGO分期、淋巴结转移,以及PRMT5、ASF1B阳性是影响宫颈癌无进展生存预后的因素(P<0.05)。将单因素分析中差异有统计学意义的因素(P<0.05)纳入多因素COX比例风险回归分析。结果显示,FIGO分期ⅠB2~ⅡA期、淋巴结转移、PRMT5阳性、ASF1B阳性是影响宫颈癌患者无进展生存预后的独立危险因素(P<0.05)。见表2、3。
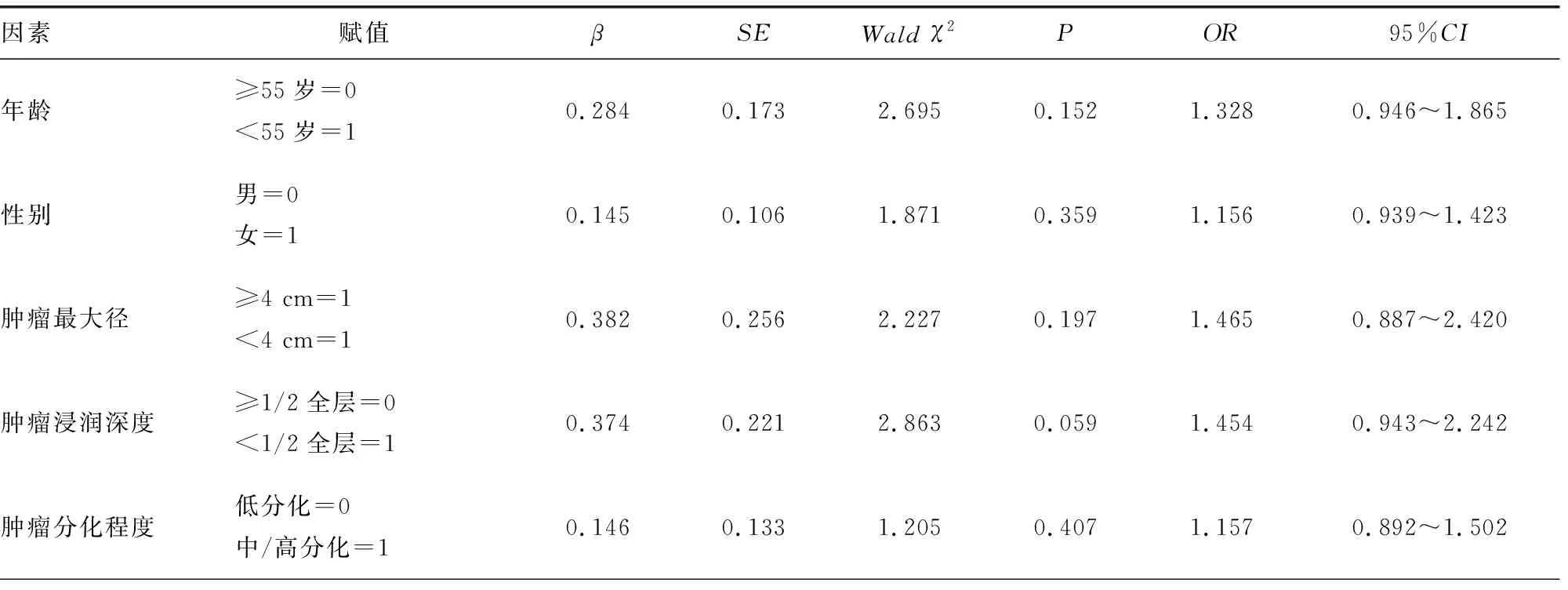
表2 宫颈癌患者无进展生存的单因素COX比例风险回归分析
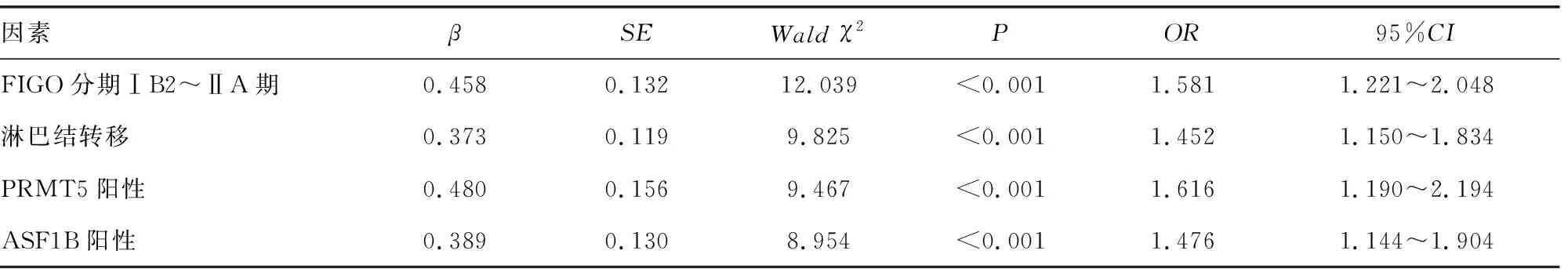
表3 宫颈癌患者无进展生存的多因素COX比例风险回归分析
3 讨 论
宫颈癌是我国女性常见的恶性肿瘤之一[9]。目前宫颈癌的治疗主要包括手术、放疗及铂类药物化疗,但仍有部分患者会发生肿瘤复发或转移。因此,深入研究宫颈癌的分子机制,寻找预后生物标志物,对于宫颈癌个体化治疗具有重要的临床价值。
PRMT5属于Ⅱ型精氨酸甲基转移酶,参与包括细胞代谢、增殖、染色质重塑、细胞周期进展和细胞信号转导等细胞过程。PRMT5与人类恶性肿瘤的发生和发展有关。ZHANG等[10]报道,PRMT5通过激活磷脂酰肌醇3激酶/Akt信号通路促进肺癌细胞增殖,导致患者不良预后。本研究结果发现,宫颈癌组织中PRMT5表达升高,并与FIGO分期、淋巴结转移有关,表明PRMT5表达升高促进宫颈癌的发生发展。KTYUKOV等[11]报道,肿瘤中甲基硫腺苷磷酸化酶的缺失促进PRMT5的表达,细胞内甲硫腺苷水平增加,促进肿瘤细胞代谢及过度增殖。QIN等[12]研究显示,胰腺癌中PRMT5的过度表达抑制E3泛素连接酶含F-box/WD重复序列的蛋白7的表达,导致c-Myc蛋白稳定性增加,c-Myc促进肿瘤无氧糖酵解,从而导致肿瘤细胞过度增殖。本研究中,PRMT5阳性表达宫颈癌患者预后较差,提示检测癌组织中PRMT5的表达有助于评估宫颈癌患者的临床预后,这可能与PRMT5的表达促进肿瘤耐药性形成有关。研究表明,PRMT5的表达升高能够促进微管去稳蛋白2的表达,增强肿瘤对紫杉醇等化疗药物的抵抗性[13]。JIANG等[14]发现,敲除宫颈癌肿瘤细胞中PRMT5的表达可以直接增强T细胞中干扰素-γ、颗粒酶B的表达,降低T细胞程序性死亡因子1配体的表达,抑制宫颈癌移植肿瘤模型中的肿瘤生长。因此,PRMT5可能是宫颈癌治疗的潜在靶点。
ASF1B是组蛋白H3/H4的分子伴侣,参与DNA复制,修复及转录调控,在细胞周期进程调节中发挥重要的功能。近年来研究发现,ASF1B参与乳腺癌,甲状腺癌等恶性肿瘤的发生和发展过程,因其与肿瘤患者不良预后有关[5,15]。本研究中,宫颈癌中ASF1B表达升高,并与FIGO分期、淋巴结转移有关,表明ASF1B表达升高促进宫颈癌的发生发展。ASF1B表达升高与转录后调控异常有关。SHI等[16]研究显示,肿瘤中miR-767-3p表达显著下调,导致其不能结合及降解ASF1B mRNA,使ASF1B蛋白表达升高。ASF1B的表达升高能够通过促进肿瘤的增殖和侵袭转移能力,促进肿瘤进展。有研究发现,在宫颈癌Hela细胞中,ASF1B能与细胞周期蛋白依赖性激酶9结合形成复合物,并增强其稳定性,导致肿瘤细胞的过度增殖[17]。WANG等[18]报道,肺癌中ASF1B的表达上调诱导Snail等转录因子的表达,促进肿瘤细胞上皮间充质转化的发生,导致肿瘤的侵袭及转移。
本研究中,ASF1B阳性表达宫颈癌患者预后较差,提示检测ASF1B有助于评估宫颈癌患者的临床预后。其原因可能与ASF1B表达升高促进肿瘤细胞化疗耐药性有关。KIM等[19]报道发现,胰腺癌中ASF1B的过度表达抑制半胱氨酸天冬氨酸蛋白酶3和9的激活,进而抑制细胞凋亡的发生,促进顺铂等化疗药物耐药性的形成。因此,ASF1B可能是宫颈癌潜在预后相关生物标志物和新的治疗靶点。
此外,本研究还发现,宫颈癌中PRMT5与ASF1B蛋白表达呈正相关,提示二者可能共同参与促进宫颈癌的肿瘤进展。原因可能是二者共同参与调控抑癌基因p53的表达。既往研究显示,PRMT5通过抑制p53基因翻译起始因子结合p53基因启动子,抑制p53基因的表达,而ASF1B能够结合并降低p53蛋白的稳定性,消除p53介导的肿瘤抑制效应[18,20]。因此,宫颈癌中PRMT5、ASF1B可能协同促进宫颈癌的肿瘤进展。
综上所述,宫颈癌中PRMT5、ASF1B表达升高,二者与宫颈癌FIGO分期、淋巴结转移相关,参与宫颈癌肿瘤的发生发展。PRMT5阳性、ASF1B阳性是影响宫颈癌患者无进展生存预后的独立危险因素,有助于辅助临床医师对宫颈癌患者的临床预后进行评估。针对宫颈癌高危患者,建议予以积极治疗及随访,以改善患者的临床预后。但本研究也存在一定的局限性:首先,本研究以癌旁组织为对照,未纳入健康者及宫颈炎患者作为良性对照,结果可能存在一定的偏倚,有待今后设计严谨的临床实验进一步验证本研究结论;其次,本研究未能对PRMT5、ASF1B在宫颈癌中的具体作用机制进行探索,有待今后进行深入的基础实验研究。
