弓形虫SAG1、ROP18真核表达载体的构建及在诱导小鼠保护性免疫中的作用研究*
2023-10-11吴腊梅彭天丽何雁鸿董成林杨慧健
吴腊梅,彭天丽,何雁鸿,董成林,杨慧健△
1.上海市嘉定区安亭医院检验科,上海 201800;2.上海中冶医院检验科,上海 200941
弓形虫是一种专性细胞内寄生的原虫,能够感染大多数温血哺乳动物,可引起人兽共患弓形虫病[1]。弓形虫病也是常见的机会性致病寄生虫病[2],在肿瘤患者、人类免疫缺陷病毒(HIV)感染者及艾滋病(AIDS)人群中弓形虫抗体阳性率分别高达63.0%、44.8%和95.0%[3]。弓形虫感染人体后可侵犯人体的各个组织及脏器,并可通过母婴垂直传播造成胎儿神经系统发育障碍、胎儿畸形,引起流产甚至是死胎。家畜弓形虫病的传播和流行,不仅给畜牧业的生产带来严重的损失,更是人类感染弓形虫的重要传染源[4-5]。目前弓形虫病的药物治疗效果不很理想,疫苗接种可能是预防弓形虫病的最佳策略[6]。
速殖子表面抗原1(SAG1)是最早被克隆表达的蛋白,弓形虫SAG1抗原作为弓形虫速殖子表面的主要抗原之一,是诱导宿主免疫应答的主要靶抗原,也是迄今应用最多的弓形虫疫苗候选抗原[7-8]。棒状体蛋白18(ROP18)定位于纳虫泡中[9],是丝氨酸-苏氨酸激酶,是重要的毒力因子。ROP18可改变其感染的宿主细胞的信号传导,使感染细胞的基因表达发生变化,阻止宿主细胞发生凋亡。当弓形虫进入宿主细胞时,会生成一层保护膜将自身包裹起来,ROP18的作用则是让宿主细胞的某些蛋白失效而无法破坏这层保护膜[10]。弓形虫的生活史较为复杂,抗原成分种类多,每种抗原在体内诱导的免疫反应有所不同,单个抗原的免疫效果不很理想,联合基因疫苗诱导的各项免疫指标显著优于单价疫苗[11-13],能够克服单基因抗原作为候选疫苗诱导主动免疫的不足。因此,本研究拟在构建真核表达质粒p3×FLAG-Myc-CMVTM-24-SAG1、p3×FLAG-Myc-CMVTM-24-ROP18的基础上分别单独或联合免疫小鼠,并初步研究判断其免疫保护效果。
1 材料与方法
1.1实验动物 纯种BALB/c鼠102只,4~6周龄,雌性,体重(20±2)g,由扬州大学实验动物中心提供。
1.2弓形虫虫株与质粒 弓形虫RH株速殖子为本实验室保种,p3×FLAG-Myc-CMVTM-24真核表达载体由江苏大学医学院龚爱华副教授惠赠,重组真核表达质粒p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAG-Myc-CMVTM-24-ROP18由本课题组构建。
1.3主要试剂及仪器 AxyPrep质粒大量试剂盒购于AxyGEN 公司,RNA提取试剂Trizol、逆转录试剂盒HiScriptTMReverse Transcriptase、荧光定量试剂AceQ qPCR SYBR Green Master Mix(不含ROX染料)均购于南京诺唯赞(Vazyme)公司,异硫氰酸荧光素(FITC)anti-mouse CD4(L3T4)、藻红蛋白(PE)、anti-mouse CD8a(Ly-2)购于联科生物,RPMI 1640培养液购于赛默飞世尔生物化学制品(北京)有限公司,胎牛血清购于杭州四季青公司。荧光定量PCR扩增仪购于美国Bio-Rad公司,流式细胞仪购于美国BD公司,CO2培养箱(Forma series Ⅱ)购于美国Thermo公司。
1.4重组质粒的大量提取与表达鉴定 按照质粒大量提取试剂盒制备重组真核表达质粒p3×FLAG-Myc-CMVTM-24-SAG1、3×FLAG-Myc-CMVTM-24-ROP18及对照质粒p3×FLAG-Myc-CMVTM-24,各质粒经DNA转染试剂盒(RonfectTMDNA transfection reagent)导入HEK-293T细胞内,加入含胎牛血清的DMEM培养基,在含5%CO2,37 ℃孵育箱培养48 h后,收集细胞并提取蛋白,通过Western blotting法鉴定质粒表达情况。紫外分光光度计测定吸光度(A)值A260及A280并计算其比值,确定质粒的浓度和纯度。质粒转染过程按照试剂说明书操作。
1.5DNA疫苗免疫接种 将BALB/c系小鼠随机分成6组,每组17只,将提取的空载体p3×FLAG-Myc-CMVTM-24及重组质粒p3×FLAG-Myc-CMVTM-24-SAG1、p3×FLAG-Myc-CMVTM-24-ROP18以磷酸盐缓冲液(PBS)稀释至1 μg/μL。注射选用4 号针头,经小鼠左后腿或右后腿胫后下端,以平行于肌肉纵轴的方向进针。第1组为PBS对照组(以下简称PBS组),第2组为空载体对照组(p3×FLAG-Myc-CMVTM-24)(以下简称空载体组),第3组为p3×FLAG-Myc-CMVTM-24-SAG1(SAG1组),第4组为p3×FLAG-Myc-CMVTM-24-ROP18(ROP18组),以上4组每次注射100 μL;第5、6组为p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAG-Myc-CMVTM-24-ROP18均量混合组(全量混合组、半量混合组),每次分别注射200 μL和100 μL。初次免疫后于第2、4周加强免疫,末次免疫4周后做检测。
1.6小鼠脾脏T淋巴细胞亚群的测定 末次免疫后4周,各组随机挑选7只小鼠,无菌条件下取脾,将脾制成脾细胞悬液,用Hanks液洗3次,每次1 000 r/min,离心10 min,然后将细胞悬浮于PBS中,调整细胞浓度至1×106/mL。取100 μL悬液,加抗 CD4+、CD8+T 单抗,避光 40 min,用流式细胞仪检测CD4+、CD8+T淋巴细胞比例。其中,检测CD4的单抗为FITC标记的小鼠IgG2b,检测CD8的单抗为PE标记的IgG2a,二者均配以阴性对照。
1.7白细胞介素(IL)-4、IL-12、干扰素γ(IFN-γ)细胞因子检测 实时荧光定量法检测各组小鼠脾细胞中细胞因子IL-4、IL-12、IFN-γ mRNA表达水平。收集剩余的脾细胞悬液1 000 r/min离心10 min后弃除上清,加入Trizol试剂,按照试剂使用说明书提取脾脏细胞总RNA,并确定其纯度和浓度,以总的RNA为模板,用逆转录试剂盒将其逆转录成cDNA。根据GenBank中小鼠IL-4、IL-12、IFN-γ、β-actin的基因序列设计引物。IL-4:上游引物为5′-GGTCTCAACCCCCAGCTAGT-3′,下游引物为5′-GCCGATGATCTCTCTCAAGTGAT-3′。IL-12:上游引物为5′-TGACATGGTGAAGACGGC-3′,下游引物为5′-GCCTGGAACTCTGTCTGGTA-3′。IFN-γ:上游引物为5′-GCTTTGCAGCTCTTCCTCAT-3′,下游引物为5′-TCTTCCACATCTATGCCACTTG-3′。内参β-actin:上游引物为5′-TGGAATCCTGTGGCATCCATGAAAC-3′,下游引物为5′-TAAA ACGCAGCTCAGTAACAGTCCG-3′。采用10 μL体系进行荧光定量PCR反应,PCR反应热循环参数为:预变性95 ℃ 5 min,然后95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环,最后设定57~95 ℃熔解温度区间每5 s上升0.5 ℃。利用公式2-ΔΔCt对数据进行相对定量。
1.8免疫小鼠抗攻击感染试验 末次免疫后4周,各组小鼠随机抽取10只,每只小鼠腹腔注射弓形虫RH株速殖子1 000个,每天观察小鼠的变化和死亡时间。
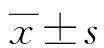
2 结 果
2.1重组质粒的鉴定结果及提取 真核表达质粒p3×FLAG-Myc-CMVTM-24-SAG1、3×FLAG-Myc-CMVTM-24-ROP18及对照质粒p3×FLAG-Myc-CMVTM-24在HEK-293T中蛋白表达条带清晰,即SAG1蛋白相对分子质量介于35×103~40×103,ROP18蛋白相对分子质量介于55×103~70×103。见图1。经紫外分光光度计测得扩增质粒的A260/A280为1.8~2.0,采用PBS将质粒稀释至1 μg/μL。
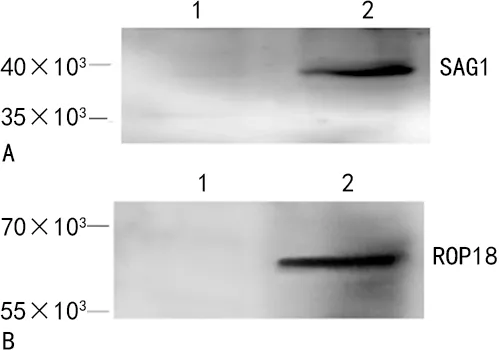
注:A为SAG1蛋白表达,1为空载体,2为SAG1;B为ROP18蛋白表达,1为空载体,2为ROP18。图1 SAG1和ROP18真核表达载体在HEK-293T细胞中的蛋白表达
2.2小鼠脾淋巴细胞T细胞亚群的测定 小鼠脾CD4+T细胞在各组间分布差异无统计学意义(P>0.05),而两单基因疫苗组(SAG1组和ROP18组)、全量混合组、半量混合组与两对照组(PBS组和空载体组)CD8+T细胞比较,差异有统计学意义(P<0.01),且全量混合组与单基因ROP18组CD8+T细胞比较,差异有统计学意义(P<0.05),半量混合组与全量混合组、两单基因疫苗组CD8+T细胞比较,差异均有统计学意义(P<0.05)。同时研究结果发现,CD4+/CD8+比值降低,半量混合组、全量混合组,两单基因疫苗组与两对照组比较,差异有统计学意义(P<0.05),半量混合组、全量混合组,两单基因疫苗组差异无统计学意义(P>0.05)。见表1。

表1 小鼠脾淋巴细胞T细胞亚群测定结果
2.3IL-4、IL-12、IFN-γ细胞因子的检测 各组小鼠脾细胞IL-4相对表达水平比较差异无统计学意义(P>0.05),但相比IL-4,不论单载体组还是混合载体组,IL-12与IFN-γ的相对表达水平均高于两对照组(P<0.05),且半量混合组混合二者的表达水平升高更显著,明显高于全量混合组(P<0.05)。见图2。
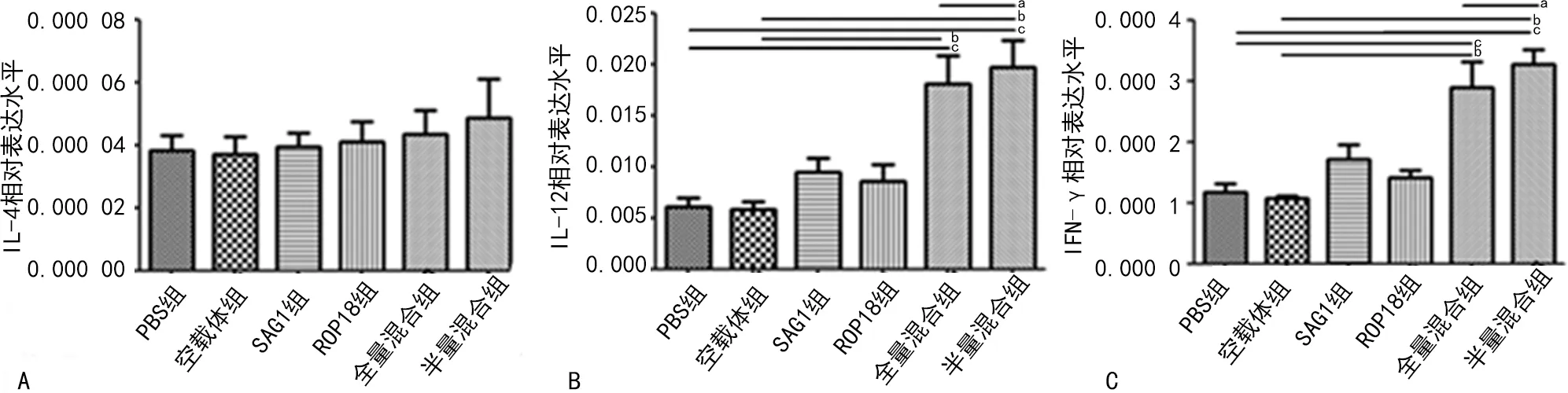
注:A为IL-4 mRNA表达;B为IL-12 mRNA表达;C为IFN-γ mRNA表达;与全量混合组比较,aP<0.05;与空载体组比较,bP<0.05;与PBS组比较,cP<0.05。图2 各组小鼠脾细胞中细胞因子IL-4、IL-12、IFN-γ水平比较
2.4免疫小鼠抗攻击感染试验结果 对BALB/c小鼠腹腔注射约1 000个弓形虫速殖子行攻击感染,试验结果发现各组小鼠均未能耐受感染且均在感染后15 d内死亡。其存活的时间分别为:PBS组(6.42±0.07)d,空载体组(6.38±0.63)d,SAG1组(7.07±0.11)d,ROP18组(6.95±1.10)d,全量混合组(6.95±1.11)d,半量混合组(9.53±0.89)d。两单基因疫苗组、全量混合组、半量混合组较两对照组的生存时间均有延长(P<0.05),且半量混合组较全量混合组的生存时间也延长(P<0.01)。见图3。
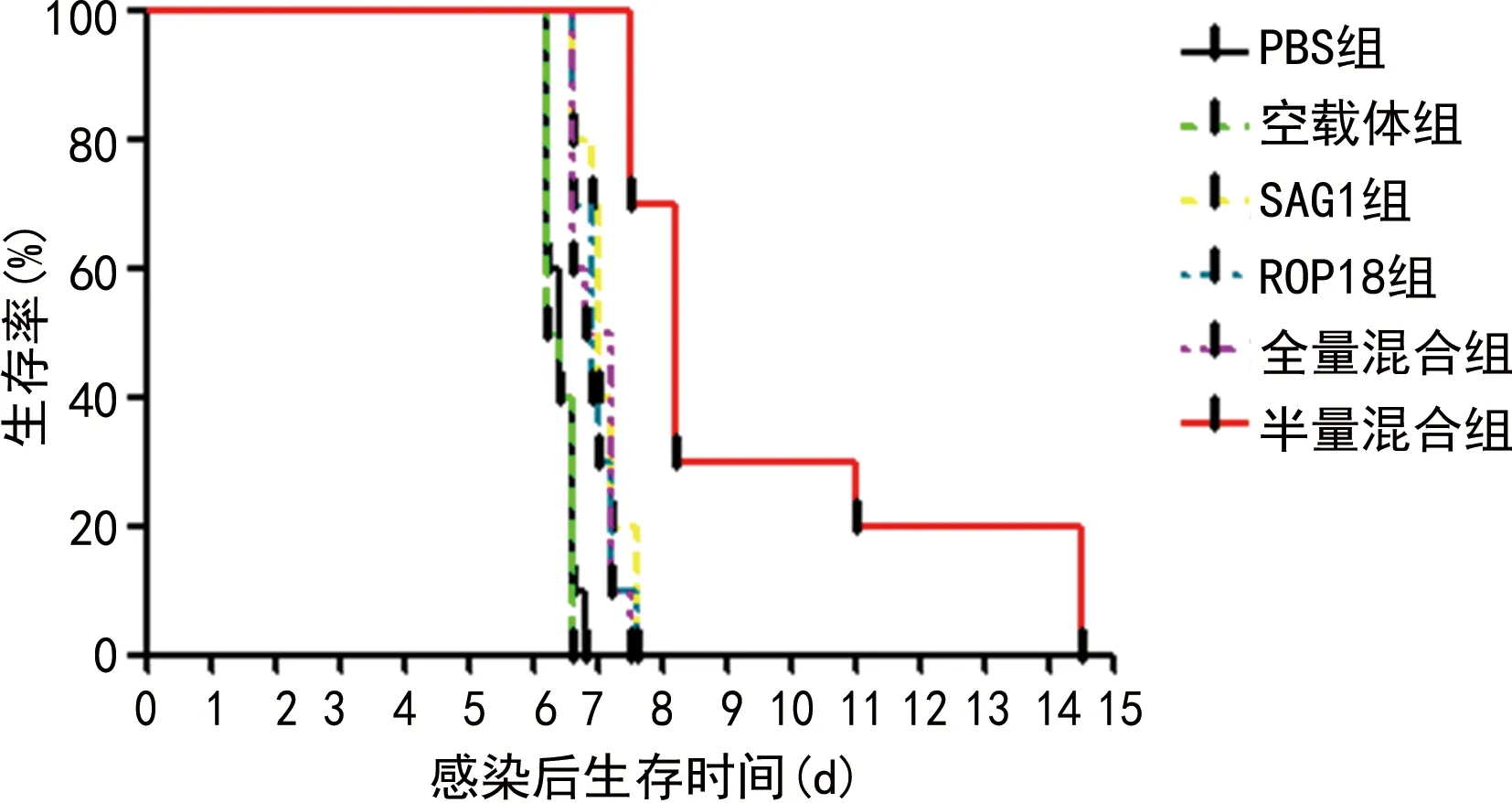
图3 弓形虫RH株速殖子攻击感染后小鼠生存曲线
3 讨 论
DNA疫苗又称核酸疫苗或基因疫苗,是编码免疫原或与免疫原相关的真核表达质粒DNA(有时也可是RNA),它可经一定途径进入动物体内,被宿主细胞摄取后转录和翻译表达出抗原蛋白,此抗原蛋白不仅能刺激机体产生体液免疫应答,而且还可诱导机体产生强烈持久的细胞免疫应答,从而起到免疫保护作用[14-15]。然而,单基因疫苗免疫原性较弱,联合使用编码不同功能构成蛋白的DNA疫苗将是其强化诱导主动免疫的思路之一。本研究将构建好的真核表达载体p3×FLAG-Myc-CMVTM-24-SAG1和p3×FLAG-Myc-CMVTM-24-ROP18联合免疫小鼠,并通过检测小鼠免疫细胞、主要细胞因子的方法监测不同方案小鼠免疫功能状态,通过观察小鼠生存时间的方法判断最佳免疫效果。
本实验结果显示,末次免疫的后4周,半量混合组小鼠脾细胞CD8+T的分布频率最高而CD4+T细胞在各组间分布差异不明显,原因可能与CD8+T参与了清除寄生虫及感染细胞的细胞毒性反应相关[12]。同时,对主要由Th1分泌的IL-12、IFN-γ和Th2来源的IL-4 mRNA表达水平的检测发现,在混合组IFN-γ、IL-12的表达水平明显升高且半量混合组更高(P<0.05),IL-4水平则在6组间表达水平差异无统计学意义(P>0.05)。这一结果表明在针对寄生虫的免疫活动中Th1与Th2的动态平衡的打破及细胞免疫的优势地位,因为很可能是Th1亚群分泌IFN-γ、IL-12 等多种细胞因子诱导了细胞免疫及增强吞噬细胞介导的抗感染免疫,特别是抗胞内病原体的感染。因此,本课题组认为合适的抗原量混合免疫BALB/c小鼠能刺激机体产生更强烈的细胞免疫应答。这与XUE等[16]的研究结果相符。
为观察所构建的单基因质粒单独或联合使用对弓形虫感染的实际免疫诱导保护效果,本研究用高剂量弓形虫强毒株攻击感染BALB/c小鼠,结果显示,半量混合组小鼠的平均存活时间较全量混合组和单基因疫苗组显著延长(P<0.05),说明联合疫苗相比于单基因疫苗能更好地产生免疫保护作用,且合适的抗原量能更好地刺激机体产生免疫保护反应。
在本研究中各组小鼠均未能存活,可能与用于攻击感染试验的弓形虫数量远高于自然感染量有关[16],也可能与小鼠的种类及载体的选择有关[17]。在自然环境中,弓形虫主要是通过消化道感染包囊、卵囊等感染中间宿主,因为消化道具有屏障保护的作用,如果通过口服或鼻黏膜免疫弓形虫来模仿弓形虫的自然感染途径,则可较客观地评价此疫苗的免疫保护效果,此研究有待进一步进行探索。
