金丝桃苷通过miR-155/c-MYB通路抑制脑胶质瘤U251细胞增殖、侵袭及迁移作用
2023-10-11张金仿马开慧
侯 悦,张金仿,马开慧,郑 艳
首都医科大学附属北京友谊医院临床检验中心,北京 100050
脑胶质瘤是中枢神经系统最常见的恶性肿瘤,复发率高,预后差[1]。有研究显示,Ⅳ级神经胶质瘤的生存期往往不到一年,这主要由于脑胶质瘤细胞的快速、不受控制的增殖以及神经胶质瘤细胞的高侵袭性[2]。因此,了解神经胶质瘤肿瘤发生和发展的分子机制将有助于改善神经胶质瘤的疗效。微小RNA(miRNA)是长度为19~25个核苷酸的单链非编码RNA,主要通过靶向信使RNA(mRNA)的3′-非翻译区(3′-UTR)影响mRNA转录和蛋白质翻译的稳定性。miRNA可调控抑癌或致癌基因的表达水平,并参与癌症的发生和发展。有研究表明,miR-16-1在减少胶质瘤细胞的侵袭中发挥了作用,而miR-155通过靶向FOXO3a促进胶质瘤细胞的增殖和侵袭,而PI3K/Akt信号传导可能对其负调控[3]。 近期有研究表明,miR-155的表达可能受包括c-MYB在内的核转录因子的调节,c-MYB与造血细胞的分化和增殖有关 c-MYB促进miR-155宿主基因MIR155HG在慢性淋巴细胞性白血病中的表达水平,这表明c-MYB可能充当miR-155的转录激活因子[4-5]。
金丝桃苷具有抗衰老,抗炎和抗氧化的特性,可防止异丙肾上腺素引起的心肌损伤[6]。有研究表明,金丝桃苷对乳腺癌、黑色素瘤、结肠癌和前列腺癌具有抗癌作用[7]。理化分析表明,金丝桃苷不仅可溶于水,而且还具有很高的亲脂性,因此它很容易穿过血脑屏障[8]。有研究表明,脑脊液中金丝桃苷的水平高于血液,因此,金丝桃苷已被用于改善帕金森病的失眠症和预防[9]。目前,金丝桃苷对脑胶质瘤细胞的作用的研究报道尚不清楚。本研究拟探讨金丝桃苷经miR-155/c-MYB通路抑制脑胶质瘤U251细胞增殖、侵袭及迁移作用,为脑胶质瘤的治疗提供依据。
1 材料与方法
1.1细胞培养及分组 人神经胶质瘤细胞系U251购自中国科学院(中国上海)。使用Dulbecco改良的Eagle培养基(DMEM)/ F12培养细胞,该细胞培养基还含有10%胎牛血清(FBS)、100 U/mL青霉素和100 mg/mL 链霉素。细胞培养环境为:37 ℃、5%CO2、2%O2、93%N2。细胞分组设计如下。U251细胞组:细胞浓度为5×106/mL的脑胶质瘤U251细胞在10%FBS的DMEM中培养;紫杉醇组:脑胶质瘤U251细胞培养方法同U251细胞组,加入紫杉醇,使紫杉醇浓度为300 μmol/mL;金丝桃苷低、高剂量组的脑胶质瘤U251细胞培养方法同U251细胞组,各组分别加入金丝桃苷,使金丝桃苷浓度分别为300、600 μmol/mL。以上各组细胞设置6个平行孔,培养72 h。
1.2主要试剂及仪器 DMEM培养基/F12(美国格兰德岛生命技术公司,批号545263.32);FBS、青霉素、链霉素(中国碧云天生物技术研究所,批号:598756.63、548985.38、415298.59);金丝桃苷(美国Sigma公司,批号:MN-45875.36);紫杉醇(德国Merck KGaA,批号:RF-4512.36);CCK-8测定试剂盒(江苏和创生物科技有限公司,批号:14526.34);TRIzol®试剂(美国Invitrogen公司,批号:NB-478523.34);PrimeScriptTMRT试剂盒(日本TaKaRa公司,批号:VC-418963);SYBR Green PCR Master Mix试剂盒(日本TaKaRa公司);放射免疫沉淀测定缓冲液(中国碧云天生物技术研究所,批号:BV-47896.32);双辛可宁酸试剂盒(中国碧云天生物技术研究所,批号:VH-412369.96);PVDF膜(美国EMD Millipore公司,批号:CI-54896.36);c-MYB一抗(1∶2 000;美国Sigma公司);β-肌动蛋白(β-actin)一抗,1∶5 000;美国Sigma公司);膜与抗兔IgG(1∶5 000;美国Sigma公司);增强型化学发光蛋白质检测试剂盒(美国Pierce Biotechnology公司,批号:B548596)。FR-09酶标仪(Bio-Rad Laboratories);Transwell上室(孔径0.8 μm;美国BD公司,批号:XI-478596);基质胶(美国Sigma-Aldrich公司,批号:452656.36);yh-09倒置光学显微镜(日本Olympus公司);NanoDrop 1000分光光度计(美国Thermo Fisher Scientific公司)。
1.3细胞增殖测定 通过CCK-8法检测细胞的增殖活性。在相应的时间点将10 mL的CCK-8溶液添加到每个孔中。在37 ℃下温育2 h后,使用酶标仪测量450 nm处的吸光度(A)。存活率=(A实验组-AU251细胞组)/(A实验组-A蒸馏水空白组)×100%。
1.4细胞侵袭迁移水平测定 采用Transwell测定法评估细胞迁移和侵袭能力。为了进行迁移分析,使用无FBS培养基稀释约105个细胞加入预先涂有基质胶的上室中。随后,将500 mL含10%FBS的培养基加入下室中。温育48 h后,使用棉签去除非迁移/侵袭性细胞。使用甲醇将下腔室中迁移/侵袭的细胞固定15 min,然后用0.5%的结晶紫染色。使用倒置光学显微镜在10个随机选择的区域中进行细胞计数。
1.5细胞凋亡水平测定 流式细胞仪检测细胞的凋亡率。在相应的时间点将Annexin V-FITC和PI试剂各15 μL添加到每个孔中,孵育18 min,混匀,采用流式细胞仪检测细胞凋亡水平。
1.6细胞miR-155、c-MYB mRNA水平测定 实时荧光定量聚合酶链反应(RT-qPCR)测定细胞miR-155、c-MYB水平。使用TRIzol®试剂提取细胞中的总RNA,使用NanoDrop 1000分光光度计评估提取的RNA纯度和质量浓度。 cDNA由PrimeScriptTMRT试剂盒合成,使用SYBR Green PCR Master Mix进行PCR反应。以内源性β-actin和U6小核RNA分别作为对照来标准化mRNA和miRNA的表达。正向和反向引物的序列如下。miR-155:正向引物为5′-TGCTAGTCGATCGATCGTAGCTAGCTAG-CTGATCGAC-3′,反向引物为5′-TGCTAGTCGAT-CGATCGATCGTACGTAGCTAGCTAGCTAGCT-AGC-3′;c-MYB:正向引物为5′-TCGCGATCGATCG-TAGCTAGCTAGCTAGCTAGCTAGC-3′,反向引物为5′-TGCTAGTCGATCGATCGATCGTAGCTA-GCTCGCTCGCT-3′;β-actin:正向引物为5′-TCG-CTAGTCGATCGATCGATCGATCGTAGCTAGCT-CGATCG-3′,反向引物为5′-TGCTAGCTA-GCTAGCTAGCTAGCTGATCGCTAGC-3′;内参U6:正向引物为5′-CTCGCTTCGGCAGCACATA-3′,反正向引物为5′-AACGATTCACGAATTTGCGT-3′。PCR反应条件:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 20 s,72 ℃ 10 s,共45个循环。采用2-ΔΔCt法计算相对表达水平。
1.7细胞c-MYB蛋白水平测定 Western blotting法测定c-MYB蛋白水平。提取神经胶质瘤细胞总蛋白,使用双辛可宁酸测定法确定提取的蛋白质的浓度。SDS-PAGE电泳分离等量(40 mg)蛋白质样品,将蛋白质转移到PVDF膜上,然后在室温下使用含5%脱脂牛奶的Tris缓冲液封闭膜1 h,使用c-MYB、β-actin一抗4 ℃孵育过夜,洗涤后将膜与二抗温育1 h。采用增强型化学发光蛋白质检测试剂盒可视化蛋白质条带,通过Image J对信号进行定量。
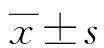
2 结 果
2.1各组U251细胞存活率比较 与U251细胞组相比,紫杉醇组、金丝桃苷低、高剂量组存活率均显著降低(P<0.05);与紫杉醇组相比,金丝桃苷低剂量组存活率显著升高(P<0.05),金丝桃苷高剂量组存活率显著降低(P<0.05);与金丝桃苷低剂量组相比,金丝桃苷高剂量组存活率显著降低(P<0.05)。见图1。
注:与U251细胞组相比,aP<0.05;与紫衫醇组相比,bP<0.05;与金丝桃苷低剂量组相比,cP<0.05。图1 各组U251细胞存活率比较
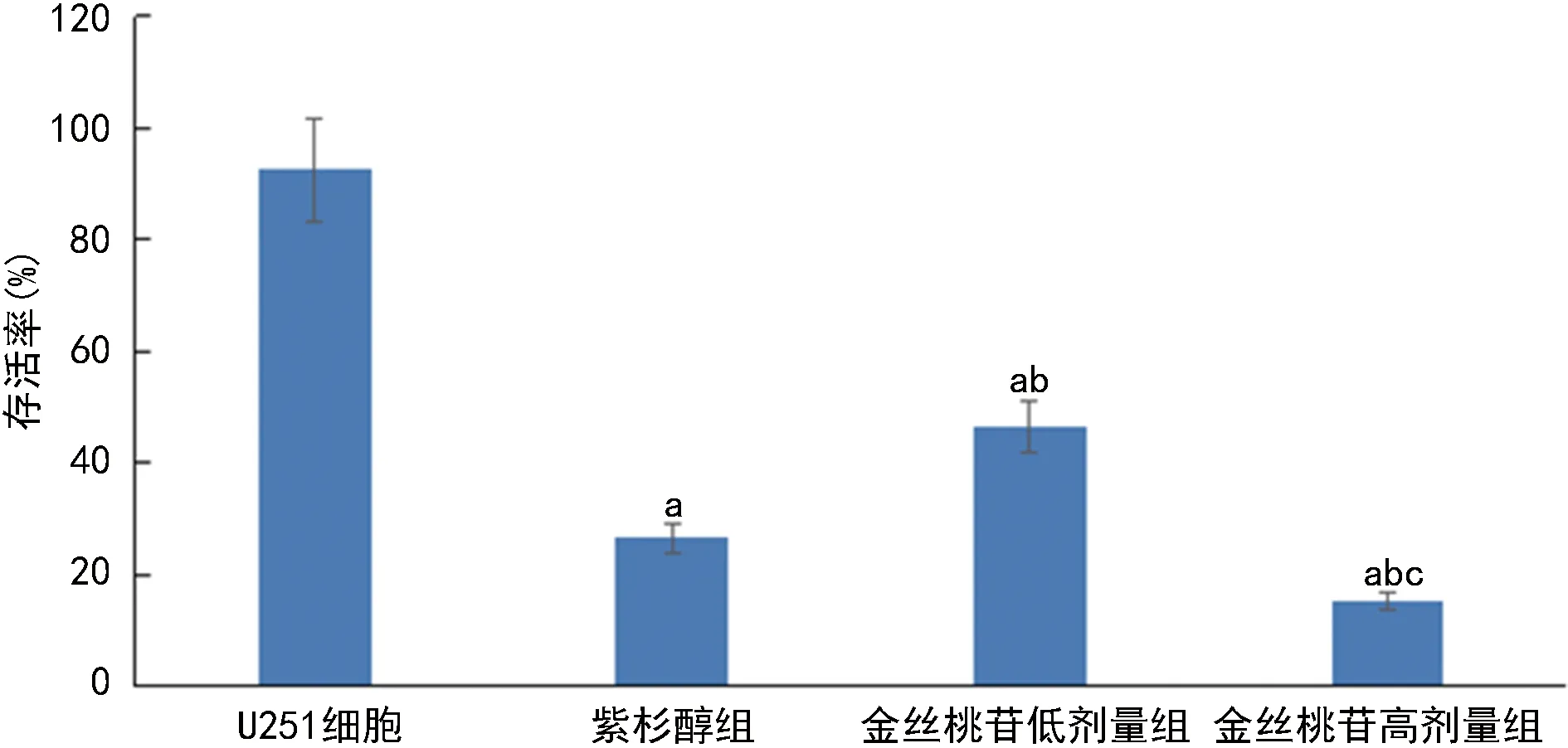
2.2各组U251细胞克隆形成数目比较 与U251细胞组相比,紫杉醇组、金丝桃苷低、高剂量组克隆形成数显著降低(P<0.05);与紫杉醇组相比,金丝桃苷低剂量组克隆形成数显著升高(P<0.05),金丝桃苷高剂量组克隆形成数显著降低(P<0.05);与金丝桃苷低剂量组相比,金丝桃苷高剂量组克隆形成数显著降低(P<0.05)。见图2。
2.3各组U251细胞侵袭迁移能力比较 与U251细胞组相比,紫杉醇组、金丝桃苷低、高剂量组穿膜数目显著降低(P<0.05);与紫杉醇组相比,金丝桃苷低剂量组穿膜数目显著升高(P<0.05),金丝桃苷高剂量组穿膜数目显著降低(P<0.05);与金丝桃苷低剂量组相比,金丝桃苷高剂量组穿膜数目显著降低(P<0.05)。见图3。
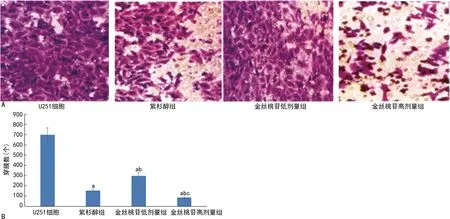
注:A为各组U251细胞侵袭迁移能力(200×);B为各组U251细胞穿膜情况统计与U251细胞组相比,aP<0.05;与紫衫醇组相比,bP<0.05;与金丝桃苷低剂量组相比,cP<0.05。图3 各组U251细胞侵袭迁移能力比较
2.4各组U251细胞凋亡率比较 与U251细胞组相比,紫杉醇组、金丝桃苷低、高剂量组凋亡率显著升高(P<0.05);与紫杉醇组相比,金丝桃苷低剂量组凋亡率显著减低(P<0.05),金丝桃苷高剂量组凋亡率显著升高(P<0.05);与金丝桃苷低剂量组相比,金丝桃苷高剂量组凋亡率显著升高(P<0.05)。见图4。
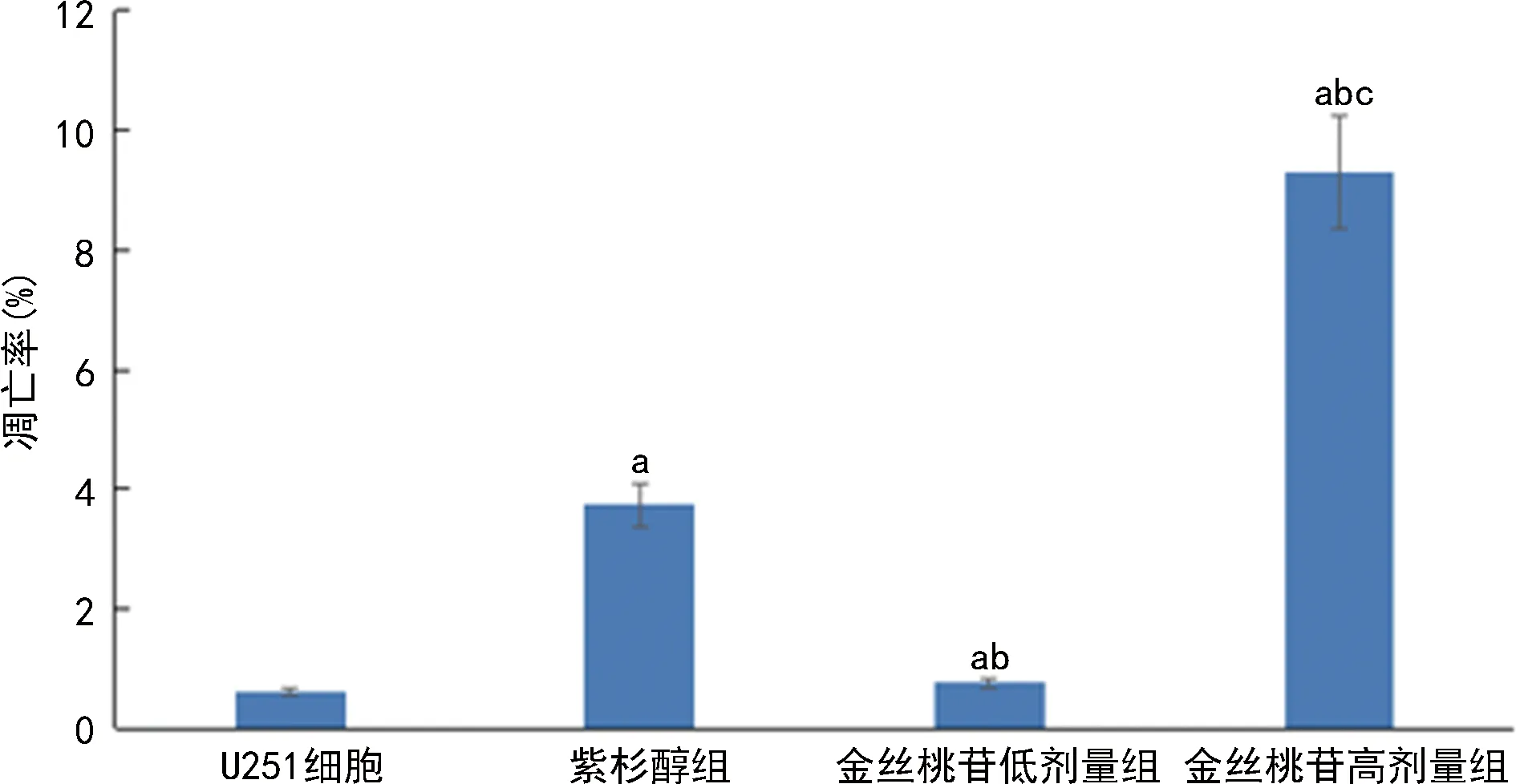
注:与U251细胞组相比,aP<0.05;与紫衫醇组相比,bP<0.05;与金丝桃苷低剂量组相比,cP<0.05。图4 各组U251细胞凋亡率比较
2.5各组U251细胞miR-155、c-MYB mRNA及蛋白表达水平比较 与U251细胞组相比,紫杉醇组、金丝桃苷低、高剂量组miR-155、c-MYB mRNA和蛋白表达水平显著降低(P<0.05);与紫杉醇组相比,金丝桃苷低剂量组miR-155、c-MYB mRNA和蛋白表达水平显著升高(P<0.05),金丝桃苷高剂量组miR-155、c-MYB mRNA和蛋白表达水平显著降低(P<0.05);与金丝桃苷低剂量组相比,金丝桃苷高剂量组miR-155、c-MYB mRNA和蛋白表达水平显著降低(P<0.05)。见图5。
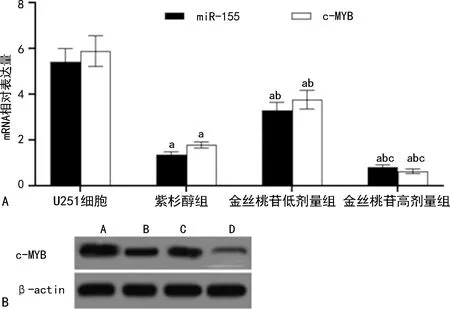
注:A为各组U251细胞miR-155、c-MYB mRNA表达水平比较;B为各组U251细胞c-MYB蛋白表达水平比较;与U251细胞组相比,aP<0.05;与紫衫醇组相比,bP<0.05;与金丝桃苷低剂量组相比,cP<0.05。图5 各组U251细胞miR-155、c-MYB mRNA及蛋白表达水平比较
3 讨 论
脑胶质瘤是脑部常见的侵袭性原发性恶性肿瘤之一,占中枢神经系统恶性肿瘤的大多数。尽管目前已经开发出诸如辅助放射疗法、激素疗法、化学疗法和靶向生物疗法等脑胶质瘤疗法,但大多神经胶质瘤患者的总体生存率仍然很低,预后较差。因此,亟待寻找新的神经胶质瘤的治疗方法。
金丝桃苷是单宁酸的基本组成单元,在植物界广泛分布。据报道,金丝桃苷具有抗癌作用,可以在不同阶段干扰肿瘤的进展[10]。金丝桃苷可抑制肿瘤血管生成,其潜在的机制可能与上调包括血管内皮生长因子在内的关键血管生成因子而干扰参与血管生成的CXCR4/SDF-1相互作用有关[11]。金丝桃苷在MB-49鼠膀胱癌模型中对体外侵袭具有抑制作用,其机制与抑制基质金属蛋白酶-9(MMP-9)有关。此外,金丝桃苷还可以通过抑制激活蛋白1的转录活性来预防动脉粥样硬化[12]。金丝桃苷的抗病毒能力与其抗氧化活性有关[13]。目前,关于金丝桃苷在神经胶质瘤细胞中的作用的报道很少。本研究结果表明,胶质瘤U251细胞经金丝桃苷处理后,其存活率、单细胞克隆形成数目,穿膜数降低,凋亡率升高,差异均有统计学意义(P<0.05);且金丝桃苷高剂量组效果优于紫衫醇组(P<0.05)。这说明金丝桃苷可降低胶质瘤细胞的活力,以及增殖和侵袭能力,并促进其凋亡。
氧缺少和缺乏营养会导致神经胶质瘤细胞分泌促血管生成因子,其在肿瘤生长中起着至关重要的作用。据报道金丝桃苷在一定程度上具有体外的抗血管生成活性。人胎盘静脉血管生成模型分析表明,金丝桃苷对人血管生成的起始和新生血管的生长具有剂量依赖性的抑制作用[14]。大鼠试验表明,250 mg金丝桃苷的给药显著抑制了血管生成,然而,灌胃金丝桃苷的大鼠并未显著抑制血管生成的起始和新血管的生长[15]。本研究未探讨金丝桃苷对脑胶质瘤U251细胞血管的生成作用,但根据本研究数据,金丝桃苷可能对血管生成有用,但需要进一步阐明其潜在机制。
有研究发现,miR-155通过靶向FOXO3a来促进神经胶质瘤细胞的增殖和侵袭,该研究推测金丝桃苷可能通过调节miR-155的表达在神经胶质瘤细胞中起抑制作用[16]。本研究检测了金丝桃苷(300、600 μg/mL)处理后的神经胶质瘤细胞中miR-155的表达水平,结果发现金丝桃苷显著抑制了miR-155的表达水平。有研究表明,金丝桃苷可以正向调节乳腺癌细胞中miR-362-3p的表达水平,而miR-362-3p可以靶向并抑制与肿瘤相关的分子,如TNFAIP8、NRP2,而TNFAIP8、NRP2在人乳腺癌中具有抑制肿瘤细胞增殖和促进凋亡功能[17]。结合本研究结果,TNFAIP8、NRP2也有可能参与了神经胶质瘤细胞的增殖、侵袭,这有待后续进一步研究证实。
c-MYB已被认为是miR-155的转录激活因子,c-MYB在恶性神经胶质瘤中高表达,并与癌细胞的侵袭呈正相关,这提示金丝桃苷可能通过miR-155靶向抑制c-MYB表达[18]。在本研究中,与U251细胞组比较,紫衫醇组、金丝桃苷低、高剂量组c-MYB mRNA和蛋白表达水平降低(P<0.05);与紫衫醇组比较,金丝桃苷低剂量组c-MYB mRNA和蛋白表达升高,金丝桃苷高剂量组c-MYB mRNA和蛋白表达降低,差异均有统计学意义(P<0.05);与金丝桃苷低剂量组比较,金丝桃苷高剂量组c-MYB mRNA和蛋白表达降低,差异有统计学意义(P<0.05)。而在前列腺癌细胞中,c-MYB沉默与前列腺癌细胞的迁移和侵袭相关[19]。结合金丝桃苷对miR-155的作用,提示金丝桃苷抑制miR-155、c-MYB的表达进而抑制miR-155/c-MYB通路,这可能是金丝桃苷抑制脑胶质瘤U251细胞机制之一。
综上所述,金丝桃苷可降低胶质瘤细胞的活力,增殖和侵袭能力,并促进其凋亡,其机制可能与金丝桃苷抑制miR-155、c-MYB表达进而抑制miR-155/c-MYB通路有关。但本文尚未设置miR-155/c-MYB通路抑制剂实验,需在后续研究中进一步验证。
