基于IPA分析SF3B4作为胃癌潜在生物标志物的分子机制*
2023-10-11李德红林赋桂杨兴文杨晓燕袁秀梅
李德红,鲁 彦,颜 丽,林赋桂,杨兴文,杨晓燕,杨 阳,袁秀梅
甘肃省医学检验临床医学研究中心/甘肃省人民医院检验中心,甘肃兰州 730000
可变剪接因子SF3B4是U2型剪接体的重要组成部分,参与前体mRNA剪接[1]。SF3B4在不同肿瘤中的作用不同,是卵巢癌的潜在癌基因[2],但在胰腺癌中可能充当阻遏物[3]。因此,SF3B4在不同肿瘤中的独特作用需要进一步研究。SF3B4在人胃癌组织和细胞中的表达及在胃癌发生发展中的作用尚鲜见文献报道。为探讨SF3B4对人胃癌的分子调控机制,本研究首先检测SF3B4在人胃癌组织和细胞系中的表达情况,进一步基于IPA系统的生物信息学分析,探讨SF3B4对胃癌发生的可能分子调控机制及作为潜在分子标志物的价值。
1 材料与方法
1.1材料 收集2018年5月至2019年5月在甘肃省人民医院行手术切除的34例胃癌患者癌组织及癌旁正常组织标本。本研究经甘肃省人民医院伦理审查委员会批准。
1.2主要仪器与试剂 LightCycler 480 Ⅱ Real time PCR 仪(Roche);NovaSeq 6000 Illumina二代测序仪、NEBNext®UltraTMRNA Library Prep Kit建库试剂盒(Illumina);AGS、HGC-27、 KATO Ⅲ、MKN-74和NCI-N87胃癌细胞株(上海吉凯基因化学技术有限公司);Bulge-LoopTMmiRNA qPCR Primer Set试剂盒(广州锐博);QIAGEN′s Ingenuity®通路分析系统。
1.3免疫组化法检测SF3B4蛋白表达 切片脱蜡,用柠檬酸缓冲液进行热介导抗原修复,用过氧化物酶阻断液在室温下阻断10 min,并按照制造商的方案用正常的非免疫动物血清处理。然后,用稀释的SF3B4一抗4 ℃过夜染色组织切片,然后用磷酸盐缓冲液(PBS)清洗切片,生物素化二抗室温下孵育10 min。清洗后,组织切片用3,3-二氨基联苯胺(DAB)染色,用苏木精反染色,乙醇脱水,用树脂固定。使用NanoZoomer 2.0-HT(日本Hamamatsu)捕获图像。通过免疫组化评分(IRS评分,强度评分×程度评分)评估SF3B4表达水平。染色强度分为0~3分(0分:阴性;1分:弱;2分:中度;3分:强)。染色细胞阳性程度分为5类:0分(0%)、1分(>0%~25%)、2分(>25%~50%)、3分(>50%~75%)、4分(>75%~100%)。根据IRS评分,将染色结果定义为低表达(IRS评分:0~6分)和高表达(IRS评分:8~12分)。
1.4荧光定量PCR(RT-qPCR)检测SF3B4在人胃癌细胞系中的表达水平 胃癌细胞以2×105/mL密度制成细胞悬液,接种于6孔板,每种细胞设置3个复孔,置于37 ℃、5% CO2培养箱中培养。待细胞生长达80%时收集细胞, TRIzol法提取总RNA,逆转录(Promega M-MLV)为cDNA后采用RT-qPCR仪检测SF3B4的相对表达水平。以GADPH为内参。GAPDH:上游引物5′-TGACTTCAACAGCGACACCCA-3′,下游引物5′-CACCCTGTTGCTGTAGCCAAA-3′;SF3B4:上游引物5′-GGGAAGCCAATACGGGTGAA-3′,下游引物5′-GTGATAGGACGGTTACAGAGGT-3′。
1.5应用短发夹RNA(shRNA)技术沉默AGS细胞SF3B4表达 取对数生长期的人胃癌细胞AGS制成3×104~5×104/mL的细胞悬液接种于6孔板中。细胞分为SF3B4沉默组(KD组,SF3B4 shRNA干扰序列为CTGAGATTGATGAGAAGTT)和对照组(NC组,含阴性对照病毒CON053),每组设置3个复孔。继续培养保证感染时细胞铺板量达到15%~30%,更换感染培养基,加入最适病毒量(慢病毒三质粒系统)进行感染,感染复数(MOI)为10。感染后8~16 h更换普通培养基培养,72 h收集细胞在荧光显微镜下观察并应用RT-qPCR检测SF3B4基因沉默效率。引物序列同上。采用2-ΔΔCt法计算SF3B4相对表达水平。
1.6RNA测序(RNA-seq) 收集KD组和NC组细胞,TRIzol法抽提总RNA,检测RNA纯度和完整性后,获取mRNA。NEBNex®UltraTMRNA Library Prep Kit建立测序文库,Qubit2.0 Fluorometer 初步定量,稀释至1.5 ng/μL,Agilent 2100生物分析仪对文库的插入片段检测,符合预期后,RT-qPCR 法对文库有效浓度进行准确定量(有效浓度高于2 nmol/L),以保证文库质量。应用Illumina测序仪对两组细胞进行RNA-seq。
1.7IPA(Ingenuity Pathway Analysis)分析 倍数变化|FC|>1.00(上调或下调)和错误发现率(FDR)调整P值<0.05被认为是差异表达,输入IPA系统(https://digitalinsights.qiagen.com/ products-overview/ discovery-insights-portfolio/analysis-and-visualization/qiagen-ipa/)进行分析。IPA包括经典通路分析、疾病功能分析和互作网络分析。经典通路分析:首先,基于差异基因列表与各个通路包含的基因集合,通过计算显著性(P<0.05)来找到表达差异基因主要富集在哪些通路中;接着,基于差异基因受调控信息(上调或下调),与文献[4]的调控信息相比较(|Z分数|>2),明确调控通路。根据P值鉴定和评价差异表达基因富集的典型信号通路,确定参与典型信号通路的Z分数和占比。Z分数表示信号通路的激活(Z分数>0)或抑制(Z分数<0)。通过将典型信号通路中的差异表达基因(DEGs)数除以通路中总基因数来计算占比。疾病功能分析:基于数据库分析差异基因在不同疾病与功能分类中的富集情况(P<0.05,|Z分数|>2)。互作网络分析:对每一个调控网络进行打分,该分值反映了同一个网络中DEGs的数量,同一个网络中包含差异基因的数量越多,则得分越高。
1.8关键基因验证 通过分析经典通路、疾病功能、互作网络等,选取SF3B4沉默后发生显著变化的多条通路中共同出现的部分关键基因,在AGS细胞上通过RT-qPCR检测SF3B4沉默后各关键基因的mRNA变化,与测序结果进行比较。
2 结 果
2.1SF3B4在人胃癌组织和细胞系中的表达水平及SF3B4基因沉默效率 SF3B4蛋白在胃癌组织中的表达显著高于癌旁组织(P<0.05),见图1A。SF3B4 mRNA在人胃癌细胞系AGS、HGC-27、KATO Ⅲ和MKN-74中呈高表达,在NCI-N87细胞系中表达水平一般,ΔCt值分别为4.53±0.06、6.62±0.07、4.15±0.16、6.38±0.19和14.88±0.32。慢病毒感染AGS细胞后荧光显微镜显示KD组和NC组大部分细胞表达绿色荧光蛋白,提示慢病毒感染效率较高,RT-qPCR检测结果显示,KD组SF3B4基因沉默效率达到80.0%,差异有统计学意义(P=0.015),见图1B、C。

注:A为SF3B4蛋白在人胃癌组织和癌旁组织中的表达;B、C为NC组和KD组AGS细胞的慢病毒感染效率及SF3B4 mRNA表达情况;与NC组比较,*P<0.05。图1 SF3B4在胃癌组织、AGS细胞系的表达情况及沉默效率
2.2RNA-seq测序结果 慢病毒介导shRNA技术在SF3B4高丰度表达的常见胃癌细胞AGS中进行沉默,比较KD组和NC组的SF3B4 RNA-seq结果,结果显示两组的基因表达分布标准化程度较好(图2A)。以表达|FC|≥1.00倍(上调或下调)且FDR<0.05作为标准,鉴定出DEGs共105个,其中上调基因数64个,下调基因数41个,见图2B。

图2 KD组和NC组的基因表达图及火山图
2.3显著富集的经典通路的鉴定 IPA 经典信号通路分析显示在富集到的203条经典通路中,29条转导通路中DEGs富集达到显著水平,主要为小窝蛋白介导的内吞信号、FAK信号通路、ERK/MAPK信号通路、神经源性一氧化氮合成酶(nNOS)信号传导、钙蛋白酶调控细胞力学等。本研究中两条转导通路Z分数=-1,说明这两条通路显著抑制,分别为坏死性凋亡信号通路和衰老通路。见表1。

表1 经典通路分析
2.4疾病与功能分析 IPA分析显示,DEGs与500种疾病和功能相关,根据其P值对这些相关疾病和功能进行评级,并选择前30个丰富的疾病和功能类别,见图3。结果表明,细胞生长、增殖、发育、运动等与SF3B4相关。除了这些关键的生物学过程,SF3B4与癌症、损伤、感染和代谢性疾病等多种疾病密切相关。通过Z分数分析发现,被激活的功能主要集中在细胞周期中,与细胞周期进程、有丝分裂相关,被抑制的功能主要集中在细胞形态、细胞功能和维持以及细胞运动中,与自噬、肿瘤细胞的迁移相关。
2.5互作网络分析 对DEGs进一步进行相互连接,构建IPA功能网络。共确定了6个IPA网络。这些IPA网络根据它们的得分进行排名。得分最高的IPA网络共包含22个DEGs,得分为47分,最低的IPA网络得分为17分,表明这些基因高度相关,见表2。共有3个IPA网络的得分>30分(网络1、2和3,得分分别为47、44和31分)。5个IPA网络富集了与细胞和组织生长相关的疾病和功能,包括细胞周期、细胞发育、细胞功能维持等,表明SF3B4对胃癌细胞发育的动态变化起重要作用。

表2 SF3B4抑制后的IPA功能网络
2.6关键基因的验证 选取多条通路中同时出现的关键基因进行mRNA的验证,结果表明SF3B4沉默后,DNAJA3、PPP3CB、VDAC1、FOXO3、EI24和DRAM2基因表达抑制,见图4。
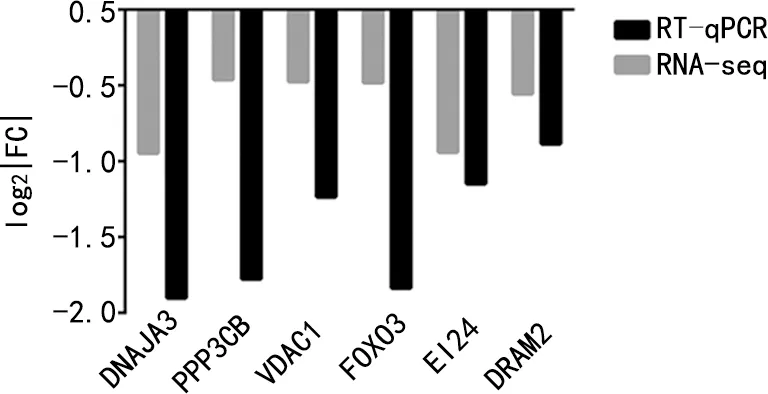
图4 RT-qPCR与RNA-seq的结果比较
3 讨 论
胃癌是我国常见的恶性肿瘤之一。胃癌发病机制的深入研究对胃癌早期诊断标志物的寻找极为重要。本研究基于免疫组化和IPA分析,探讨了SF3B4作为生物标志物的潜能及在人胃癌发生中的可能作用和机制,结果显示,SF3B4蛋白在胃癌组织中高表达,SF3B4 mRNA在人胃癌细胞系中呈高表达,其可能通过坏死性凋亡信号和衰老、自噬通路在肿瘤发生发展中起重要作用。SF3B4是U2型剪接体的重要组成部分[1],在pre-mRNA 剪接中起关键作用[5]。同时,SF3B4还在转录、翻译和细胞信号传导等方面发挥作用[6],并参与细胞周期、细胞分化和免疫缺陷的调控[7]。SF3B4突变与异常细胞生长有关,可造成肿瘤在内的多种疾病。但SF3B4是否在胃癌中发挥作用还鲜见报道。本研究显示,SF3B4在胃癌细胞中高表达,沉默SF3B4后坏死性凋亡信号和衰老通路显著抑制。进一步疾病与功能分析发现,SF3B4对细胞周期、细胞功能与维持、自噬和肿瘤细胞迁移通路有显著影响。IPA互作网络分析结果也发现SF3B4主要影响细胞周期、细胞形态、细胞运动、结缔组织发育和功能等。
本研究通过对IPA功能网络三个维度的研究发现,DNAJA3、PPP3CB、VDAC1、FOXO3、EI24和DRAM2在经典通路、疾病与功能、互作网络中高频出现。DNAJA3属于热休克蛋白家族,在细胞生长、增殖、分化、衰老、存活、凋亡和运动中起重要作用[8]。VDAC1位于线粒体外膜中,充当线粒体“看门人”,是线粒体功能的重要调节剂[9],除了控制能量来源和代谢外,该蛋白质在线粒体介导的细胞凋亡中发挥关键作用[10]。VDAC1的失调可造成肿瘤发生、转移[11]。FOXO3是叉头框O转录蛋白家族的成员,参与调节自噬、细胞凋亡、细胞增殖、细胞周期进展、细胞存活和DNA损伤[12]。FOXO3在胃癌中的作用与不同的分子机制有关,可能同时作为抑癌因子和癌基因。一方面,FOXO3与Parkin协同可抑制胃癌发展[13];但另一方面FOXO3可通过诱导组织蛋白酶L促进胃癌细胞迁移和侵袭[14]。DRAM2定位于溶酶体膜,在自噬诱导中发挥重要作用[15]。EI24在细胞生长的负调控和细胞凋亡的诱导中起重要作用,EI24还是一种自噬相关的跨膜蛋白,在自噬中发挥重要作用[16]。PPP3CB是钙调神经磷酸酶(CaN)催化亚基PPP3C中的三种亚型之一[17],CaN可使不同的转录因子去磷酸化,这些转录因子与重塑过程(包括炎症、肥大和自噬)具有病理生理学相关性,PPP3CB的失调与肿瘤有密切关系[18]。
本研究结果发现,DNAJA3、PPP3CB、VDAC1、FOXO3、EI24和DRAM2通过参与自噬、凋亡、增殖、细胞周期等生理作用,在肿瘤的发生发展中起作用。同时,本研究对以上6个基因进行了RT-qPCR验证,与测序结果一致,SF3B4沉默后,可引起这6个基因的表达下调。以上结果表明这6个基因可能与SF3B4促进胃癌发生的机制相关。
综上所述,SF3B4在胃癌组织和细胞系中高表达,可能是胃癌的潜在生物标志物。SF3B4可能通过细胞凋亡通路和自噬调控通路参与胃癌的发生发展,并与DNAJA3、PPP3CB、VDAC1、FOXO3、EI24和DRAM2等基因相关,可为胃癌发生发展的分子机制研究提供新思路。
