宫腔预处理对夫精人工授精结局的影响
2023-10-11庞益伟郭晓晓李学峰唐丽丽王雁林
庞益伟,郭晓晓,李学峰,唐丽丽,王雁林△
(滨州医学院附属医院:1.生殖医学科;2.内分泌科,山东 滨州 256603)
女性不孕症患者基本生育能力评估手段包括:排卵检查、输卵管通畅检查、阴道超声检查等,用以排除女性不孕症患者的子宫或卵巢及输卵管病变。在一项关于女性不孕症患者宫腔镜检查结果的研究中,子宫腔异常率约为46.3%[1]。因此,对子宫腔的评价被认为是不孕妇女生育力评估的一个重要步骤。目前,宫腔镜被认为是评估和处理宫腔异常的“金标准”。与非侵入性技术相比,如经阴道超声,子宫输卵管造影和超声下子宫输卵管造影,宫腔镜可以更精确地诊断子宫内膜异常。最重要的是,它可以同时治疗宫内病变[2]。夫精人工授精(IUI)是一种辅助生殖技术,其将男性精液进行洗涤优化制成精子悬液,通过特殊导管将精子悬液注入女性宫腔,使精卵自然结合达到妊娠生育目的。因为子宫腔及其内层,即子宫内膜,是人类胚胎着床的重要场所。子宫因素,如息肉、粘连和慢性炎症等,会对女性生育力产生负面影响。本研究回顾性分析964个IUI治疗周期,探究IUI术前行宫腔镜检查预处理宫腔是否会对IUI妊娠结局产生影响。
1 资料与方法
1.1一般资料 选取2017年1月至2021年10月滨州医学院附属医院生殖医学科行IUI治疗的964对夫妇的964个周期。入选标准:首次行IUI助孕;女方输卵管检查提示双侧输卵管均通畅;男方精液正常或轻度少弱精子症。
1.2方法
1.2.1宫腔检查 宫腔镜检查与否,视患者进行IUI助孕前常规检查时B超结果及月经周期决定,助孕前B超提示子宫内膜异常,如异常强回声、回声不均匀、内膜不连续等的患者,则行宫腔镜检查。其他患者如果月经周期正处于或即将处于宫腔镜检查的时间窗,则该患者本次月经周期行宫腔镜检查,所有检查完善且无异常后进入IUI助孕周期。如果患者已经错过宫腔镜检查时间窗,则不行宫腔镜检查,所有检查完善且无异常后进入IUI助孕周期。宫腔镜检查在患者月经周期的增殖早期(经净3~7 d)进行。术前完善妇科检查及阴道分泌物检查,排除盆腔炎及阴道炎症。采用的内窥镜摄像、冷光源系统及TROPHYscope®CAMPO一体式宫腔镜为德国卡尔史托斯公司生产,医用灌注泵为桐庐精锐医疗器械有限公司生产。患者在无麻醉的情况下完成检查,取膀胱截石位,常规消毒外阴及阴道,接通医用灌注泵及宫腔镜设备,膨宫压力110 mm Hg,液体流速0.3 L/min,生理盐水膨宫,缓慢进镜,观察宫腔及宫颈管。检查期间记录手术信息和图像。术中遇到简单的息肉或粘连时,更换操作鞘管,一并执行手术操作。较大息肉及复杂宫腔粘连收入院在全身麻醉下手术。如为慢性子宫内膜炎,术后给予抗生素治疗。如镜下内膜明显增厚或凹凸不平,则行子宫内膜活检术,送病理检查。
1.2.2卵泡监测
1.2.2.1自然周期 适用于月经周期规律的患者,根据月经周期情况,于月经周期的第9~11天开始B超监测排卵。卵泡直径<10 mm者,可以3 d监测1次;卵泡直径10~14 mm者,可以2 d监测1次;卵泡直径>14 mm者,开始检测尿LH峰并每1~2天超声监测卵泡的大小。
1.2.2.2促排卵周期 促排卵适应证:(1)排卵障碍:如多囊卵巢综合征(PCOS)、下丘脑性闭经等;(2)原因不明不孕;(3)自然周期卵泡发育不良;(4)年龄较大(≥35岁)。用药方案:(1)来曲唑诱导排卵:月经第3~5天开始每天用来曲唑2.5~5 mg,共用5 d,停药2~4 d复诊,B超监测卵泡大小和子宫内膜的情况。(2)促性腺激素诱导排卵:月经第3~5天开始用尿促性腺激素(HMG),每日应用37.5~75.0 IU,7 d后开始监测卵泡发育,如果超声监测显示卵泡生长正常,维持原剂量;如果用药7~14 d,仍无优势卵泡生长,增加HMG 37.5 IU或75 IU,3~7 d后继续监测卵泡的生长。(3)来曲唑加HMG诱导排卵:经期第3~5天开始每天用来曲唑2.5~5 mg,共用5 d,月经周期第4、6、8或5、7、9天加用HMG 75~150 IU,停药2~3 d后复诊,B超监测卵泡大小和子宫内膜的情况,及时调整药物用量。当优势卵泡直径在14 mm以上时,开始检测尿LH峰并每1~2天超声监测卵泡的大小。
当以下各项条件中至少有一项达到标准,则可认为卵泡已成熟:(1)阴道B 超检查有1个或2个以上优势卵泡直径达到18 mm;(2)动态观测血E2水平,平均每个主导卵泡达到700 pmol/L以上;(3)血LH>30 IU/L或尿LH定性阳性。
1.2.3IUI手术操作 卵泡成熟酌情决定是否肌肉注射人绒毛膜促性腺激素(HCG)5 000~10 000 IU或皮下注射促性腺激素释放激素激动剂(GnRH-α) 0.1~0.2 mg。(1)血生长激素(LH)>30 IU/L或尿LH定性阳性当天直接行IUI;(2)血LH<10 IU/L或尿LH定性阴性注射人绒毛膜促性腺激素(HCG)/GnRH-α 24~36 h人工授精;(3)血LH 10~<30 IU/L或尿LH定性弱阳性,注射HCG/GnRH-α 12~24 h内人工授精。
患者术前排空膀胱,取膀胱截石位。臀部铺一次性消毒垫,暴露外阴。用0.9%氯化钠液清洗外阴阴道,拭净宫颈分泌物。以1 mL注射器连接无损伤性宫腔内授精管,吸取经优化处理后精液0.3~0.5 mL,沿宫颈管走向缓慢置入授精管,进入宫颈内口并超过宫颈内口1.0~1.5 cm,缓缓注入宫腔中。嘱患者平卧休息15~30 min。术后次日作B超监测,如优势卵泡破裂,再行手术1次;如未破裂,继续监测排卵24 h,排卵后再次人工授精。术后给予黄体支持。
1.2.4精液处理 精液标本采集前至少禁欲2 d,但不超过7 d,以保证精液质量。精液处理在液化后开始进行,时间不超过1 h。取1 mL 90% SpermGrad置于离心管底部,再将1 mL 45% SpermGrad沿管壁缓缓加入,使其分层。待密度梯度液恢复至室温,将已液化的精液加至上层,300 g离心20 min,弃上清;加入含G-IVF PLUS培养液3 mL混匀,300 g离心5 min,弃上清;加入G-IVF PLUS培养液0.5~1 mL混匀,置圆底试管,取一滴镜检,记录精子浓度、PR,置37 ℃、6% CO2培养箱备用。
1.2.5黄体支持 手术次日起每日给予地屈孕酮20~30 mg口服,或黄体酮20 mg肌内注射,共14 d;加或不加HCG 2 000 IU 隔天肌内注射1次,共3次;对于有过自然流产史的患者酌情联合用药加强黄体支持。对于排卵前子宫内膜厚度不足8 mm患者可以适当补充雌激素(如补佳乐)2~4 mg/d。
1.2.6妊娠结局 IUI术后14~16 d复诊,确定是否HCG阳性。HCG阳性后的2~3周复诊,确定是否为临床妊娠。B超观察到妊娠囊为临床妊娠。临床妊娠包括宫内妊娠、异位妊娠、宫内外复合妊娠。流产是指发生在28周之前的妊娠丢失,胎儿体重不足1 000 g。

2 结 果
2.1两组患者基本临床特征 共纳入964个周期,其中观察组616个周期,对照组348个周期。两组在原发不孕占比、促排卵周期占比、年龄、不孕年限、基础促卵泡激素(bFSH)、基础黄体生成素(bLH)、抗穆勒氏管激素(AMH)、体重指数(BMI)、处理后前向运动精子总数、手术日内膜厚度等方面的临床特征比较,差异均无统计学意义(P>0.05)。见表1。

表1 两组患者基本情况比较
2.2两组妊娠结局比较 观察组临床妊娠率、异位妊娠率、活产率均高于对照组,差异均无统计学意义(P>0.05)。观察组流产率明显低于对照组,差异有统计学意义(P<0.05)。见表2。
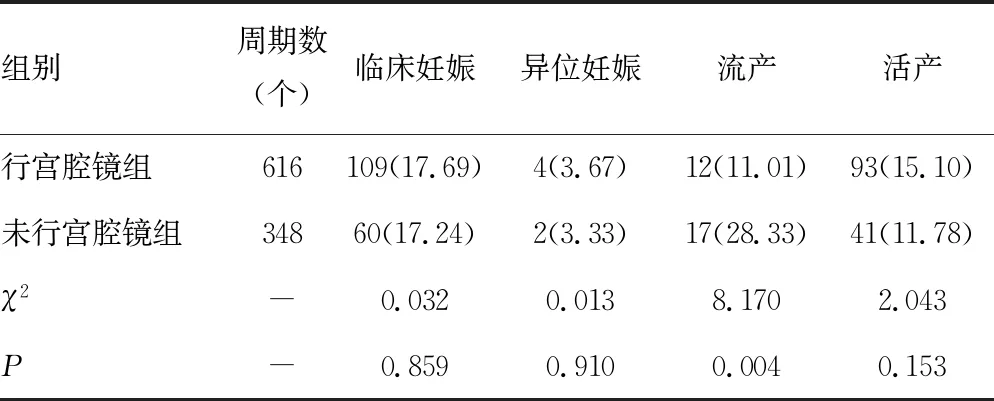
表2 两组妊娠结局比较[n(%)]
2.3行宫腔镜组宫腔情况及妊娠结局 宫腔镜下主要病变由子宫内膜息肉、慢性子宫内膜炎、宫腔粘连、子宫畸形(均为单角子宫)、子宫内膜增厚(病理证实为正常子宫内膜)。其中子宫内膜息肉和慢性子宫内膜炎发病率最高。宫腔镜正常组异位妊娠率最高,子宫内膜增厚组有最高的临床妊娠率和活产率,差异均无统计学意义(P>0.05)。见表3。

表3 行宫腔镜组妊娠结局比较[n(%)]
3 讨 论
当受精卵成功植入子宫腔的内膜层时,人类的生命就开始了。来自宫腔和子宫内膜的异常,如子宫内膜息肉、慢性子宫内膜炎、子宫畸形和宫腔粘连等,可能会干扰这一事件。因此,通过使用非常小直径的宫腔镜来去除这些异常,可能会增加自发怀孕的机会或者改善辅助生殖技术,如人工授精或体外受精-胚胎移植的妊娠结局[3]。
子宫内膜息肉的发生与雌激素刺激和局部慢性炎症有关。子宫内膜息肉可以阻塞宫颈管或输卵管,从而阻碍精子运输。产生类似宫内节育器的内膜炎性反应,阻碍胚胎植入子宫内膜等。另外,子宫内膜息肉中的基质金属蛋白和细胞因子水平升高,对精子存活、精卵结合和胚胎发育有不利影响。研究提示,切除息肉可以增加不孕患者的自然妊娠率,尤其是对于不明原因不孕的患者,妊娠率可从43%增加至80%[4]。宫腔镜下子宫内膜息肉切除术在直视下操作,治疗准确性和有效性较高。一项荟萃分析纳入8项研究,共2 267例患者。结果显示,宫腔镜下切除子宫内膜息肉(平均大小< 2 cm),能够增加宫腔内人工授精患者的临床妊娠率[5]。
慢性子宫内膜炎对生育有潜在的不利影响,可能是宫腔微生物与子宫内膜免疫之间的相互作用,造成不适当的宫腔微环境,干扰正常着床及妊娠的维持[6]。近年来,有研究表明,慢性子宫内膜炎可能与不孕症、反复流产及反复种植失败的发生相关,CE在不同疾病的患病率有所不同。重复体外受精失败女性的患病率估计范围为13.95%~57.55%,复发性流产女性的患病率为7% ~56%,异常子宫出血女性的患病率为1.4%~52.0%。而改善子宫内膜的炎症状态,可以提高患者的妊娠率[7]。慢性子宫内膜炎的主要病因是子宫腔内的微生物感染,抗生素治疗可改善慢性子宫内膜炎患者的妊娠结局。张朝玉等[8]研究表明,当宫腔镜联合CD138诊断为慢性子宫内膜炎时,经规范抗生素治疗并复查,与非治愈组比较,治愈组体外受精和胚胎移植(IVF-ET)周期的临床妊娠率(53.57%和36.36%)和活产率(46.43%和27.27%)显著增加。本研究中宫腔镜诊断慢性子宫内膜炎组流产率较高,可能与部分患者未治愈有关。后续研究中可在抗生素治疗后行内膜活检评估治疗效果。
宫腔粘连多继发于子宫手术后。据报道,有过流产手术史的妇女中,宫腔粘连的发生率为6%~30%。分娩后行刮宫的妇女中,宫腔粘连的发病率可高达25%。中期妊娠流产重度宫腔粘连发生率(69.6%),明显高于早期妊娠流产(36.7%)[9]。宫腔镜是临床上常用的IUA诊断和治疗方法。直接手术能即刻减少宫内粘连,但由于高促炎因子水平、低激素水平和子宫内膜损伤,复发率高达40%。因此,与手术切除粘连组织相比,预防术后复发更具挑战性。粘连分离术后可采取放置宫内屏障预防粘连再次形成,同时可以采用雌激素治疗、羊膜治疗、干细胞治疗及富血小板血浆等促进子宫内膜再生[10]。另外,手术选择冷刀或者电切,也会对术后复发率和妊娠率产生不同影响。刘敏等[11]的一项包含169例宫腔粘连患者的研究表明,宫腔镜冷刀分离宫腔粘连患者102例,术后复发率为14.71%,妊娠率为47.06%;电切分离宫腔粘连患者67例,术后复发率为31.34%,妊娠率为26.87%,差异均有统计学意义(P<0.05)。宫腔粘连的严重程度,也会影响手术效果和术后妊娠结局。陈芳等[12]的一项包含145例中-重度宫腔粘连患者的研究显示,宫腔粘连分离术后总体妊娠率为46.9%(68/145),其中自然妊娠率为54.4%(37/68),人工辅助妊娠率为45.6%(31/68);41.2%(28/68)的妊娠患者于孕发生早期流产,58.8%(40/68)获得活产。本研究中宫腔粘连术后妊娠率及活产率低于文献报道,可能与样本量较小有关。总之,宫腔粘连的治疗,关键是要注意保护残留内膜,促进术后内膜再生,预防再粘连形成。
子宫发育异常是在胚胎发育过程中,双侧副中肾管出现异常,导致先天性子宫形态和功能异常的一系列表型。普通人群中的患病率为0.1%~2.0%,其中约有4%患有不孕症。在拟行辅助生殖技术(ART)的不孕患者中,子宫发育异常发生率为12.3%[13]。CORROENNE等[14]研究表明,经宫腔镜切除子宫纵隔可以提高术后1年的自然妊娠率,另外,也有利于改善辅助生殖技术助孕结局。对于不孕合并弓形子宫或T形子宫的患者,如果存在反复ART助孕失败或妊娠丢失,则建议行宫腔镜手术。对于单角子宫、双角子宫和双子宫患者,手术能否改善其妊娠结局尚存争议。范丽娟[15]回顾性分析了34例单角子宫患者行IUI助孕的妊娠结局,与同期单侧输卵管梗阻行IUI的68例患者对比,单角子宫组有较高的生化、临床妊娠率和活产率,但差异无统计学意义(P>0.05)。本研究中5例子宫发育异常均为单角子宫,均未妊娠,可能与样本量较小有关。
本研究中17例宫腔镜提示子宫内膜增厚患者,子宫内膜活检均提示增生期子宫内膜,这部分患者能够获得最高的临床妊娠率,且全部活产。有研究提示人工授精术前对子宫内膜进行轻柔搔刮处理,对宫腔具有机械扩张的作用,有提升子宫内膜容受性的作用,增加夫精人工授精妊娠成功率[16]。宫腔镜检查过程中的机械刺激,以及子宫内膜活检的操作,可能改善子宫内膜容受性,对提高该组患者临床妊娠率起到积极作用。
本研究结果显示,行宫腔镜检查组总体异常率(39.94%,246/616)较高,对宫腔异常的积极处理对改善患者的不孕状态起到积极的作用。因此,在数量庞大的不孕症群体和较高的宫腔异常发生率的前提下,建议双侧输卵管通畅的不孕症患者,行人工授精助孕前完善宫腔镜检查。因此能够有效降低流产率,并对提高活产率起到积极的作用。