合并心包积液及胸腔积液的血液病患儿行胸腔镜手术1例报道
2023-10-11杜艺敏
王 祥,余 帅,钟 良,杜艺敏
(华中科技大学同济医学院附属武汉儿童医院:1.麻醉科;2.心胸外科;3.护理部,湖北 武汉 430000)
对于合并大量心包积液和胸腔积液的患者往往需要行胸腔镜手术治疗,在胸腔镜下行心包切开引流时,围手术期麻醉需要警惕:麻醉诱导期间出现心动过缓和低血压、围手术期血流动力学剧烈波动,术后复张性肺水肿等。围手术期超声可以观察心包积液量和胸腔积液量、床旁监测心肺功能,评估术后肺部并发症等。麻醉医生在围手术期需要根据患者情况,制订个体化的麻醉方案,与外科医生紧密配合,确保患儿围手术期生命安全。
1 临床资料
患儿,男,16岁,体重47 kg,身高174 cm。主诉为:确诊急性淋巴细胞性白血病2年余,返院输血。现病史:患儿于2019年12月在外院诊断为急性淋巴细胞性白血病,然后按序开始化疗,化疗期间予以抗感染、输血、提高白细胞水平等治疗,期间仍有反复发热等不适,患儿于2022年8月26日在华中科技大学同济医学院附属武汉儿童医院血液内科门诊复查,门诊以“急性淋巴细胞性白血病”收入院。入院后完善体格检查:体温36.4 ℃、呼吸21次/分、脉搏109次/分,血压102/61 mm Hg(1 mm Hg=0.133 kPa)。患儿发育良好,营养中等,神志清楚,面色苍白,呼吸音正常,双肺未闻及干湿性啰音,心律整齐,心音正常,心脏杂音未闻及,腹部外形正常,肝脾肋下未触及,脊柱及四肢活动正常,病理征阴性。入院后完善实验室检查,血常规提示红细胞计数2.32×1012L-1、血红蛋白73 g/L、白细胞计数1.68×109L-1、血小板43×109L-1,C反应蛋白14.95 mg/L,肝功能提示总蛋白62.3 g/L、白蛋白45g/L。心电图提示:窦性心律,正常心电图。心脏彩色多普勒超声提示:左室稍大、左室功能正常、心包积液(建议复查)。肺部CT(图1)提示:双肺肺炎、右肺部分实变,右侧胸腔积液及心包积液、气管性支气管。急诊床旁胸部超声提示:双侧胸腔积液,右侧量较大(坐位时,右侧胸腔腋后线至肩胛线可见无回声区,最大前后径4.5 cm,其内可见肺叶飘动),右下肺呈实样变。患儿目前偶诉胸闷,存在多浆膜腔积液,有纵隔压迫致呼吸困难、心脏压塞等风险,遂请心胸外科医生会诊,会诊意见为:建议完善术前检查,择期在全身麻醉下行胸腔镜探查术。
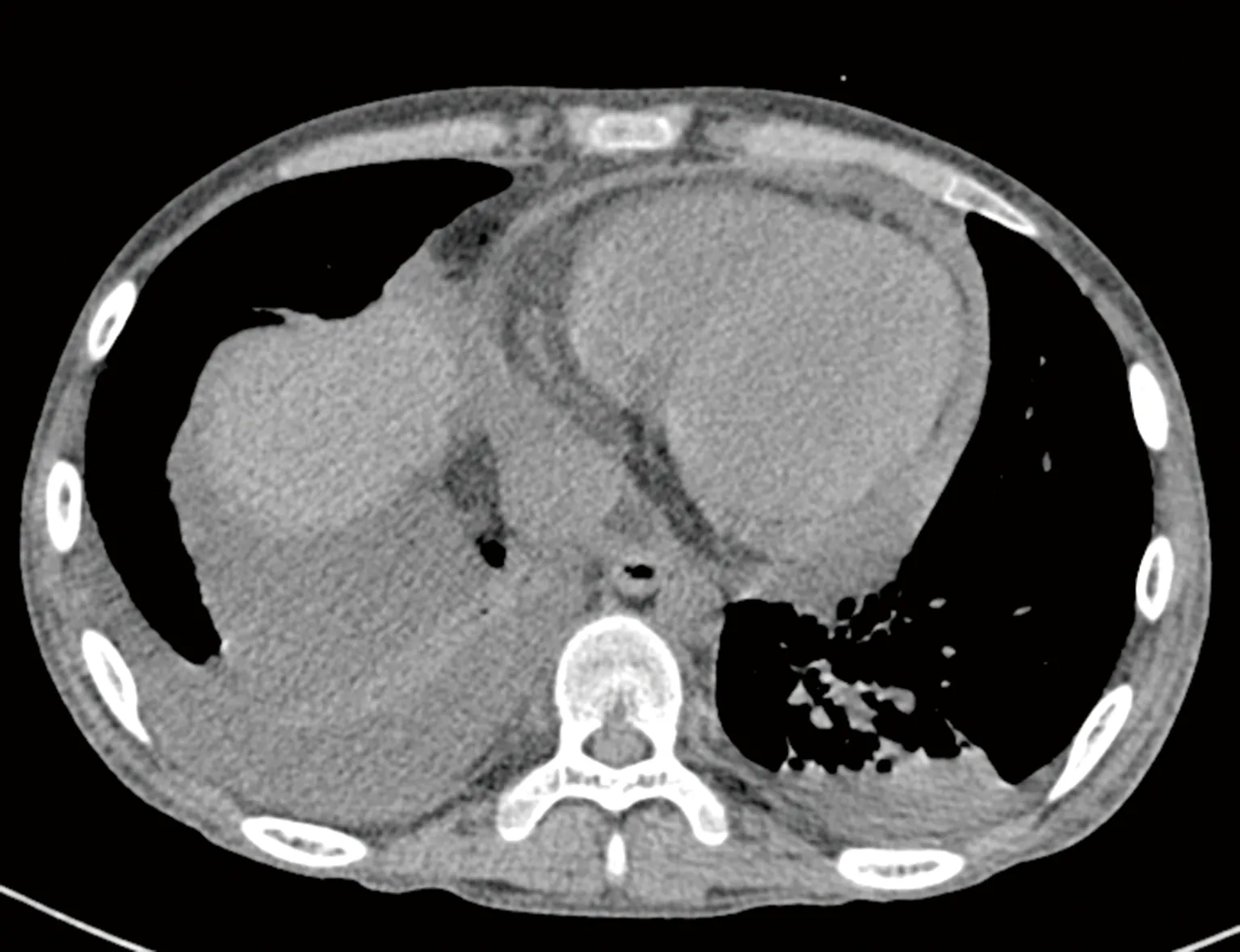
图1 肺部CT
麻醉及手术经过:患儿入手术室后常规吸氧、行心电监护,开放静脉通道。在局部麻醉下行右侧桡动脉穿刺并连接动脉换能器持续监测动脉血压,麻醉诱导药物为依托咪酯10 mg、芬太尼0.2 mg、顺势阿曲库铵12 mg,3 min后行气管插管,置入6.5号单腔气管导管,深度固定在22 cm。调整呼吸机通气模式为PCV-VG模式,潮气量设置为300 mL,呼吸频率16次/分,根据血气分析及呼气末CO2调整通气参数。术中持续泵注异丙酚6 mg/(kg·h)复合瑞芬太尼0.1 μg/(kg·min),同时吸入七氟醚1%维持麻醉,术中间断追加肌松剂。麻醉诱导平稳后,取左侧卧位,常规消毒铺巾,建立人工气胸,期间麻醉机提示气道压力最高至30 cm H2O,血气分析提示CO2分压高至60 mm Hg,调整吸入氧浓度为100%,术中氧饱和度维持在90%以上。胸腔镜下可见血性胸腔积液,吸引器吸引约1 000 mL,同时可见右肺与前胸壁广泛粘连,分离胸膜粘连后检查心包,可见心包显饱满,提起并打开心包,吸引心包积液约200 mL。术毕冲洗胸腔,逐层缝合胸壁。术中输注林格液体1 500 mL,术中出血50 mL,手术时间1.5 h,尿量300 mL。术毕将患儿调整为平卧位,麻醉医生进行膨肺、吸引口腔及气管内分泌物,停麻醉药后,待患儿呼吸平稳后拔除气管导管送入心胸外科监护室。术毕床旁超声提示胸腔积液、心包积液术后。于次日随访,患儿无并发症,病情平稳后择期转入血液内科继续治疗。
2 讨 论
儿童白血病主要以急性淋巴细胞性白血病为主,其次为急性髓细胞性白血病[1]。临床表现主要为贫血、发热、感染、肝脾淋巴结肿大等,有部分患儿髓外的临床表现为多浆膜腔积液如心包积液[2]。白血病的治疗主要以化疗为主,治疗期间需要注意化疗药物的不良反应,尤其是蒽环类化疗药如柔红霉素,可以造成心电图异常、心肌酶及心功能的异常。对于拟行手术的白血病患儿,术前需要回顾病史,了解病程进展及治疗效果。对于化疗的患儿其免疫力往往较低下,临床麻醉操作过程中需要严格无菌操作,避免院内感染和多重耐药菌感染。其次要关注患儿血常规检查及凝血功能,避免在临床穿刺操作过程中或有创操作时,由于血小板及凝血功能异常造成血肿及相关并发症。
正常情况下,心包的脏壁两层之间有少量的浆液。心包积液的病理生理改变为:当心包积液量较大时,会影响心脏舒张功能,限制右心血液回流,进而出现低心排和代偿性心率增快,而静脉回心血量减少时,血液则瘀滞在腹腔及门静脉系统。相应的临床症状为心音遥远低钝、静脉压升高、颈静脉怒张、奇脉(吸停脉)等。对于拟行心包切开术的患者,麻醉及围手术期需要警惕:术前合并呼吸困难、入室时低氧及低血压、心房/心室压迫是心包积液患儿围手术期发生不良事件的危险因素[3]。其次,在麻醉诱导时,由于大多数全身麻醉药具有心血管系统抑制作用,对于心包填塞的患儿,全身麻醉药应选择对循环抑制轻的药物如依托咪酯、咪唑安定、氯胺酮、泮库溴铵等。氯胺酮可以激活交感系统而增加心输出量,从而减少低血压的发生。泮库溴铵可使心率轻度增快,配伍使用其他全麻药时对循环系统抑制轻。此外,还需要注意:在麻醉诱导期正压通气有时可能是致死性的,因为正压通气会使静脉回流进一步减少,而出现低血压及休克的危急情况。术前需要维持足够的血容量以维持前负荷,必要时使用心血管活性药物来维持心输出量。术中剥离心包时,可能发生大出血、心律失常、急性右心衰等危急情况[4],必要时使用体外循环技术(CPB)或体外膜肺氧合技术(ECMO)。若合并心包缩窄或粘连,需注意术中术者的操作步骤,警惕手术相关的并发症,如心包剥脱后回心血量骤增引起的循环衰竭。心包剥脱后维持出入量平衡即可,术毕仍需警惕复张性肺水肿的发生。对于行胸腔镜手术的患者,麻醉医生需要掌握剖胸和侧卧位对呼吸和循环的影响,根据术者要求决定是否需要行单肺通气(OLV),如需行单肺通气,要尽量减少围手术期低氧血症及急性肺损伤(ALI)的发生,合理的通气参数设置能有效降低低氧血症和高碳酸血症的发生[5]。术毕需要综合评估,待患者的血流动力学稳定及自主呼吸恢复良好后,可酌情拔除气管导管。
围手术期床旁超声(POCUS)对于合并心包积液及胸腔积液的患儿行胸腔镜手术有重大应用价值。在术前,床旁超声可用于评估心包积液量和胸腔积液量。通过经胸壁超声心动图(TTE)检查,选择心尖四腔心切面或剑突下四腔心切面可见整个心包腔内积液量[6]:心包积液量较少时(<100 mL),心包积液常聚集在左心室后壁及房室瓣环远端;大量心包积液(>500 mL)时,除左心室后壁,其他部位如左房后壁也可见液性暗区,甚至出现心脏摆动。心脏超声除了评估心包积液量外还可观察心脏的瓣膜、心室腔、心室壁等结构,评估心脏的收缩及舒张功能,也可在心脏超声实时引导下行心包穿刺术。此外,术中还可使用经食道超声检查(TEE)评估心功能状态[7],经食道超声相对于体表超声的优势是可以实时连续的监测心功能,术中能在直视下观测心脏泵血情况,尤其是心包填塞时可能会出现心率减慢及心脏射血无力的情况,还可以通过评估下腔静脉(IVC)及下腔静脉变异率来评估中心静脉压及血容量状态。
近年来,床旁肺超声(LUS)在围手术期的应用有了极大的进展,常见的肺超声征象为A线、B线、肺实变、窗帘征、蝙蝠征、肺组织肝样变等。当出现胸腔积液时,胸腔内可见无回声区,壁胸膜和脏胸膜分开[8]。少量胸腔积液(<500 mL)表现为仰卧位液体宽度<20 mm,或者坐位液体不超过膈顶。当液体宽度>40 mm或坐位液体超过第6肋间隙时,提示大量胸腔积液(>1 000 mL)。床旁肺超声除了评估胸腔积液量外,也可在超声引导下行胸膜腔穿刺术。此外,可根据术中不同时点的肺超声图像的异常改变,指导呼吸机参数的设置,比如通过肺复张手法,可使肺部超声征象从肺实变(碎片征或支气管充气征)改变至肺充气状态(碎片征减少或消失),也可对胸前区各部位进行肺超声扫查后进行综合评分,对肺内通气状态进行半定量评估,从而指导呼吸机参数的设置[9]即实施保护性肺通气策略(LPVS)、行个体化的呼气末正压(PEEP)的滴定、实施肺复张策略(RMs)。术毕,通过床旁超声综合评估心、肺、膈肌等器官的功能状态,可有效预测术后能否拔出气管导管,评估术后是否出现呼吸困难的情况[10],通过测量不同时间点膈肌厚度(吸气末和呼气末)、膈肌移动度并计算出膈肌厚度变化率(DTF),用以指导临床上拔管撤机的时机。
结合该病例,术前已通过心脏超声检查和肺超声检查评估心包积液量和胸腔积液量,在麻醉诱导前即进行了桡动脉穿刺,如此能快速评估围手术期血流动力学的变化。在麻醉诱导时,既要避免因为麻醉过浅造成心动过速而出现低心排的状况,又要避免麻醉过深造成心脏抑制出现心动过缓及低血压休克的情况。术中合理设置呼吸机参数,进行合理的液体管理,控制适当的麻醉深度,维持围手术期血流动力学稳定,通过与外科医生、护士的紧密配合,顺利完成该例胸腔镜手术,术毕再次行床旁超声检查评估积液量,避免术后肺水肿的发生,确保患儿围手术期生命安全。