乳腺癌脑转移差异基因的生物信息学分析*
2023-10-11吴双丽徐敬宣
吴双丽,徐敬宣,邢 龙△
(青岛滨海学院附属医院:1.神经内科;2.肿瘤内科,山东 青岛 266500)
脑转移是一个毁灭性的恶性肿瘤并发症,影响约20%的癌症患者[1]。乳腺癌是女性最常见的恶性肿瘤,近年来随着新疗法的引入,乳腺癌的治疗发生了巨大变化。但是由于患者生存期的延长及血脑屏障的存在,脑转移的发病率持续上升,这给肿瘤学专家带来了挑战,同时也导致患者生存时间和生存质量显著下降[2]。从历史上来看,将患有脑转移的乳腺癌患者排除在临床试验之外,使得治疗选择更加有限。低存活率及较高的致残率迫使人们寻找新的治疗方法,以提高治疗成功的概率。近年来,分子靶向药物在众多恶性肿瘤的治疗中取得了骄人的成绩,但分子靶向治疗在乳腺癌脑转移中研究尚少,因此研究乳腺癌脑转移发生、发展的分子机制,进而制定有针对性的治疗策略将造福众多乳腺癌脑转移患者。微阵列技术已被用于众多恶性肿瘤的致癌基因研究中,发现了许多具有重要科研及临床价值的核心基因,本研究通过对乳腺癌脑转移组织基因芯片进行生物信息学分析,以期发现具有与患者预后相关核心基因。
1 材料与方法
1.1基因芯片数据集选取 以“breast cancer”和“brain metastases”为检索词在线数据库GEO(http://www.ncbi.nlm.nih.gov/geo)上检索基因芯片数据集,从检索出的数据集中选取GSE1259892(平台:GPL571HG-U133A_2] Affymetrix Human Genome U133A 2.0 Array)进行研究,该芯片集中有乳腺癌组织及乳腺癌脑转移组织样本各16例。
1.2方法
1.2.1筛选差异基因 分别通过在线工具GEO2R(http://www.ncbi.nlm.nih.gov/geo/geo2r)选出芯片集中乳腺癌脑转移组织与乳腺癌组织的差异表达基因(DEGs)。筛选条件为|logFC|>2和校正P<0.05。以logFC>2、logFC <-2作为上下调基因的筛选标准。
1.2.2DEGs的KEGG和GO富集分析 通过在线数据库DAVID(https://david.ncifcrf.gov/home.jsp)对筛选得到的DEGs进行GO(Gene Ontology)功能富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析,以校正P<0.05为差异有统计学意义。GO功能富集分析主要包括生物过程(BP)、细胞成分(CC)、和分子功能(MF)。
1.2.3PPI网络构建及核心基因筛选 使用在线工具STRING构建DEGs的蛋白互作网络(PPI),并利用CytoHubba 插件进一步对差异基因编码蛋白相互作用进行可视化处理,利用CytoHubba插件筛选度(Degree)位于前10位的为核心基因。
1.2.4核心基因生存分析 将10个核心基因导入在线工具Kaplan-Meier Plotter(http://kmplot.com/an-alysis/index.php?p=background)选择OS进行生存分析,以P<0.05为条件筛选出与预后明显相关的核心基因。
2 结 果
2.1筛选差异表达基因 将芯片结果标准化后,鉴定出GSE125989中共筛选出72个DEGs,其中上调基因6个,下调基因66个。见表1。

表1 差异表达基因
2.2差异基因GO及KEGG富集分析 GO功能注释显示BP在细胞外基质组织、胶原原纤维组织、细胞黏附等方面显著富集;CC主要在胞外区、细胞外基质、细胞外的外来体等方面显著富集;MF主要在细胞外基质结构成分、细胞外基质具有抗拉强度的结构成分、胶原结合区等方面显著富集。见图1A。KEGG通路主要在蛋白质消化吸收、ECM受体的交互作用、癌症中的蛋白聚糖等方面富集(图1B)。
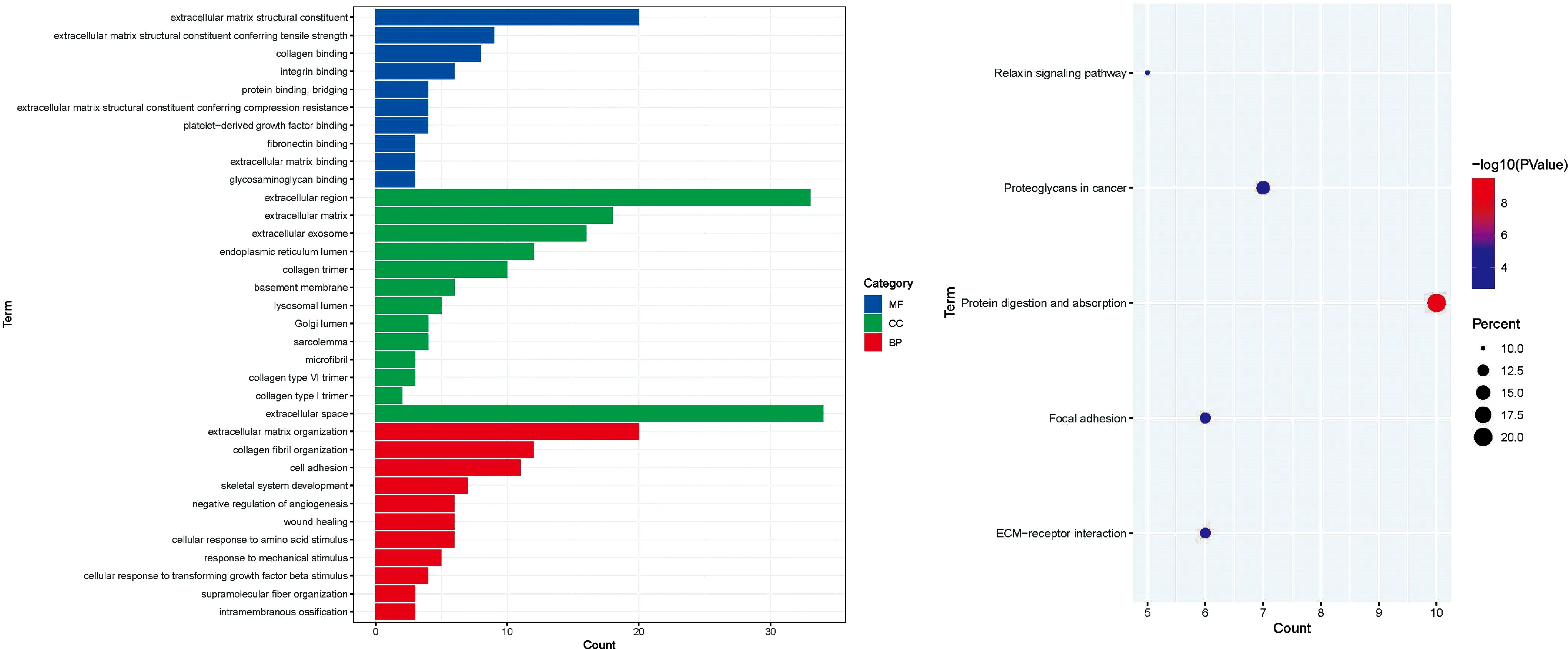
图1 差异基因GO和KEGG富集分析
2.3PPI蛋白互作网络构建 STRING数据库构建DEGs的PPI网络,并利用CytoHubba 插件以进一步对DEGs编码蛋白相互作用进行可视化处理,上、下调的基因被标记为红色和绿色(图2)。利用 CytoHubba 插件以度来筛选 PPI 网络中相互作用排名前10 位的 DEGs 作为核心基因。见图3。
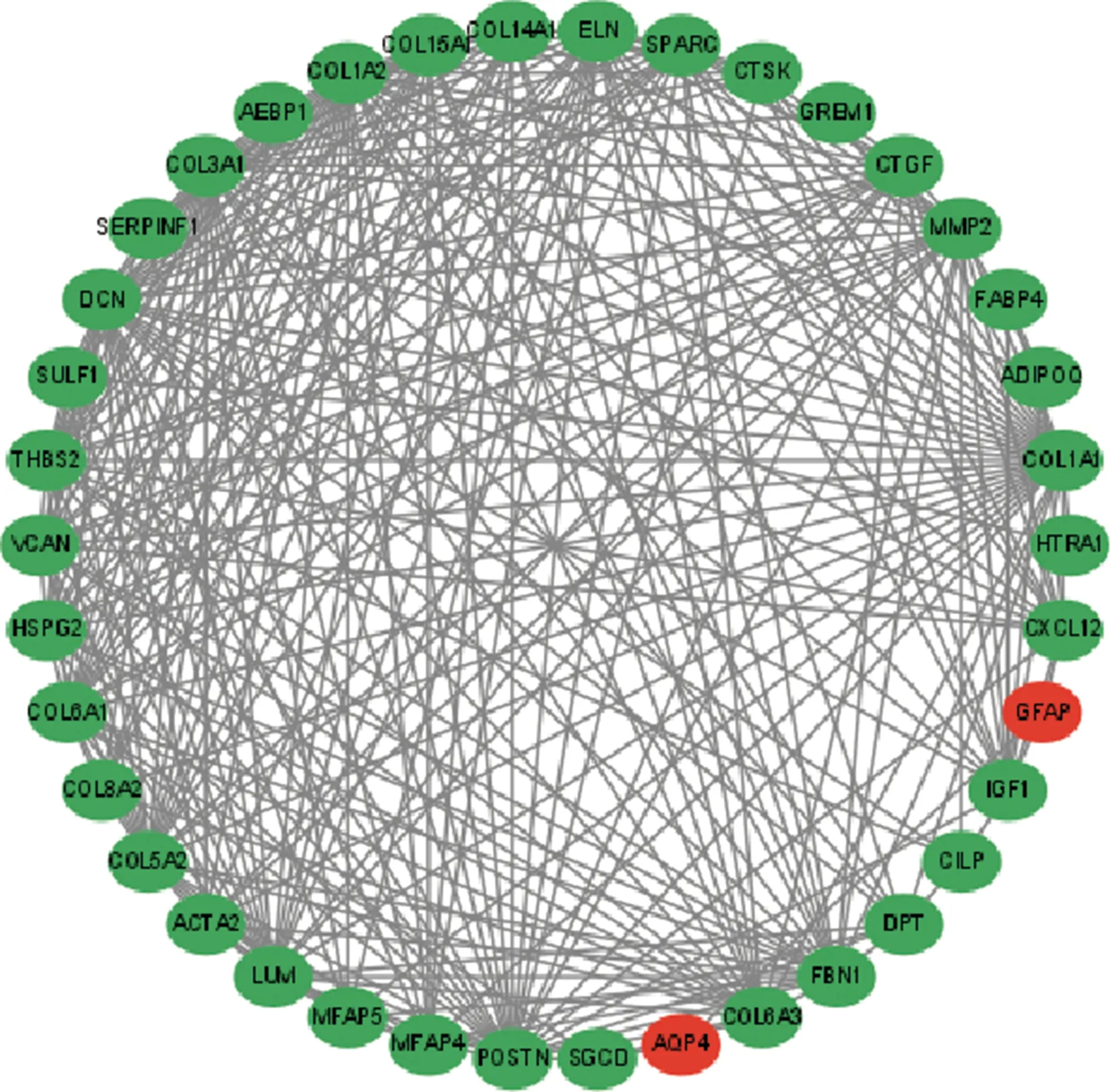
图2 PPI网络互作图
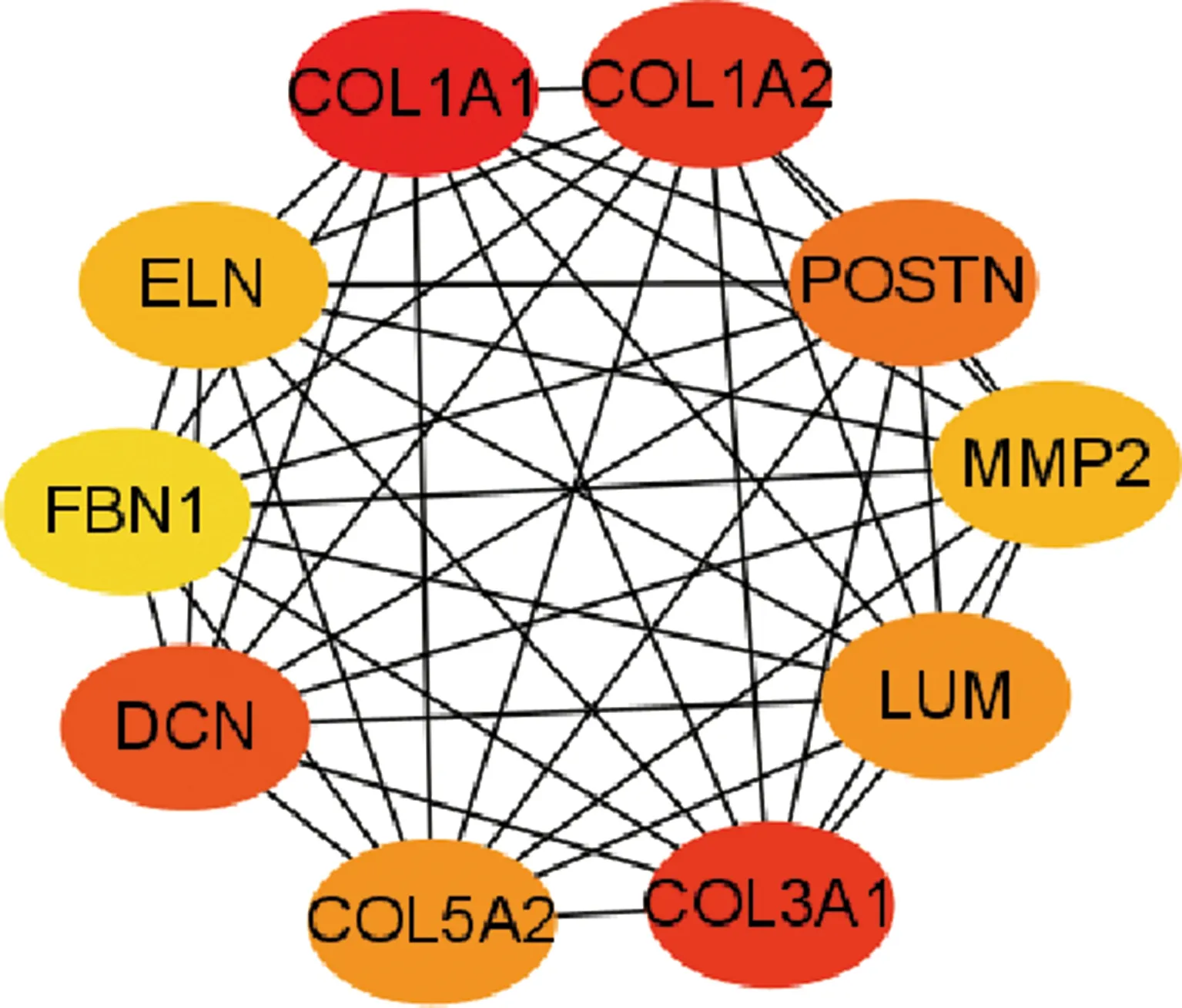
图3 核心基因PPI网络互作图
2.4核心基因生存分析 使用在线工具Kaplan-Meier Plotter进行生存分析,得到核心基因与患者总生存期(OS)关系,其中DCN、ELN与患者OS具有显著相关性。见图4。
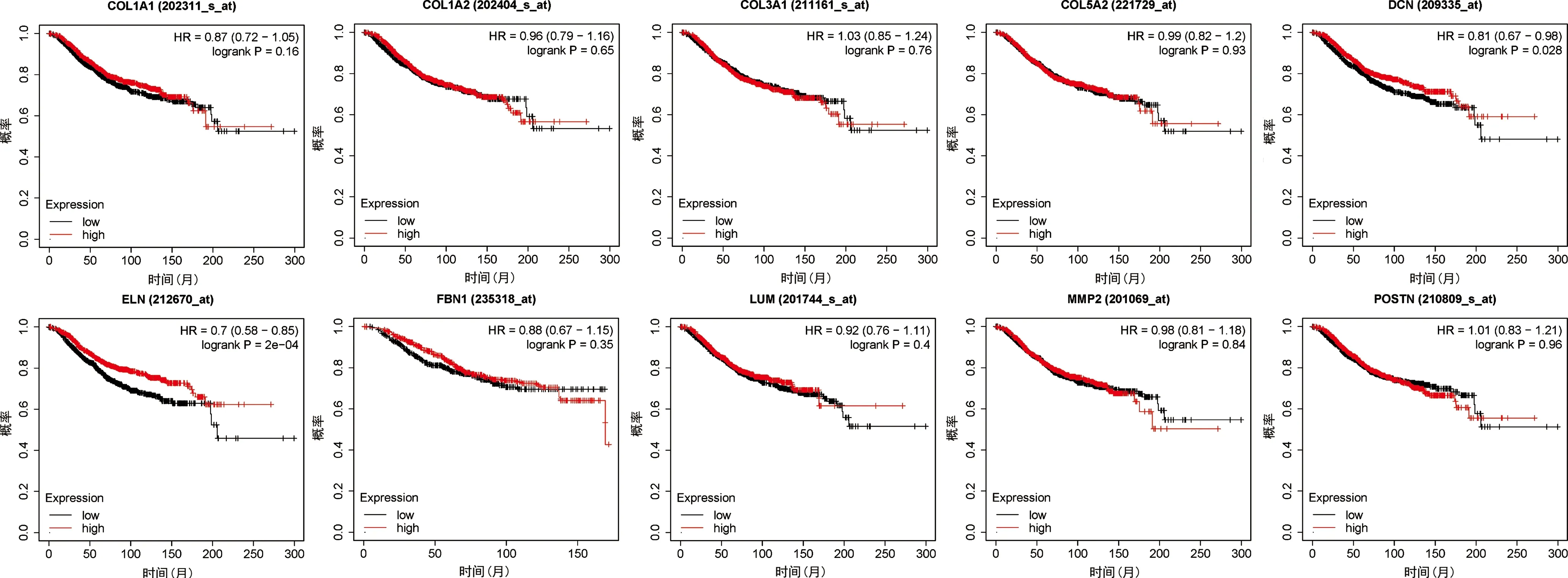
图4 核心基因生存分析
3 讨 论
目前,脑转移瘤的确切发生率尚不清楚,但由于现有治疗手段的进步使得许多癌症患者生存期更长、预后更好;另外,监测成像技术的使用、人口老龄化、人群健康意识提高及肿瘤学家的认识水平提高,脑转移瘤的发生率正在逐步上升,脑转移的发生率在实体肿瘤患者中约占30%。此外,尸检队列的数据表明,脑转移瘤的真实发生率在某些原发癌患者中较高[3-4]。恶性肿瘤中最易出现脑转移瘤的前3位是肺癌、乳腺癌和黑色素瘤,约占全部脑转移瘤的67%~80%[5]。流行病学结果显示,小细胞肺癌或非小细胞肺癌患者在诊断时有较高的脑转移率,而黑色素瘤患者则有较高的脑转移风险[6]。尽管脑转移在儿童中很少见,但在儿童神经母细胞瘤、肉瘤、肾母细胞瘤、黑色素瘤和生殖细胞肿瘤患者中都表现出较高的脑转移的倾向[7-8]。
DCN(decorin )一方面可抑制肿瘤细胞的增殖、转移,另一方面可抑制肿瘤组织中的血管生成[9]。有研究发现,肺腺癌组织中DCN表达显著降低,进一步细胞增殖实验表明,对肺腺癌细胞系A549和H157细胞的DCN进行过表达处理,细胞系的增殖速率可被显著抑制[10]。HU等[11]研究发现,DCN在炎性乳腺癌患者的肿瘤组织中表达显著下调,在IBC异种移植小鼠模型中,过表达DCN可通过破坏E-cadherin的稳定性和抑制EGFR/ERK信号通路减弱肿瘤细胞的侵袭及迁移能力。ZHAO等[12]通过将一种基于DCN蛋白研制的溶瘤毒素(rAd.DCN),通过对免疫活性乳腺肿瘤模型瘤内和静脉给予rAd.DCN,发现与静脉输注相比,瘤内注射rAd.DCN可产生更高水平的转基因表达,诱发更强的肿瘤溶瘤作用,而静脉输注可导致肺部病毒积聚量增加,可起到防止肿瘤肺转移的作用,肺组织中DCN的表达增加了Th1细胞因子的表达,如白细胞介素(IL)-2、IL-12和肿瘤坏死因子α,降低了Th2细胞因子的表达,如转化生长因子β和IL-6。此外,rAd.DCN治疗可诱导强烈的全身炎症反应和上调CD8+T淋巴细胞,提示rAd.DCN在抑制乳腺癌细胞生长的同时可抑制肺转移的发生。另外,还有学者研究发现,在三阴性乳腺癌小鼠模型中,在高剂量照射下肿瘤周围肌肉比常规照射下分泌更多的DCN,提示肿瘤周围肌肉分泌的DCN可能是超分割放疗能更有效抑制TNBC生长的原因之一[13]。此外,DCN表达上调可减弱三阴性乳腺癌的肺转移。
ELN编码的蛋白为弹性蛋白,是弹性纤维的主要成分。在许多恶性肿瘤中,重建的ECM表达高水平的弹性蛋白,这可能对肿瘤的生长有积极或消极的影响。弹性蛋白与其他ECM组分的交联以及控制这一过程的酶都对肿瘤的发生有影响。弹性蛋白酶的中性粒细胞弹性蛋白酶,是肿瘤入侵和转移的关键驱动因素[14]。LI等[15]研究发现,弹性蛋白是结直肠癌肿瘤发生的关键因素,通过对2个微阵列数据集中分析ELN基因在结直肠患者肿瘤组织、邻近非肿瘤结肠组织及健康对照组中的表达情况,结果发现,与癌旁非肿瘤组织和健康对照组相比,结直肠癌患者肿瘤中ELN基因表达增加,提示ELN在结直肠肿瘤发展和微环境中发挥着重要作用。亦有学者研究结果提示,ELN的表达与膀胱癌[16]、胶质瘤[17]患者的预后有关。
综上所述,通过对乳腺癌脑转移组织与乳腺癌组织之间的差异表达基因进行生物信息学分析,发现DCN、ELN 2个与乳腺癌脑转移患者预后相关的核心基因,由于肿瘤位置特殊性,能选用的数据集及样本量虽较少,但仍可为乳腺癌脑转移的预后和治疗提供一定方向。