肾脏黏液样小管状和梭形细胞癌的临床病理观察
2023-10-11兰秋霞肖华亮
兰秋霞,张 茜,肖华亮,马 强
(陆军特色医学中心病理科,重庆 400042)
肾脏黏液样小管状和梭形细胞癌(mucinous tubular and spindle cell carcinoma,MTSCC)是具有黏液样小管状和梭形细胞特点的低级别的多形性肾脏上皮肿瘤[1]。MTSCC较少见,穿刺活检病例和不典型病例易漏诊误诊。临床上常无特殊症状,影像学检查发现肿块,伴或不伴有季肋部疼痛和血尿,术前明确诊断较为困难。本研究报道8例MTSCC,结合相关文献复习探讨该肿瘤的形态学、免疫表型、鉴别诊断、治疗及预后。
1 资料与方法
1.1 一般资料
收集2012年9月至2022年2月经本中心诊断的8例MTSCC的临床资料。年龄33~76岁,平均61.8岁,女5例,男3例,6例为体检发现,2例因腰痛就诊发现。临床资料见表1。本研究经医院伦理委员会审批(医研伦审[2022]第130号)。
1.2 方法
所有手术切除标本均经4%中性甲醛溶液固定24 h,常规取材、石蜡包埋切片(4 μm),HE染色,显微镜下观察,选择具有代表性的石蜡块进行免疫组织化学染色。免疫组织化学采用EnVision 两步法,高温高压修复,4 ℃孵育一抗过夜,37 ℃孵育二抗30 min,DAB显色。所用标记抗体Vimentin、PAX-8、CK7、CK8/18、EMA、P504S、CD10、RCC、CA9、CD117、TFE3、增殖指数(Ki-67)及二抗均购自北京中杉金桥生物技术有限公司,操作步骤严格按照说明书进行。
2 结 果
2.1 基本情况
8例患者均为MTSCC,所有患者手术后未行进一步治疗,随访3~116个月,均无复发及转移。
2.2 大体标本检查
4例行保留肾单位肿瘤切除术,4例行根治性肾切除术。肿瘤最大径0.9~9.0 cm,平均4.8 cm;病变位于左肾5例,右肾3例。切除标本均呈灰白色,边界清楚,大部分有假包膜,切面灰白或灰黄色,质地较软,1例可见局灶性坏死。
2.3 显微镜检查
手术切除标本肿瘤边界清楚,部分病例可见纤维性包膜,见图1A。部分病例可见胆固醇结晶沉积伴灶性坏死,淋巴细胞、浆细胞浸润、泡沫样组织细胞聚集,见图1B。肿瘤细胞排列呈小管状、条索状,局灶呈肾小球样结构,可见梭形细胞区,间质黏液样变。小管状结构、梭形细胞区、黏液样间质等3种成分比例不一,见图1C。肿瘤细胞细胞质嗜酸,细胞体积较小,呈立方状或卵圆形,核级别低,异型性小,核分裂象少见,部分细胞高倍镜下可见小核仁,见图1D。其中病例6肿瘤最大径<1 cm,肿瘤边界清楚,缺乏纤维性包膜,可见小管状结构、梭形细胞区,缺乏典型的间质黏液样变及间质反应。

A:HE,40×;B:HE,100×;C:HE,100×;D:HE,200×;E:IHC,40×;F:IHC,40×。图1 MTSCC 组织形态及免疫标记
2.4 免疫组织化学检测
8例患者均表达PAX-8、CK7、Vimentin(图1E)、P504S(图1F)、CK8/18,EMA、CD10、RCC、CA9、TFE-3均有不同程度表达,Ki-67均≤10%,而CD117均不表达,见表2。
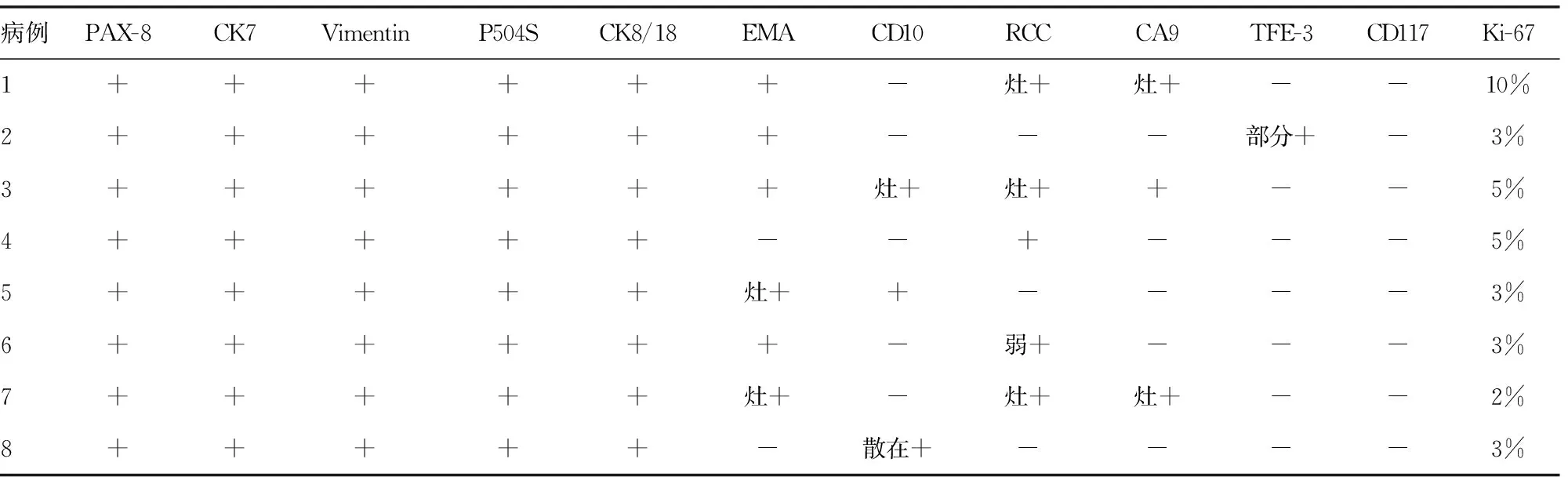
表2 8例MTSCC患者的免疫组织化学检测情况
3 讨 论
MTSCC较为少见,目前文献报道约200例[2],具有典型病理组织学特征的病例较易诊断,但穿刺活检病例和瘤体较小病例易漏诊误诊。穿刺活检由于取材的局限性,缺乏经验的病理医生极易漏诊。需仔细观察病变,组织学上寻找小管状、条索样结构,小管内/间质黏液、立方形或卵圆形或梭形细胞等具有提示MTSCC的诊断依据,加做相关免疫组织化学进行辅助诊断。对于中年女性肾脏肿瘤穿刺标本,具有部分MTSCC形态学特征的病例,也要考虑到MTSCC的诊断,加做免疫组织化学和分子检测进一步明确。瘤体较小病例,影像学检查容易漏诊,病理取材医生需仔细取材。
3.1 临床病理特征及诊断
MTSCC为低度恶性肾脏上皮来源肿瘤,预后相对良好。男女发病率约为1∶3.75,发病年龄17~84岁,中位年龄53岁[3]。大多数患者无特殊症状,在影像学检查时发现肾脏肿块,少部分病例存在季肋部疼痛和血尿情况。MTSCC是一种乏血供肿瘤,与透明细胞肾细胞癌不同;由于MTSCC的影像学特征重叠,因此很难将MTSCC与其他乏血供的肾肿瘤区分开来,在MTSCC的鉴别诊断应用上正确率较低,需要结合病理组织学检查[4-6]。本组8例患者中5例以体检发现肾脏占位就诊。病例5肿瘤较大,伴有腰部胀痛;病例6有输尿管结石病史,因肿瘤较小,术前影像学检查并未发现明显肿块。典型的病理组织学特征为小管状结构、梭形细胞区、黏液样间质等同时存在且占比均较多,但实际工作中,3种成分比例不一或由于取材的局限性,某种成分不明显,易漏诊误诊。典型的病理组织学特征是诊断的关键,本组病例均同时存在小管状结构、梭形细胞区、黏液样间质,部分病例可见胆固醇结晶沉积伴灶性坏死,淋巴细胞、浆细胞浸润、泡沫样组织细胞聚集,这也是诊断MTSCC的次要标准。XU等[7]提出MTSCC的生物学较好,可能是由于肿瘤周围的B淋巴细胞激活补体系统抗肿瘤的结果。
3.2 免疫表型及组织学来源
MTSCC的免疫表型谱系较广且缺乏特异性,既可以部分表达近端小管的免疫标记,又可以部分表达远端小管的免疫标记。有文献报道也可以部分表达集合管和Henle襻的免疫标记[8-12]。RAKOZY等[8]研究显示,7例MTSCC中5例EMA、PNA、SBA、CK8/18、CK19均表达,Vimentin部分表达,RCC、Villin均不表达,支持集合管上皮来源。FERLICOT等[9]报道了15例MTSCC,其中大部分EMA、CK、CK7、CK19、E-cad、AMACR均表达,CD10不表达,支持其来源于远曲小管。PARWANI等[10]发现,4例MTSCC的形态学、免疫组织化学和超微结构均提示该肿瘤来源于远端肾单位。PANER等[11]通过对MTSCC的光镜(20例)和电镜(5例)研究,认为MTSCC起源于远端肾单位的Henle襻。WANG等[12]发现IRX5在MTSCC中高表达,进一步支持MTSCC起源于Henle襻。本研究中8例MTSCC患者免疫组织化学检测显示,PAX-8、CK7、Vimentin、P504S、CK8/18均表达,EMA、CD10、RCC、CA9、TFE-3均有不同程度表达。既有部分支持近端小管的证据,又有部分支持远端小管的证据。Henle襻是近端小管的直部、细段与远端小管的直部连成“U”字形部分,提示本组病例免疫表型支持MTSCC起源于Henle襻。
MTSCC的病因不明,HES等[3]报道与肾结石有关,NOUH等[13]报道MTSCC可以发生在终末期患者中。本组病例中1例患者有输尿管结石病史,且MTSCC肿瘤<1 cm,术前临床及影像学未考虑肿瘤,不完全除外MTSCC与泌尿系统结石的相关性。SARLOS等[14]在最近对 MTSCC 胚胎起源的研究中提出,肿瘤是由分化受损的胚胎静止样前体病变发展而来。间质向上皮细胞转化的时间变化影响了不同的细胞谱系,这可能是 MTSCC出现多种形态的原因。
3.3 分子遗传学
在对MTSCC的一系列比较基因组杂交研究中,有研究报道,具有经典形态的MTSCC显示丢失了1、4、6、8、9、13、14、15和22号染色体,而具有相似形态学特征的乳头状肾细胞癌,则可能出现其他染色体的扩增和丢失,包括7号和17号染色体的扩增[7,15-16]。其后基于荧光原位杂交的研究表明,MTSCC没有7号、17号染色体的扩增和Y染色体的丢失,这是乳头状肾细胞癌的特征。
MTSCC的全外显子和转录组测序揭示了Hippo信号通路肿瘤抑制基因PTPN14、NF2 和SAV1的双等位基因缺失。这一发现表明,Hippo通路失调是MTSCC发病机制中的一个必不可少的原因,这可能会对诊断和今后的治疗产生影响[17]。
3.4 鉴别诊断
(1)乳头状肾细胞癌镜下见多少不等的小管和乳头状结构,间质也可有泡沫样组织细胞、胆固醇结晶、出血和坏死,MTSCC也可出现乳头状结构,二者形态学上有较多相似之处;免疫表型Vimentin、CD10、P504S、CK7在二者均可表达。黏液样基质和梭形细胞区提示MTSCC,但是伴有低级别梭形细胞灶的1级乳头状肾细胞癌,可能需要分子检测辅助鉴别诊断。乳头状肾细胞癌的分子遗传学为7、17号染色体扩增,Y染色体缺失;而MTSCC的分子遗传学为1、4、6、8、9、13、14、15及22号染色体缺失,无7、17号染色体扩增,在分子层面可鉴别[7,15-16]。(2)集合管癌组织学结构为管状、乳头状,间质促结缔组织增生反应,形态学上与MTSCC有部分相似之处;但集合管癌边界不清,浸润周围肾组织,细胞核异型性明显;而MTSCC边界清楚,大部分有包膜,可见黏液样基质,细胞异型性小,核级别低。(3)后肾腺瘤形态学上与MTSCC有相似之处,但后肾腺瘤通常缺乏梭形细胞区和黏液样间质,免疫表型后肾腺瘤CD57、WT-1均表达,CK7不表达;而MTSCC的CK7表达,CD57、WT-1均不表达。(4)胃肠外间质瘤当肿瘤位于腹膜后,以梭形细胞形态为主时需与高级别MTSCC鉴别,因肿瘤分化差,组织学上鉴别比较困难;免疫表型胃肠外间质瘤CD117、DOG-1、CD34均表达。(5)高级别MTSCC需与肉瘤样肾细胞癌鉴别,高级别MTSCC局部可见小管状结构及黏液样间质,穿刺活检病例,组织学上鉴别比较困难;免疫表型肉瘤样肾细胞癌Desmin、SMA均表达,而MTSCC常不表达。
3.5 治疗与预后
MTSCC治疗以手术完整切除为首选,术后大部分无复发、转移。部分文献报道肿瘤细胞异型性大,核大、奇异型核及病理性核分裂象多见等高级别形态表现[18-19],往往提示有复发及转移可能,可行化疗及免疫治疗[20]。目前MTSCC病例数量较少,暂无标准化和共识性指南的治疗方案。
