MeCP2基因在脑胶质瘤中的表达及临床意义*
2023-10-11黄冠又刘家骏杜永贵葛学成甘鸿川
黄冠又,刘家骏,杜永贵,苏 恒,葛学成,张 欣,甘鸿川
(贵阳市第二人民医院神经外科,贵阳 550081)
神经胶质瘤(glioma)起源于神经上皮组织,是一种位于成人原发性中枢神经系统中的恶性肿瘤,具有发病率高、恶性程度高、致残致死率和复发率高等特点,严重威胁患者的生命健康[1-2]。目前胶质瘤的治疗方案是在手术切除肿瘤的基础上,结合病理和分子病理结果,辅助放疗和(或)化疗。但由于肿瘤异质性、耐药性及血脑屏障等因素,导致患者对各种治疗的敏感性差异较大。据报道,低级别胶质瘤患者5年生存率为60%~74%[3],而高级别的胶质瘤患者的中位生存时间仅为15个月左右,5年生存率低于6%[4]。因此,深入了解胶质瘤发生、发展的特点和分子机制,发现新的分子标记物,对于开发更好的胶质瘤治疗方法至关重要。
甲基化CpG结合蛋白2(methyl-CpG-binding protein 2,MeCP2)是甲基化结合蛋白家族中的主要成员,是维系大脑功能所必需的,并参与神经元的成熟和突触发生,在基因转录调控中发挥重要作用[5]。当MeCP2基因功能异常时,不能对相应的下游靶基因产生抑制作用,会造成DNA甲基化改变,进而影响DNA的转录和翻译,从而使基因的表达异常,与肿瘤的发生密切相关,并促进肿瘤细胞的增殖和迁移,如肺癌、结肠癌、卵巢癌等[6-7]。目前关于MeCP2与神经胶质瘤的相关研究较少,其在胶质瘤中的具体作用和机制仍不明确。
本研究基于对癌症基因组图谱(the cancer genome atlas,TCGA)数据库进行挖掘分析,同时结合GTEx数据集,分析mRNA在胶质瘤(低级别胶质瘤LGG和高级别胶质瘤GBM)和正常脑组织的表达差异,目的在于分析MeCP2在胶质瘤患者中的表达与临床病理特征和预后的关系,通过对样本数据的挖掘,探讨MeCP2在胶质瘤中的潜在作用,为胶质瘤的靶向治疗提供理论依据。
1 材料与方法
1.1 数据来源及临床资料
从TCGA数据库(https://portal.gdc.cancer.gov)中下载神经胶质瘤患者基因表达谱数据(TCGA-GBMLGG、level3、RNA-seq)及临床和生存信息,共获得696例胶质瘤患者组织和5例癌旁组织mRNA转录组数据。纳入标准:(1)有完整的患者临床和基因表达数据;(2)病理结果为LGG或GBM。对TCGA数据库中基因表达水平的标准化是通过对FPKM值以2为底(log2)取对数实现的。本研究获贵阳市第二人民医院伦理委员会批准(审批号:202153)。
1.2 MeCP2的表达情况与胶质瘤临床病理和预后关系
从UCSC XENA数据库(https://xenabrowser.net/datapages/s)经Toil流程[8]统一处理的TCGA和GTEx的TPM格式的RNAseq数据,提取TCGA中GBM、LGG(696例)和GTEx中对应的正常组织(1 157例)数据。对数据进行log2转化后进行胶质瘤和正常脑组织样本间的表达比较。
696例胶质瘤临床数据中,男398例,女498例;≤60岁553例,>60岁143例;WHO中枢神经系统分类中,WHO Ⅱ级224例,WHO Ⅲ级243例,WHO Ⅳ级168例;IDH突变者440例,野生型246例;1p/19q联合缺失171例,非联合缺失518例。经合并后分析GBM和LGG两组数据中MeCP2表达量的中位值为4.114,将>4.114设置为高表达组,≤4.114为低表达组,绘制Kaplan-Meier生存曲线,对MeCP2不同表达组进行总生存期(overall survival,OS)和疾病特异生存期(disease specific survival,DSS)分析。
1.3 差异表达基因的筛选和富集分析
应用R软件(4.1.3)limma包进行数据归一化和标准化进行差异表达基因筛选,按基因表达差异倍数的绝对值(logFC>2,P<0.05)的标准,得到有统计学意义的差异基因。基于R软件使用ggplot2包对于差异基因进行GO功能富集和KEGG信号通路富集分析。
1.4 MeCP2表达与免疫浸润和肿瘤微环境的相关性
根据TCGA数据库中胶质瘤的免疫浸润情况进行评估,通过CIBERSORT工具分析免疫浸润状况。通过Wilcoxon秩和检验比较和分析MeCP2低表达组和高表达组之间免疫细胞浸润差异。每个样本的肿瘤免疫微环境(TME)评分,包括基质评分、免疫评分和ESTIMATE评分,通过Restimate包来确定。
1.5 统计学处理
使用R软件(版本4.1.2)进行统计分析。两组间比较采用Mann-WhitneyU检验,多组见比较采用Kruskal-Wallis秩和检验;log-rank检验MeCP2与胶质瘤患者预后的关系,并绘制Kaplan-Meier生存曲线;采用单因素和多因素Cox回归模型分析相关临床病理因素和MeCP2表达与胶质瘤患者预后的关系;相关性分析采用Spearman相关系数。以P<0.05为差异有统计学意义。
2 结 果
2.1 MeCP2在胶质瘤组织中表达情况
TCGA数据库及GTEx数据集联合分析结果表明,与正常脑组织相比,MeCP2基因在胶质瘤组织中明显上调,两组间差异有统计学意义(P<0.001),见图1。
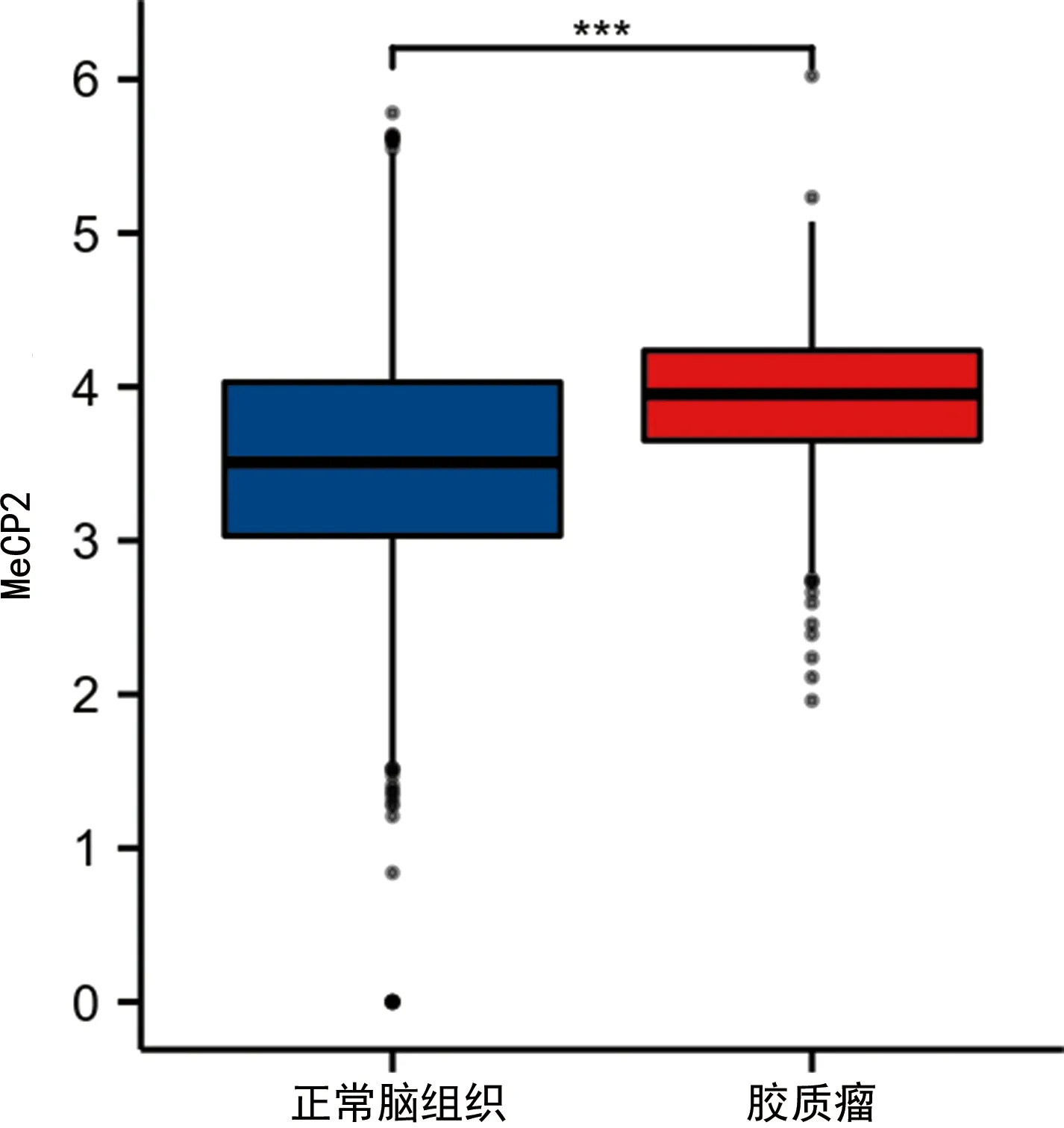
***:P<0.001。图1 MeCP2在胶质瘤和正常脑组织中的表达
2.2 MeCP2的表达情况与胶质瘤临床病理特征的关系
对TCGA数据库中与胶质瘤患者相关的临床病理特征数据进行分析,结果表明MeCP2表达与性别无关,但与年龄、病理分级和分子分型相关。MeCP2高表达与低龄(≤60岁)、低级别胶质瘤(WHO Ⅱ、Ⅲ级)、异柠檬酸脱氢酶(IDH)突变型和1p/19q共缺失相关(P<0.01或P<0.001),见图2。
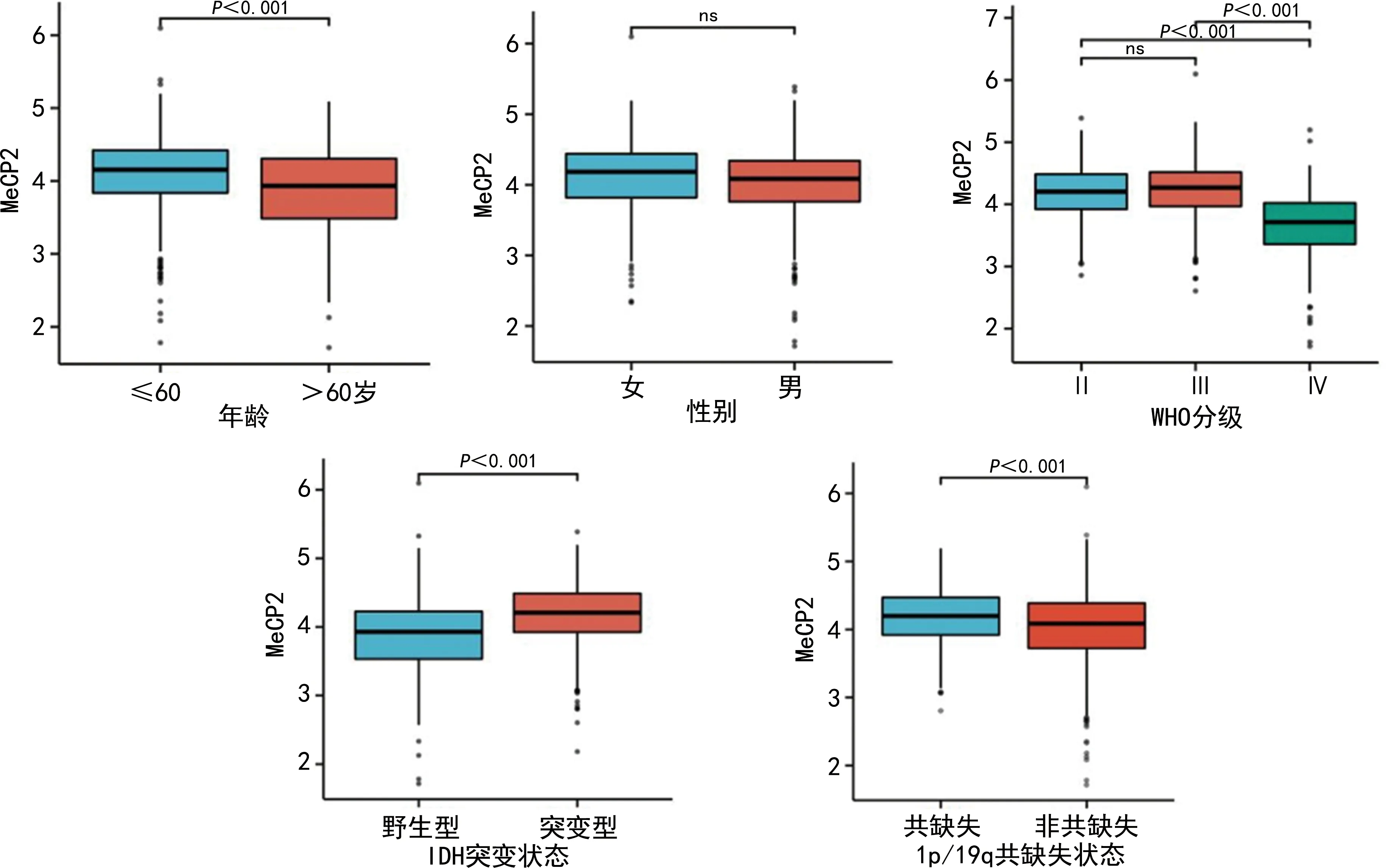
ns:差异无统计学意义。图2 TCGA数据库中MeCP2基因表达与胶质瘤患者临床病理特征关系
2.3 MeCp2表达水平对胶质瘤患者生存期的影响
对696例胶质瘤患者进行Kaplan-Meier生存分析显示,MeCP2高表达组(红线)患者的生存曲线在低表达组(蓝线)之上,即MeCP2低表达组OS较MeCP2高表达组明显缩短,差异有统计学意义(P<0.001),见图3。
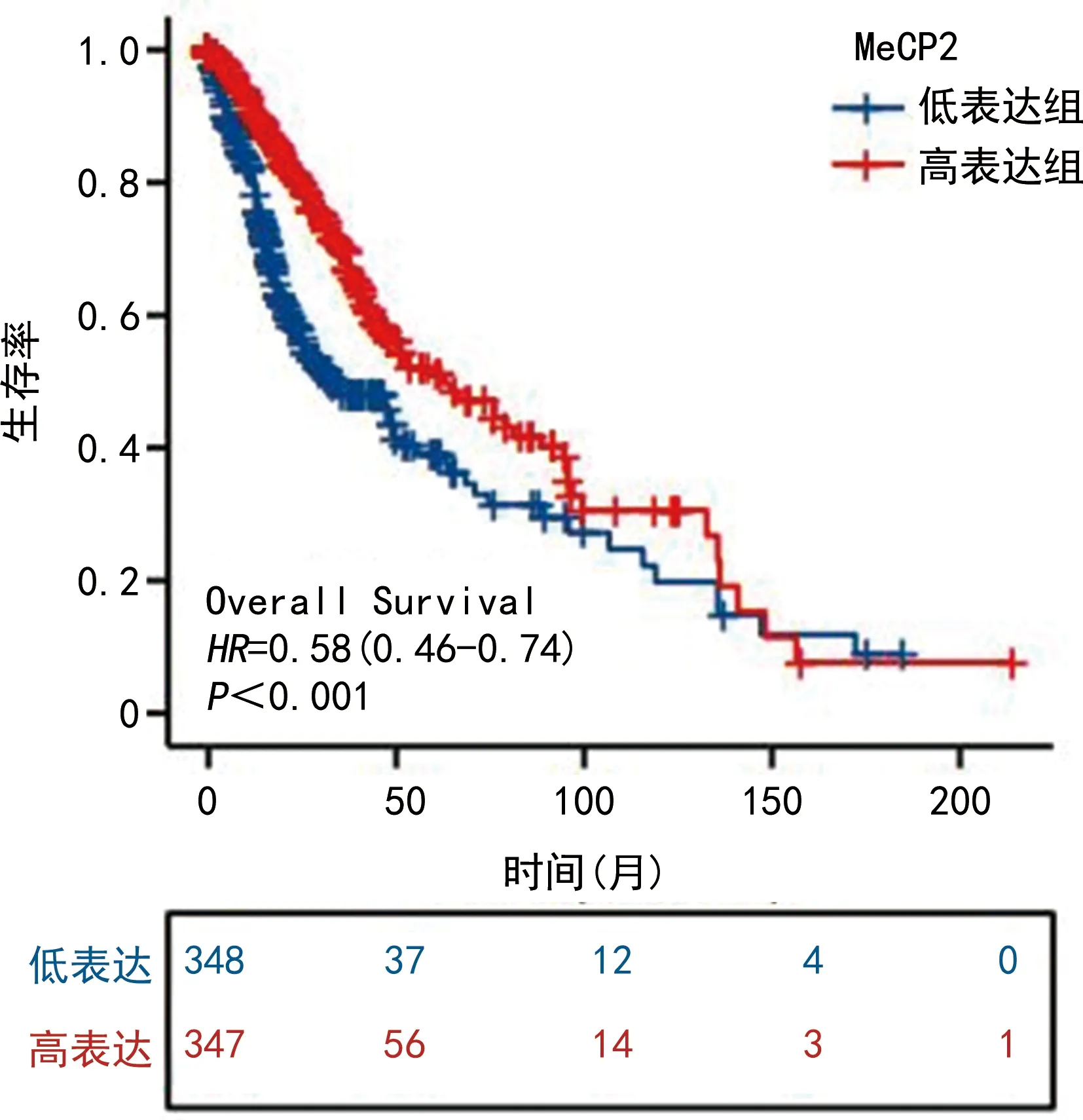
图3 MeCP2在TCGA数据库中的生存分析
2.4 MeCP2表达水平与患者预后的关系
将患者的MeCP2表达水平及相关临床病理因素纳入Cox单因素、多因素风险比例回归模型分析,结果显示高龄(>60岁)、WHO分级(Ⅲ、Ⅳ级)和IDH突变型是胶质瘤患者生存的独立影响因素。单因素分析显示MeCP2的危险度(HR)=0.412(95%CI:0.319~0.533),见表1。
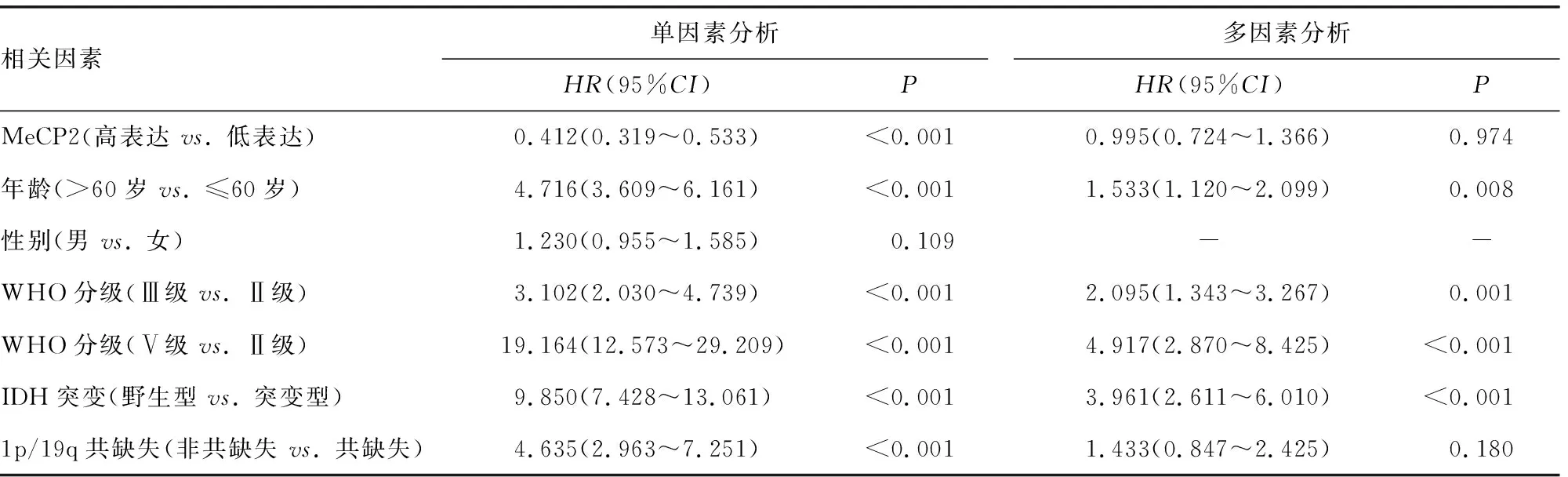
表1 MeCP2表达水平与患者预后的单因素和多因素分析
2.5 MeCP2的差异表达基因和富集分析
根据TCGA数据库中696个胶质瘤样本,比较样本中MeCP2高表达和低表达组中基因转录水平差异,进行差异分析,筛选条件为基因差异倍数的绝对值(logFC>1,P<0.05),共筛选到1 025个差异表达基因,表达水平升高的有266个,表达水平降低的有759个。GO分析显示,这些差异表达基因参与生物学过程包含白细胞迁移、细胞外结构/基质组织、细胞趋化等。KEGG信号通路分析显示,差异表达基因参与的分子信号通路包括细胞因子受体相互作用、神经活性配体受体相互作用、趋化因子信号通路等。
2.6 MeCP2表达与胶质瘤中免疫细胞浸润和肿瘤微环境相关性
CIBERSORT分析结果表明,MeCP2基因高表达组中静止树突状细胞、中性粒细胞和M2巨噬细胞较多(P<0.05或P<0.001),而低表达组中记忆B细胞、初始B细胞和浆细胞较多(P<0.01)。与MeCP2高表达组相比,低表达组的免疫评分、基质评分和ESTIMATE评分都较高(P<0.001),见图4。
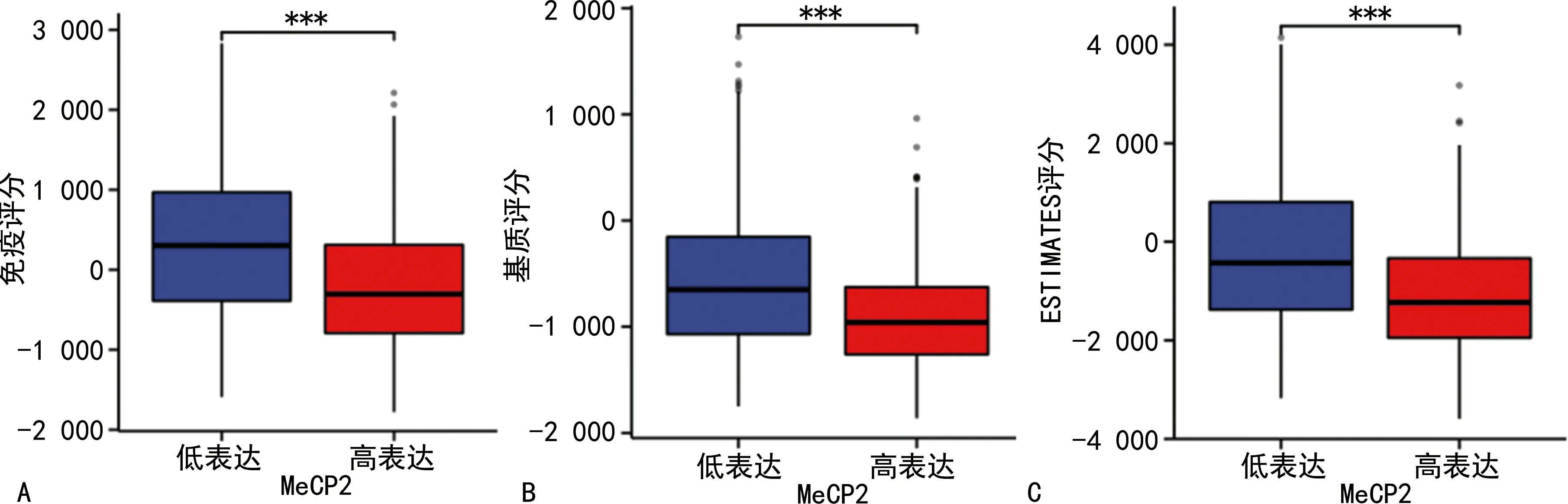
图4 胶质瘤中MeCP2高表达和低表达组中免疫相关评分
3 讨 论
胶质瘤的发生发展是多基因参与的异常复杂过程,一些重要基因的缺失或改变能导致细胞异常增殖,该过程可能涉及癌基因EGFR激活和抑癌基因如p53、p16等失活改变或异常表达。此外,与胶质瘤风险增加相关的基因,如表皮生长因子受体EGFR基因扩增/突变、1p/19q缺失、IDH突变、端粒酶逆转录酶(TERT)启动子突变等,这些基因突变也是胶质瘤发病机制的重要因素和判断预后的重要标志物[9-10]。由于胶质瘤高度异质性,其致病基因突变复杂,针对胶质瘤的特异性靶点仍需更多研究,为其个性化治疗提供依据。
MeCP2基因是一种转录调节因子,能够调控基因表达,具有转录激活或抑制双重作用。神经元中MeCP2缺失会导致神经发育障碍、Rett综合征及主要的神经精神疾病(例如自闭症和精神分裂症)[11]。MeCP2可以在DNA中结合甲基化的CpG二核苷酸,有研究认为MeCP2通过招募转录抑制因子Sin3A和组蛋白脱乙酰化酶(HDAC)作为转录抑制启动子[12]。除了在神经元中的作用外,MeCP2还在胶质细胞(星形胶质细胞、少突胶质细胞和微胶质细胞)中发挥调节作用,MeCP2基因调节失调会损害胶质细胞和神经元功能[13]。KIM等[14]研究发现丙戊酸可以使C6胶质瘤细胞中褪黑激素MT1受体、HDAC 1、HDAC 2、HDAC 3和MeCP2的mRNA表达出现明显的时间依赖性变化。BIAN等[15]研究揭示MeCP2是脑胶质瘤上皮间质转化(EMT)的1个新的调节因子,提示抑制MeCP2可能是抑制脑胶质瘤EMT的治疗选择。从以上研究报道可知,MeCP2可能是胶质瘤中治疗的一个新的靶点,但其在胶质瘤中的作用目前鲜有相关研究。
本研究基于TCGA数据库和GTEx数据集分析MeCP2在胶质瘤和正常脑组织间表达的差异性,结果显示MeCP2在胶质瘤中表达水平高于正常脑组织,且表达水平与患者年龄、病理分级和分型相关,在低龄(<60岁)、低级别胶质瘤、IDH突变型和1p/19q共缺失中表达水平明显增高。通过Kaplan-Meier生存分析发现,MeCP2的表达水平可以反映预后,表现为MeCP2高表达水平的患者预后总生存时间明显高于MeCP2低水平患者,差异有统计学意义。考虑在上述因素中胶质瘤患者预后较好,该结果同MeCP2表达上调预示患者预后较好相吻合。研究表明表达抑制或缺失是MeCP2在恶性肿瘤中的主要表达失调形式[16],本研究中,MeCP2在GBM患者中表达水平低于LGG,表明其表达水平随着胶质瘤的发展有逐步下降趋势,提示MeCP2的表达抑制可能参与胶质瘤的发生发展。但通过Cox风险比例回归模型分析,并未证实MeCP2是影响胶质瘤患者生存的独立影响因子,提示MeCP2并不能简单地归结为肿瘤抑制因子,MeCP2高表达改善胶质瘤患者预后的机制尚需进一步研究证实。
对MeCP2高表达和低表达组筛选出的差异表达基因进行GO和KEGG富集分析,结果显示,差异表达基因明显富集在白细胞迁移和趋化的生物学过程及相关分子信号通路,如细胞因子和趋化因子信号通路等。研究证实多种趋化因子及受体与胶质瘤细胞的增殖、迁移和侵袭密切相关,并在胶质瘤中表达升高,抑制趋化因子及受体的表达有助于胶质瘤的抗血管生成治疗[17-18]。并且一些细胞因子和趋化因子具有免疫调节作用,能影响GBM的肿瘤微环境,有望成为GBM免疫治疗靶向的候选分子[19]。因此,MeCP2可能参与调控细胞因子或趋化因子信号通路并在胶质瘤中起作用,为今后胶质瘤的免疫靶向治疗提供新的靶点。
目前已知,肿瘤微环境对免疫治疗有重要影响,因此,本研究最后还分析了MeCP2表达与胶质瘤免疫浸润和肿瘤微环境的关系。结果表明,低表达组有更多的免疫细胞浸润和更高的免疫评分,表明低表达组患者可能对免疫疗法有更好的治疗反应,提示MeCP2可能是胶质瘤的一个免疫治疗靶点。
综上所述,高级别胶质瘤中,MeCP2表达水平低于低级别胶质瘤,其低表达水平预示胶质瘤恶性程度高,患者生存期短。MeCP2参与调控细胞因子或趋化因子信号通路,并与免疫细胞浸润密切相关,MeCP2可能与胶质瘤的侵袭和发展有关,可能是一个潜在的胶质瘤基因治疗靶点。但MeCP2在胶质瘤中的具体生物学功能和作用机制还需进一步研究证实。
