RDH5对肺腺癌恶性生物学行为及预后的影响*
2023-10-11刘海君张洪岩任开明赵俊刚
刘海君,张洪岩,汤 隽,任开明,赵俊刚
(中国医科大学附属盛京医院胸外科,沈阳 110004)
2020年癌症相关数据显示,肺癌是全球第二大高发恶性肿瘤,约有220万新发病例,约有180万病例死于肺癌[1]。根据细胞学类型,肺癌主要分为非小细胞肺癌(non-small-cell lung carcinoma,NSCLC)和小细胞肺癌,其中肺腺癌是NSCLC的最常见病理亚型[2]。早期肺腺癌患者缺乏特异性临床表现,易错过最佳诊断时间,中晚期患者常发生局部浸润甚至远处转移,导致治疗效果不佳,5年总生存(overall survival,OS)率长期低于20%[3]。目前,靶向治疗和免疫治疗是肺腺癌治疗的主要手段,在部分患者中取得了良好的临床效果[4-5],但由于肿瘤异质性,临床上受益人群仍有限[6]。
视网膜脱氢酶5(retinol dehydrogenase 5,RDH5)属于RDH家族,通过催化维生素A氧化为视黄醛成为视觉循环中的一种关键酶[7-8]。近年来有报道指出RDH5在多种癌症中存在异常表达:在结直肠癌中RDH5的表达水平降低,通过影响细胞生长和分化来促进了结直肠癌的发展[9]。胃癌患者的外显子组测序表明RDH5的突变可能与早期癌变有关[10-11]。RDH5在肝细胞癌组织中表达明显下调,其低表达与转移和不良预后相关[12]。但在雌激素受体阴性乳腺癌中,RDH5的表达升高被认为是肿瘤发生和耐药的原因之一[13]。目前RDH5在肺癌中的表达情况,功能和作用机制仍不清楚。所以探究RDH5在肺癌中的相关信息对于预测肺癌患者预后情况,开展针对肺癌的特异性治疗及提高治愈率有着重要的理论和临床意义,现报道如下。
1 材料与方法
1.1 材料
1.1.1细胞
肺腺癌细胞系A549、H1437和支气管上皮细胞系16HBE购自中国科学院典型培养物保藏委员会细胞库。所有细胞系均在含10%胎牛血清(美国Hyclone公司)的RPMI 1640培养基(美国Invitrogen公司)进行培养。培养条件为37 ℃、5% CO2。
1.1.2组织标本
选取2012年1月至2014年12月于本院行根治性切除的139例肺腺癌患者为研究对象。所有患者均未接受术前放化疗,无重大疾病史及其他肿瘤病史。病理诊断符合美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版标准,其中男103例,女36例;AJCC分期:Ⅰ期27例,Ⅱ期34例,Ⅲ期78例。收集研究对象肿瘤组织及配对癌旁组织(距肿瘤边缘3 cm以上,避免肿瘤中心明显钙化或坏死部分),保存于液氮中,随后转移至-80 ℃保存。本研究所有研究对象签署知情同意书,并经医院伦理委员会批准。
1.2 方法
1.2.1实时荧光定量逆转录PCR(real-time fluorescent quantitative PCR,RT-qPCR)
Trizol法分别提取组织和细胞中RNA。加入适量的DEPC H2O溶解(65 ℃促溶10~15 min)。在260~280 nm处获得吸光度(A)值评估浓度。依据说明书,通过Advantage®RT-for-PCR 试剂盒 (日本Takara公司) 使用2 μg RNA合成cDNA。将cDNA稀释,使用 HiScript®Ⅱ One Step qRTPCR SYBR®Green Kit(日本Takara公司)进行RT-qPCR。PCR扩增循环条件:94 ℃预变性4 min,94 ℃变性1 min,63 ℃退火1 min,72 ℃延伸1 min,30 个循环。72 ℃延伸10 min 后降至4 ℃。以β-actin作为内参照。
所有PCR实验均使用LightCycler 480 system Ⅱ(德国罗氏诊断有限公司)完成。RDH5的上游引物是5′- GCT TCT TCC GAA CCC CTG TG -3′,下游引物是5′-CCT GGC TAC TCA CAC TTG GT-3′;β-肌动蛋白的上游引物是5′-ATT GGC AAT GAG CGG TT-3′,下游引物是5′-CGT GGA TGC CAC AGG ACT-3′。引物由北京华大基因有限公司合成。
1.2.2细胞转染
RDH5表达被预先设计的小干扰RNA(small interfering RNA,siRNA)干扰(#1,s11893;#2,s11894;Cat#4392420,美国Thermo Fisher Scientific公司)。使用非靶向shRNA作为阴性对照(#4390843,美国Thermo Fisher Scientific公司)。使用Lipofectamine RNAiMAX(#13778-150,美国Thermo Fisher Scientific公司)混合siRNA进行转染。
1.2.3Western blot
将培养的细胞用冷磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤两次,并在含有1×Halt蛋白酶和磷酸酶抑制剂混合物(#78442,美国Thermo Fisher Scientific公司)的RIPA 缓冲液中裂解。裂解液以1 s的间隔超声1 s,总共1 min,然后在15 000×g和4 ℃下离心15 min。收集上清液作为全细胞裂解物。蛋白质样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)并转移到硝酸纤维素膜上。膜用5%低脂奶粉封闭,并在4 ℃下用抗 RDH5 的一抗(PA5-19319,美国Thermo Fisher Scientific公司,1∶1 000)、抗β-actin(#4967,美国Cell Signaling Technology公司,1 ∶5 000)、抗含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase)3(#9662,美国Cell Signaling Technology公司,1∶1 000)、抗裂解(cleaved)-caspase3(#9664,美国Cell Signaling Technology公司,1∶1 000)在TBST中稀释用于Western blot。在室温下与山羊抗兔IgG二抗(#7074,美国Cell Signaling Technology公司,1∶5 000)孵育1 h后通过使用增强化学发光法(enhanced chemiluminescence,ECL)试剂(美国GE Healthcare公司)曝光显影蛋白条带1 min。
1.2.4流式细胞分析
在含有1% BSA的PBS中将细胞浓度调整为1×106个/mL。细胞悬液与抗体室温孵育30 min,用含1% BSA的PBS洗涤和离心2次,将细胞沉淀悬浮于PBS中。流式细胞术使用 FACSVerse (美国BD Biosciences公司)仪器进行。使用 FlowJo 3.3软件分析流式细胞术数据。
1.2.5细胞活性实验
使用CCK-8试剂盒,并依据其使用说明书测定处理后细胞活性。接种细胞24 h后,开始转染细胞。之后每隔24 h使用CCK-8 10 μL、避光孵育1 h,使用酶标仪在450 nm处测定A值。
1.2.6细胞凋亡实验
收集含有漂浮凋亡细胞的上清液,将贴壁细胞沉淀并与漂浮细胞结合。 收集的细胞用PBS洗涤两次,每个沉淀以1×107个/mL 重悬于膜联蛋白(Annexin)V结合缓冲液中。细胞用Annexin V(#640918,美国BioLegend公司)和7-AAD(#420403,美国BioLegend公司)染色,并在室温下避光孵育15分钟。将Annexin V结合缓冲液添加到每个样品中,并使用 FACSVerse 仪器(美国BD Biosciences公司)分析细胞。
1.2.7生物信息学分析
于癌症基因组图谱(the cancer genome atlas,TCGA)分析RDH5在泛癌和肺腺癌中的表达差异,log-rank进行生存分析,以ggplot2进行可视化。
1.3 统计学处理

2 结 果
2.1 RDH5 mRNA在肺腺癌组织及癌旁组织中的表达水平
TCGA分析结果显示,RDH5在肺腺癌组织表达水平高于癌旁正常组织,且RDH5高表达患者的OS率低于低表达患者(P<0.05),见图1。
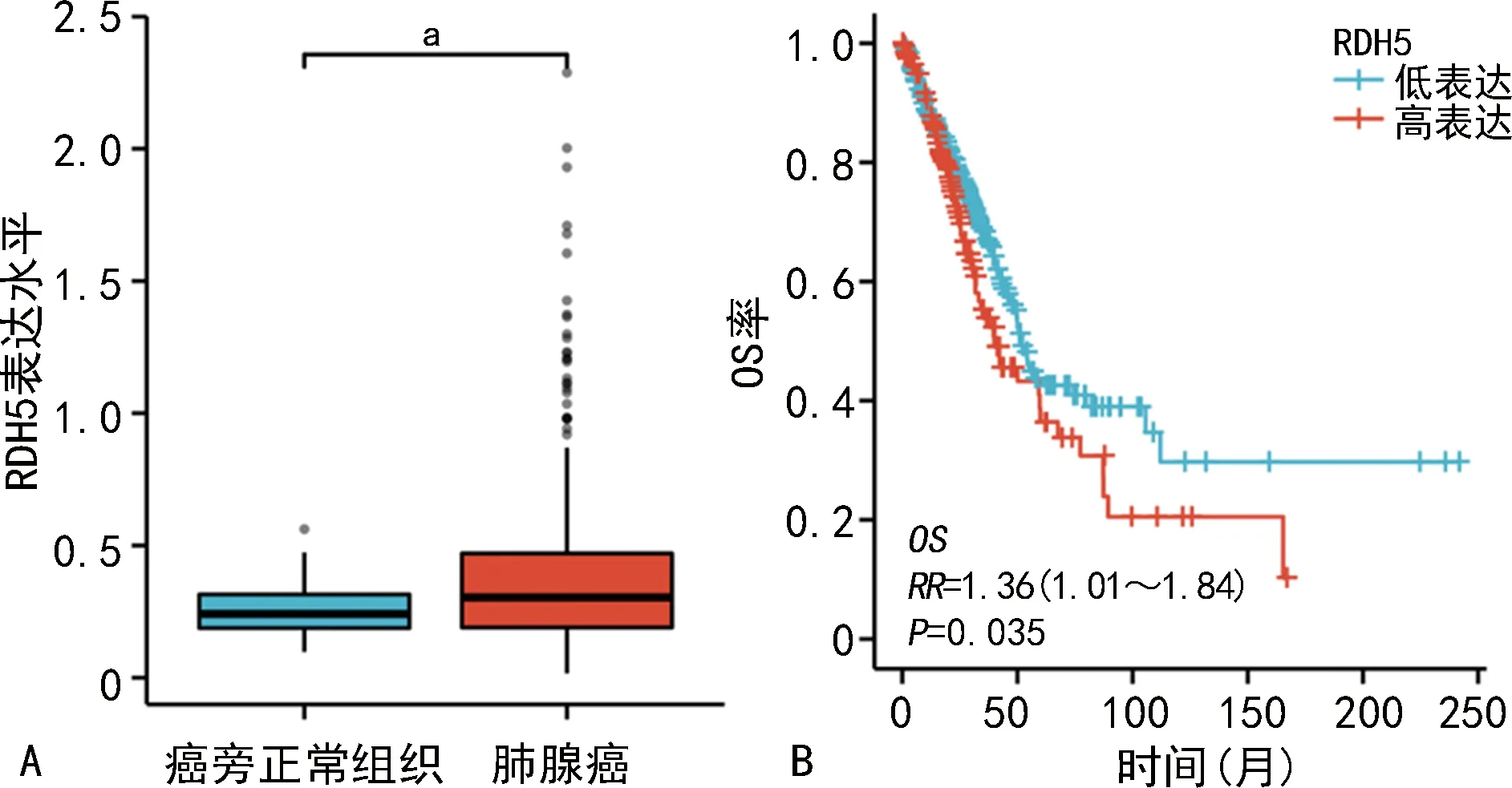
A:RDH5 mRNA在肺腺癌及癌旁正常组织中的表达水平;B:RDH5表达水平对肺腺癌患者的生存影响;aP<0.05。图1 RDH5在肺腺癌组织中的表达情况及预后影响
2.2 RDH5在肺癌细胞系的表达水平
A549、H1437中RDH5 mRNA相对表达水平较16HBE升高,A549、H1437中RDH5蛋白表达增加(P<0.05)。siRNA处理后,A549、H1437中RDH5 mRNA相对表达水平较处理前降低,RDH5蛋白表达减少(P<0.05),见图2。因siRNA#2转染后RDH5 mRNA和蛋白表达水平较siRNA#1转染后更低,故选取siRNA#2进行后续研究。

A:3种细胞系中RDH5 mRNA相对表达水平比较;B:3种细胞系中RDH5蛋白表达情况;C:siRNA转染后,肺腺癌细胞系中RDH5 mRNA相对表达水平比较;D:siRNA转染后,肺腺癌细胞系中RDH5蛋白表达情况;a:P<0.05,与A549比较;b:P<0.05,与H1437比较。图2 RDH5在肺腺癌细胞中的表达情况
2.3 干扰RDH5的表达对肺腺癌细胞的影响
siRNA转染96 h后,A549、H1437中细胞增殖率较对照明显降低(P<0.05)。克隆形成实验结果显示,siRNA转染后细胞群落数明显减少,见图3。随着siRNA转染,RDH5表达减少,细胞凋亡比例增加,A549、H1437中凋亡细胞分别从9.3%、10.0%增加至32.1%、45.6%。siRNA转染后,A549、H1437的caspase3表达减弱,cleaved-caspase3表达增强,见图4。

A:A549细胞增殖率变化情况;B:H1437细胞增殖率变化情况;C:A549克隆形成实验;D:H1437克隆形成实验;a:P<0.05。图3 CCK-8和克隆形成评估RDH5对细胞增殖的影响

A:A549的Annexin V/7AAD染色分析;B:H1437的Annexin V/7AAD染色分析;C:肺腺癌细胞系中凋亡相关蛋白表达情况。图4 抑制RDH5表达促进细胞凋亡
2.4 RDH5表达水平与肺腺癌患者临床病理特征的关系
肺腺癌组织中RDH5相对表达的中位水平为2.24,以此作为截断值将RDH5相对表达水平≥2.24的患者作为高表达(n=83),将RDH5相对表达水平<2.24的患者作为低表达(n=56)。结果显示,RDH5高表达与低表达的肿瘤分化程度、淋巴结转移、AJCC分期比较,差异有统计学意义(P<0.05),见表1。

表1 RDH5表达水平与肺腺癌患者临床病理特征的关系(n)
2.5 RDH5表达水平与肺腺癌患者预后的关系
139例肺腺癌患者中,术后5年内死亡95例(死亡率68.34%),中位无病生存(disease-free survival,DFS)时间为33(15,68)个月,中位OS时间为 46(24,69)个月。RDH5高表达的DFS、OS时间较低表达患者缩短,差异有统计学意义(P<0.05),见图5、表2。
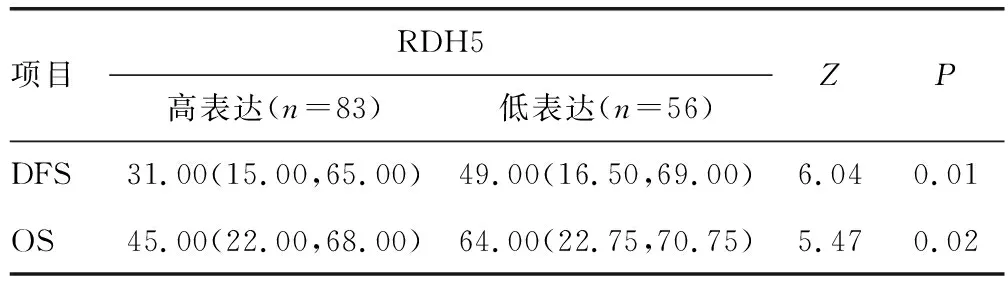
表2 RDH5高低表达的DFS、OS时间比较[M(Q1,Q3),月]

A:DFS;B:OS。图5 RDH5高表达与低表达肺腺癌患者的Kaplan-Meier生存曲线
单因素分析显示,不同性别、肿瘤大小、肿瘤分化程度、淋巴结转移、AJCC分期的DFS、OS比较,差异有统计学意义(P<0.05),见表3。将差异有统计学意义的单因素分析结果纳入多因素分析,结果显示RDH5高表达提示患者的不良预后(P<0.05),见表4。

表3 影响肺腺癌患者DFS、OS的单因素分析[M(Q1,Q3),月]

表4 影响肺腺癌患者DFS、OS的多因素分析
3 讨 论
尽管已经做出了巨大的努力,但NSCLC患者的预后仍未得到改善。在过去10年中,分子靶向治疗的发展对肺腺癌的治疗方法产生了巨大影响,小分子酪氨酸激酶抑制剂的使用进一步延长了表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性大细胞淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、c-ros肉瘤致癌因子-受体酪氨酸激酶(ROS proto-oncogene 1,receptor tyrosine kinase,ROS1)和神经营养因子受体络氨酸激酶(neurotrophin receptor kinase,NTRK)突变患者的生存期[14-15]。
本研究发现,肺腺癌高表达RDH5,与疾病预后、细胞生长和凋亡等方面密切相关,是肺腺癌发生、发展过程中的关键分子。RDH5的发现是由于其在视网膜色素上皮循环中的重要作用,它是将11-顺-维生素A转化为11-顺-视黄醛的关键酶,该基因的突变可能导致视网膜色素变性引起眼病[16]。尽管很少有组织学研究报道RDH5表达与癌症之间的关系,但近年研究显示,RDH5在结直肠癌、肝癌和胃癌中表达异常,且导致预后不良[9-12]。也有报道指出,RDH5在雌激素受体阴性乳腺癌中高表达,导致肿瘤进展及耐药[13]。RDH5在早期胃癌中发生突变,是早癌发生的驱动因素[11],但RDH5在肝细胞癌中的突变率较低[12]。RDH5与肿瘤表观遗传学改变存在相关性,与非肿瘤组织相比,RDH5在甲状腺乳头状癌中甲基化程度低,这表明DNA甲基化能够调节RDH5的表达。相似的结论在肝细胞癌中也有报道,即肝癌中存在明显的RDH5 DNA甲基化修饰异常[12]。目前,RDH5在肿瘤中的生物学功能暂不能统一,但根据已知的研究报道,RDH5有其双刃剑的作用,在不同的癌症中的不同表达会有不同的功能。因此,明确其上下游的信号通路对研究RDH5有重要意义。
本研究发现RDH5在肺腺癌中特异性表达,通过激活caspase3介导了细胞凋亡。既往研究一度认为细胞凋亡是唯一受调控的细胞死亡机制,但随着近年来对介导细胞死亡机制的理解不断加深,除了细胞凋亡外,坏死性凋亡、细胞焦亡和细胞自噬都是受调控的细胞死亡机制[17]。而寻找各种抗癌机制引起细胞死亡可能会引领新的靶向治疗方案的制订。其中细胞凋亡的特点是细胞收缩、染色质浓缩、核碎裂、质膜起泡和邻近吞噬细胞清除碎片[18],在本研究中,下调RDH5后肺腺癌细胞表现出活性减低并抑制增殖。在进一步的实验中,发现下调RDH5的表达可以诱导肺腺癌细胞凋亡,且证明RDH5在肺腺癌细胞系中会关联caspase3介导的细胞凋亡过程,导致肺腺癌细胞死亡。caspase3是刺激癌症细胞凋亡的关键分子,是一种无活性二聚体,通过某个亚基的蛋白水解切割启动激活,不同的蛋白酶切割caspase3酶原以激活caspase3。cleaved-caspase3是caspase3的激活形式,是促进细胞凋亡的主要裂解酶[19]。cleaved-caspase3进一步切割不同的底物,导致蛋白酶级联放大,最终导致细胞凋亡,切割的底物导致蛋白质功能的改变,从而导致与细胞凋亡相关的细胞变化。因此,caspase3激活意味着诱导细胞凋亡[20]。本研究证实RDH5可以调节caspase3的表达来调控细胞凋亡过程,虽然不能明确更具体的机制,但根据既往的报道,RDH5可以调控HIPPO通路[12],而HIPPO通路与细胞死亡有密切关联[21],可以推测RDH5可能通过HIPPO通路调控细胞凋亡过程,但仍需要更多的证据。此外,caspase3除了介导细胞凋亡,还可以通过裂解焦孔素(gasdermin,GSDME)来诱导细胞焦亡[22]。且有报道表明,细胞凋亡后会继发性引起细胞焦亡,所以RDH5有介导细胞焦亡的可能性,不过这仍需更多的证据表明,包括细胞形态和信号通路的验证。
综上所述,RDH5主要在肺腺癌组织中表达,其可通过抑制caspase3的激活来逃避细胞凋亡,从而增强细胞生存能力和耐药性。因此,RDH5可能是肺腺癌患者预后的新治疗靶点。
