CMTM6基因对肝内胆管癌侵袭转移的影响*
2023-10-11刘承祥梁后杰
刘承祥,董 严,梁后杰
(陆军军医大学第一附属医院肿瘤科,重庆 400038)
肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)是一种恶性程度高的上皮来源的肿瘤,具有高度的异质性和侵袭性[1],ICC是第二常见的原发肝脏恶性肿瘤,在所有消化道肿瘤中占比约3%[2-3]。随着非酒精性脂肪性肝炎和丙型肝炎患病率的增加,ICC的发病率在全球范围内不断增加,过去10年的年均增长率约为4.4%。ICC早期被诊断且同时接受治疗性手术的患者5年生存率约为30%,但诊断为晚期疾病的患者可供选择的治疗手段有限,预后不良,5年生存率仅约5.7%[4]。影响ICC患者生存率的关键因素是临床发现多在晚期,且局部或远处转移较早[5-8],同时,ICC患者通常容易对化疗产生耐药[9-10]。因此,深入研究影响ICC侵袭转移的相关因素,为ICC的临床预测及治疗提供新的思路和方向,是当前急需解决的一大难题。
含家族成员6的趋化因子样奇迹跨膜结构域(chemokine-like marvel transmembrane domain containing family member 6,CMTM6)参与基因的表观遗传调控和肿瘤发生[11]。CMTM6在不同肿瘤当中作用不尽相同,在许多癌症中通过调节肿瘤微环境中的肿瘤细胞、免疫细胞在肿瘤微环境中发挥作用,特别是对程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)的调节起关键作用[12]。有研究显示,CMTM6和PD-L1共表达与结直肠癌中活跃的免疫微环境和良好的预后相关[13],进一步研究发现具有该特征类型的结直肠癌肿瘤微环境中的M2型巨噬细胞明显升高[14]。CMTM6通过调节T细胞活化和抗肿瘤反应在恶性胶质瘤中发挥重要作用[15]。在肝细胞癌中,CMTM6与PD-L1共表达与高密度的炎性细胞有关,在体外和体内均可诱导细胞周期阻滞并抑制肝癌细胞的增殖,同时CMTM6的高表达是预测肝癌复发的一个重要因素[12,16-17]。在胃癌中,高表达的CMTM6与预后不良相关,PD-L1同时高表达则预后更差[11]。在转移性乳腺癌患者中,CMTM6阻断剂与PD-L1阻断剂的联合使用可提高免疫治疗的应答率[18]。CMTM6与PD-L1在质膜和循环内切体中共定位,可使PD-L1作为溶酶体介导降解的靶点的特点被抑制,CMTM6耗竭或减少PD-L1在体外和体内均可使肿瘤特异性T细胞的抑制作用被明显减弱[19]。既往研究主要聚焦于CMTM6在影响结直肠癌、胃癌、乳腺癌、肝细胞癌及非小细胞肺癌等肿瘤的功能作用及机制研究,尚无关于CMTM6对ICC作用的研究。因此,本研究旨在探讨CMTM6促进ICC进展中的作用特点,以期为临床治疗ICC提供新靶点和新思路,现报道如下。
1 材料与方法
1.1 材料
1.1.1细胞、组织与实验动物
shRNA(CMTM6 KD)慢病毒和对照慢病毒购自上海吉满生物科技有限公司;人ICC组织芯片(155例,芯片货号:HBDIC122SU01-M-033)购自上海芯超生物科技有限公司;裸鼠(20只,雄性,6周龄,15~17 g)购自重庆恩斯维尔生物科技有限公司。
1.1.2主要试剂
DMEM培养基、0.25%胰蛋白酶、青-链霉素溶液购自美国HyClone公司;胎牛血清购自美国Gibco公司;Western及IP裂解液、蛋白酶抑制剂、一抗二抗稀释液、BCA蛋白浓度测定试剂盒、结晶紫染液购自上海碧云天生物技术有限公司;兔抗人CMTM6、兔抗人β-catenin、鼠抗人Snail抗体购自英国Abcam公司;羊抗兔二抗、羊抗鼠二抗、GAPDH抗体及增强化学发光法(enhanced chemiluminescence,ECL)发光液购自美国Affinity公司;细胞增殖试剂盒购自美国GeneCopoeia公司;PCR引物、RNA提取试剂、逆转录试剂盒、逆转录PCR SYBRGree购自日本TaKaRa公司。
1.2 方法
1.2.1细胞培养及转染
人ICC RBE细胞株复苏于本院肿瘤科实验室,用DMEM完全培养基复苏细胞后置于37 ℃,5% CO2的细胞培养箱中常规培养,定期观察细胞密度及状态,待细胞达到一定密度且处于对数生长期时,消化、离心、重悬RBE细胞,细胞计数后接种于24孔板内(1×105个/孔),并加入0.5 mL DMEM完全培养基培养24 h后按说明书加入慢病毒稀释液,通过慢病毒转染构建敲低CMTM6基因的RBE细胞(RBE-CMTM6-KD),同时建立RBE细胞的对照细胞(RBE-Con),继续培养48 h后消化传代,继续培养细胞,嘌呤霉素筛选转染细胞,存活的细胞充分扩增传代,进行CCK-8检测、Western blot实验及实时荧光定量PCR(real-time fluorescence quantitative PCR,qPCR)等后续实验。
1.2.2Western blot检测蛋白表达
用含有蛋白酶抑制剂的Western及IP裂解液分别提取处于对数生长期的RBE-CMTM6-KD及RBE-Con两种细胞总蛋白,冰上充分裂解30 min;4 ℃离心30 min,13 000 r/min,转移上清液至新EP管中,按BCA试剂盒说明步骤测定总蛋白浓度。30 μg蛋白上样,常规电泳、转膜、封闭后4 ℃ 摇床分别孵育CMTM6、β-catenin、Snail(均按1∶1 000配置)兔抗人特异性一抗及GAPDH抗体(1∶5 000)过夜,次日二抗孵育(羊抗兔,1∶10 000),ECL Bio-Rad成像系统显影,Image J及GraphPad Prism7.0软件半定量统计分析。
1.2.3定量PCR分析
定量PCR分析采用TRIzol试剂盒,分别提取处于对数生长期的RBE-CMTM6-KD 及RBE-Con总RNA,超微量分光光度计检测总RNA浓度,经逆转录获得总cDNA,而后上机检测并比较各组细胞CMTM6表达水平。
1.2.4CCK-8法检测细胞存活
分别取处于对数生长期的RBE-CMTM6-KD及RBE-Con,按5 000个/孔、每种细胞设置3个复孔、接种于96孔板中,将细胞置于孵箱中培养贴壁后继续于孵箱中培养48 h,而后行CCK-8检测。加入CCK-8(孵箱中继续孵育2 h),使用酶标仪在450 nm处检测吸光度(A)值,GraphPad Prism7.0软件分析计算各组细胞的存活率。
1.2.5克隆形成及结晶紫染色实验
分别将处于对数生长期的RBE-CMTM6-KD及RBE-Con各5 000个接种于6孔板内,每组各设2个复孔。37 ℃、5% CO2培养箱中培养14 d,每3天进行1次换液,定期观察细胞生长及成球情况,丢弃孔板中的旧培养基后用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗3遍,加入适量4%多聚甲醛常温固定15 min。PBS洗3遍,适量结晶紫染液常温染色25 min,PBS洗3遍,常温风干后拍照,计算分析集落数目。
1.2.6侵袭迁移实验
分别将处于对数生长期的RBE-CMTM6-KD及RBE-Con用胰酶消化、离心后用DMEM(不含血清)重悬细胞(细胞浓度调整至5×105个/mL),向24孔板下室每孔中加入600 μL的DMEM培养基(含20%胎牛血清),Transwell小室中加入100 μL细胞悬液,常规培养24 h。4%多聚甲醛常规固定、结晶紫常规染色,用棉签擦掉上层未迁移的细胞后拍照计数。
1.2.7划痕实验
在6孔板背面划横线(用maker笔比着直尺划),而后分别将处于对数生长期的RBE-CMTM6-KD及RBE-Con消化、离心、重悬计数,将细胞按5×105个/孔、每种细胞3个复孔种植于6孔板中,孵箱中常规培养过夜。次日细胞贴壁后用枪头垂直于背后的横线划痕,继续放入孵箱中培养,分别于0、12、24 h拍照。
1.2.8裸鼠成瘤
10只裸鼠分为两组,将RBE-CMTM6-KD及RBE-Con两种细胞用PBS重悬,于裸鼠的右大腿外侧进行瘤细胞皮下注射(每只按1×106个细胞注射),定期监测肿瘤生长情况。测量肿瘤的3个垂直直径并使用公式估计肿瘤体积[V=π/6×长度(mm)×宽度(mm)×高度(mm)]。最大单个肿瘤体积达到2 000 mm3前处死裸鼠,解剖取出瘤体,拍照、称量、测量瘤体大小并做好记录。
1.2.9裸鼠肺转移实验
10只裸鼠分为两组,将BE-CMTM6-KD及RBE-Con两种细胞(3×106个)分别混于300 μL PBS中,通过尾静脉将瘤细胞悬液注射到裸鼠体内,活体成像技术定期监测裸鼠肺部肿瘤的生长情况(分别与第7、14天进行活体成像),后处死裸鼠,解剖并拍照。
1.2.10免疫组织化学染色
组织芯片放置于60 ℃烤箱(处理8 h),常规步骤进行脱蜡、水化、3%过氧化氢封闭、乙二胺四乙酸抗原修复、血清封闭,一抗4 ℃(稀释CMTM6至工作浓度,1∶100)孵育过夜,根据免疫组织化学试剂盒说明书完成二抗孵育及剩余染色步骤后脱水、风干、中性树胶封片、拍照采图。
参照免疫组织化学相关评判标准及本抗原特异性膜表达的特点对染色结果进行判定(半定量法),细胞膜出现棕黄色颗粒为阳性结果(细胞膜非颗粒状棕黄色及细胞膜以外的着色视为非特异性着色)。染色强度计分方法:棕褐色、棕黄色、浅黄色、无阳性着色分别计3、2、1、0分;阳性细胞数比例计分标准:细颗粒状棕黄色着色(真阳性)细胞数百分比<5%,0分;5%~<26%,1分;26%~<51%,2分;51%~75%,3分;>75%,4分。染色强度得分与阳性细胞百分比得分相乘,0~7分判定为蛋白低表达,>7分判定为蛋白高表达。
1.2.11CMTM6表达在ICC患者中的预后分析
使用155例ICC组织芯片,采用染色强度计分法,根据ICC组织标本中的肿瘤区域CMTM6的染色强度分为CMTM6高表达组(n=89)和CMTM6低表达组(n=66)。利用Kaplan-Meier法对两组进行生存分析,采用log-rank检验比较两组总生存(overall survival,OS)情况。
1.3 统计学处理

2 结 果
2.1 RBE-CMTM6-KD及RBE-Con模型的建立和鉴定
Western blot结果显示,RBE-CMTM6-KD中CMTM6、Snail蛋白表达水平低于RBE-Con,β-catenin表达水平高于RBE-Con(P<0.05)。qPCR结果显示,RBE-CMTM6-KD中CMTM6 mRNA表达水平低于RBE-Con(P<0.05),见图1。

A:Western blot检测两种细胞蛋白的表达情况;B:两种细胞蛋白表达水平比较;C:两种细胞CMTM6 mRNA表达水平比较;a:P<0.05,与RBE-Con比较。图1 RBE-CMTM6-KD及RBE-Con模型的建立和鉴定
2.2 细胞存活、增殖、侵袭迁移实验
与RBE-Con比较,24、48 h RBE-CMTM6-KD细胞存活率更低,增殖能力、侵袭迁移能力减弱(P<0.05),见图2。
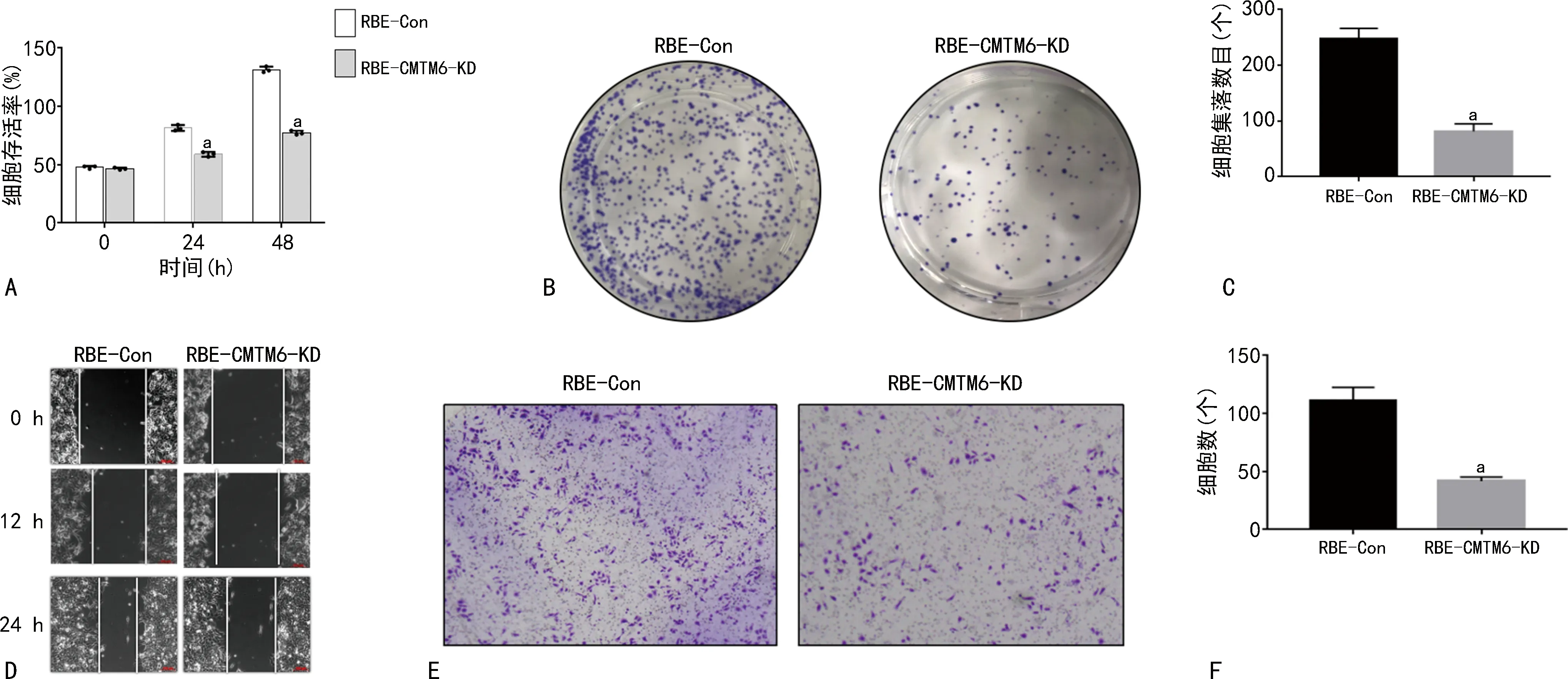
A:两种细胞存活率比较;B、C:平板克隆形成及结晶紫染色实验检测两种细胞14 d的生长情况;D:划痕实验检测两种细胞生长增殖能力;E、F:侵袭迁移实验检测两种细胞侵袭迁移能力;a:P<0.05,与RBE-Con比较。图2 细胞存活、增殖、侵袭迁移实验
2.3 两种细胞构建的裸鼠皮下成瘤能力及转移能力比较
RBE-CMTM6-KD构建的裸鼠皮下成瘤的最终质量低于RBE-Con[(26.4±0.7)mgvs.(173.9±12.8)mg],差异有统计学意义(P<0.05)。第11、14、17、20天,RBE-CMTM6-KD构建的裸鼠肿瘤体积小于RBE-Con(P<0.05)。第7、14天,RBE-KD-CMTM6构建的裸鼠肺部转移瘤的转移能力低于RBE-Con(P<0.05),见图3。
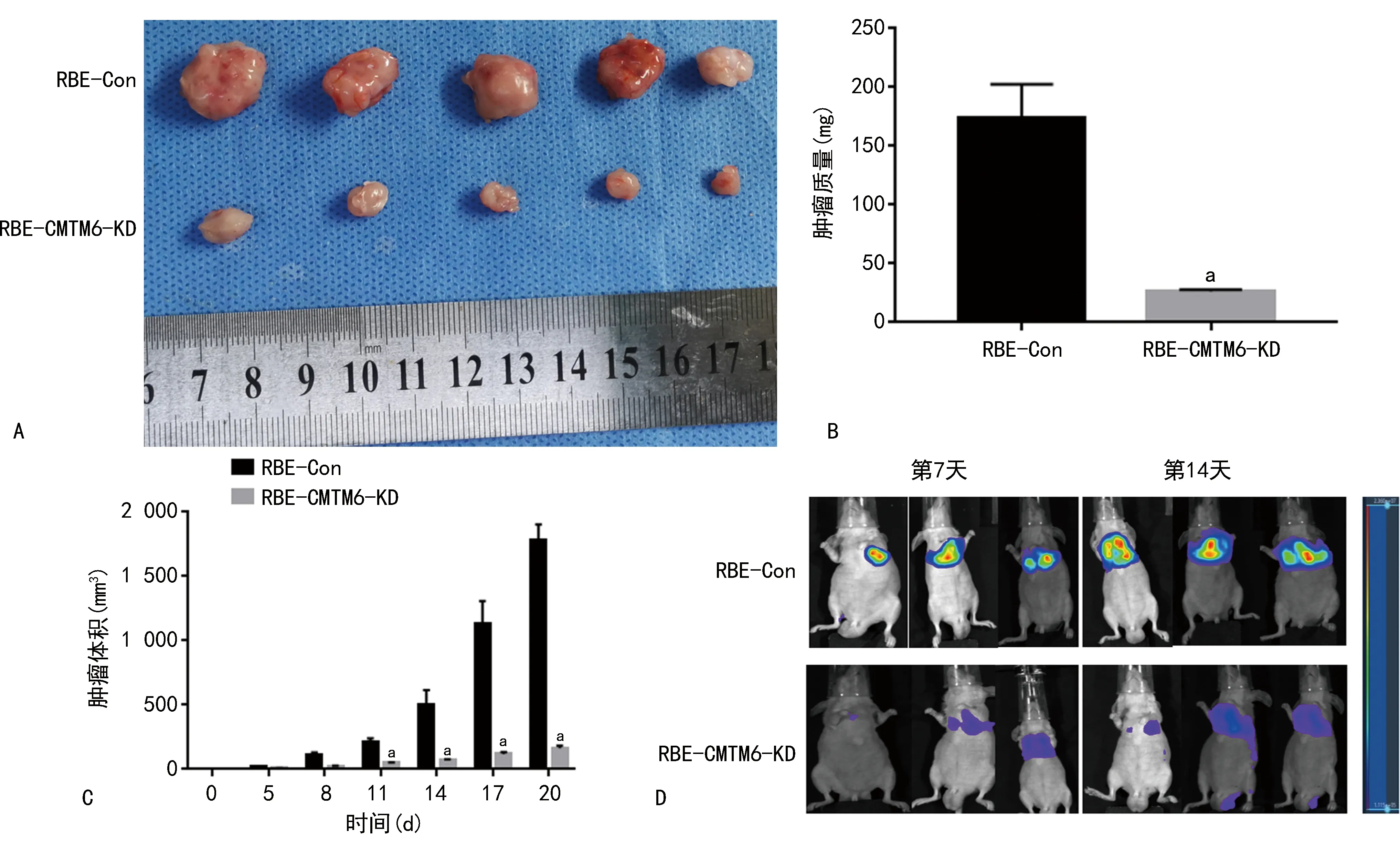
A:两种成瘤裸鼠分离的肿瘤大体标本;B:两种成瘤裸鼠分离的肿瘤质量比较;C:两种成瘤裸鼠分离的肿瘤体积随时间变化的情况两种成瘤裸鼠肺部转移模型中通过活体成像检测在第7、14天的生长情况;a:P<0.05,与RBE-Con比较。图3 两种细胞构建的裸鼠皮下成瘤能力及转移能力比较
2.4 人ICC组织内CMTM6的表达
CMTM6在癌旁正常胆管组织中几乎不表达,而在ICC组织中的表达水平高于癌旁正常胆管组织,且低分化ICC组织中的表达水平高于高分化ICC组织,见图4。
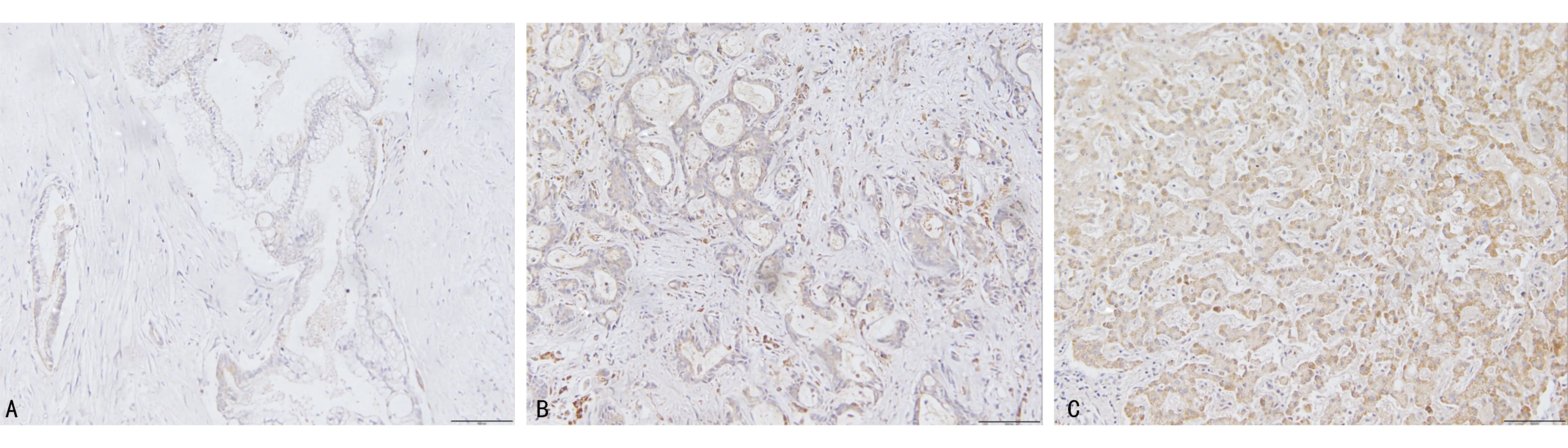
A:癌旁组织中正常胆管腺体;B:高分化ICC组织;C:低分化ICC组织;光学显微镜下评分法结果显示,A得分1×0=0(分),B得分2×2=4(分),C得分3×3=9(分)。图4 CMTM6在癌旁组织、不同分化程度ICC组织中的表达情况(免疫组织化学染色,200×)
2.5 不同CMTM6表达强度的ICC患者间的生存分析
与CMTM6低表达组比较,CMTM6高表达组OS时间明显缩短(P<0.05),见图5。

A:全体ICC患者的OS曲线分析;B:CMTM6高低表达组的OS曲线分析。图5 不同CMTM6表达强度的ICC患者间的生存分析
3 讨 论
本研究采用慢病毒转染方法构建CMTM6敲低的RBE细胞株(RBE-CMTM6-KD)及对照细胞(RBE-Con),Western blot及qPCR实验证实了细胞模型构建成功。同时,对临床病例进行随访,由于病例较为久远,无瘤生存期、复发情况等数据未获得完整信息,但OS取得了相对完整的随访数据。
本研究结果显示,在细胞实验中,与RBE-Con比较,RBE-CMTM6-KD生长速度、成球能力、侵袭迁移能力减弱(P<0.05);在动物体内实验中,与RBE-Con比较,RBE-CMTM6-KD的致瘤性及转移能力也明显减弱(P<0.05)。此外,人ICC组织免疫组织化学染色及生存分析结果提示,CMTM6高表达水平较低表达水平的OS明显缩短(P<0.05)。这些结果与既往关于CMTM6在多数其他癌种中的研究结果一致,但CMTM6对于促进ICC侵袭转移能力的具体作用机制还不明确。相关研究表明,CMTM6通过与NRP1相互作用促进口腔鳞状细胞癌细胞增殖和侵袭[20];CMTM6通过与肝癌细胞中的Vimentin相互作用并稳定Vimentin来促进迁移、侵袭和上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)[21]。在其他多种肿瘤的研究中,通过对癌组织及癌旁组织的生物信息数据分析,结果显示CMTM6与PD-L1存在高度的共表达关系,细胞免疫荧光显示CMTM6与PD-L1在肿瘤细胞的多个部位共定位。利用肿瘤组织标本在蛋白及mRNA层面也证实了CMTM6与PD-L1表达的相关性[7,12,22]。同时,PD-L1高表达使肿瘤细胞处于免疫逃逸状态,与不良预后密切相关。结合本研究结果,笔者认为,在ICC中,CMTM6可能通过与PD-L1的共表达,进一步降低肿瘤细胞对于免疫微环境的反应性,从而促使ICC进展。
综上所述,高表达CMTM6明显促进ICC的发生、发展,同时,CMTM6可能通过与PD-L1的共表达作用降低了肿瘤细胞对于免疫微环境的反应性,从而促使ICC进展。由于客观条件限制,部分机制还未详尽验证,未来将重点验证CMTM6在ICC中与肿瘤微环境的作用特点及与PD-L1的关联性,以期在现有表型的基础上进一步挖掘出CMTM6在ICC中作用的分子机制,为ICC的临床治疗提供新思路。
