改良类Fenton法降解亮绿染料的研究
2023-10-10董洪霞唐丽秋汪钰涵王春丽
董洪霞,唐丽秋,汪钰涵,王春丽
(上饶师范学院化学与环境科学学院,江西 上饶 334001)
我国每年纺织废水的排放量约为2.37×109t,其中,印染废水占80%,处理难度大[1],全行业废水处理后回收率仅在10%左右[2]。亮绿是三苯甲烷类阴离子染料,易溶于水,呈绿色,常用来对动植物组织染色[3],亦常用做羊毛、丝绸、棉麻等织物染色的染料,排入水体会导致严重的健康问题,如胃肠道感染、皮肤肿胀和呼吸困难等[4]。亮绿如未经处理直接排放到河流中将会对生态环境造成严重影响。因此,对印染废水进行有效的处理是十分必要的。
目前,我国印染废水的处理常用物理法(吸附法[5-7]、膜分离技术[8-10])、高级氧化技术[11-13]、高效生物技术[14-16]等。Fenton氧化法就是一种高级氧化技术,可借助反应过程中产生的·OH 自由基分解染料分子,使之转化成无害的低分子物质[1],该技术已成为印染废水深度处理的研究热点。关于铁(Ⅲ)-草酸盐络合物/过氧化氢体系紫外光降解刚果红[17]和甲基蓝[18]、罗丹明6G[19]、孔雀石绿[20]以及苯胺[21]的研究已有报道,但利用铁(Ⅲ)-草酸盐络合物/过氧化氢体系降解亮绿染料的研究尚未见报道。研究以亮绿为目标污染物,采用铁(Ⅲ)-草酸盐络合物/过氧化氢体系降解亮绿染料,取得较好的降解效果。
1 试验材料与方法
1.1 主要仪器
722 G 可见分光光度计、ZF-I三用紫外分析仪、p HS-2C 型精密p H 计、JE503G 电子天平、微量进样器等。
1.2 主要试剂
亮绿、Fe2(SO4)3、二水合草酸、浓硫酸、30%(质量分数)H2O2等。试剂均为分析纯。蒸馏水自制。模拟染料废水:1.0 g/L亮绿标准溶液。
1.3 试验方法
移取1.0 g/L亮绿标准溶液0.8 m L于50.00 m L具塞比色管中,加入5.0 g/L Fe2(SO4)3溶液1.0 m L、10.0 g/L草酸溶液0.08 m L、3%(质量分数)H2O2溶液0.06 m L,然后用蒸馏水定容至刻线,摇匀。再用1.0 mol/L H2SO4溶液调节p H 至3.0±0.1,摇匀。置于365 nm 紫外光下降解反应15 min后取出,用10 mm比色皿,在632 nm 处测定其吸光度,计算亮绿染料的脱色率[20,22]。
1.4 脱色率的计算[20]
脱色率的计算公式为:D=[(1-A)/A0]×100%。式中A0表示光照前溶液的吸光度,A 表示光照后溶液的吸光度。
2 结果与分析
2.1 试验条件的优化
2.1.1 亮绿特征波长的测定
先将1.0 g/L亮绿标准溶液配成8.0 mg/L的亮绿标准使用液[20],移取适当体积于10 mm 比色皿中,在610-645 nm 范围内,每隔2-5 nm 测定一次吸光度[22],结果如图1所示。由图1可知,在610-645 nm 范围内,吸光度随波长先增大再减小,于632 nm 处有最大吸收,故选亮绿最大吸收波长为632 nm[20]。

图1 亮绿最大吸收波长的选择
2.1.2 紫外灯的光照条件对脱色率的影响
取10支50.00 m L的具塞比色管,按1.3试验方法,配成两组反应体系,分别置于365 nm 和254 nm 的紫外光下进行光降解反应,每隔5 min测定其吸光度,计算亮绿的脱色率[20],结果如图2所示。由图2可知,在365 nm 下进行光降解反应体系的脱色率明显高于254 nm 处反应体系的脱色率[20]。在254 nm 条件下,反应体系的脱色率在30 min内一直处于逐渐上升状态,图呈线性,当反应时间为30 min时,亮绿的脱色率最大,达58.8%。在365 nm 条件下,反应体系的脱色率急剧增大并在15 min后达到平衡,图呈抛物线型,当反应时间为15 min时,亮绿的脱色率最大,达97.27%。故选择365 nm 紫外灯照射时间为15 min。
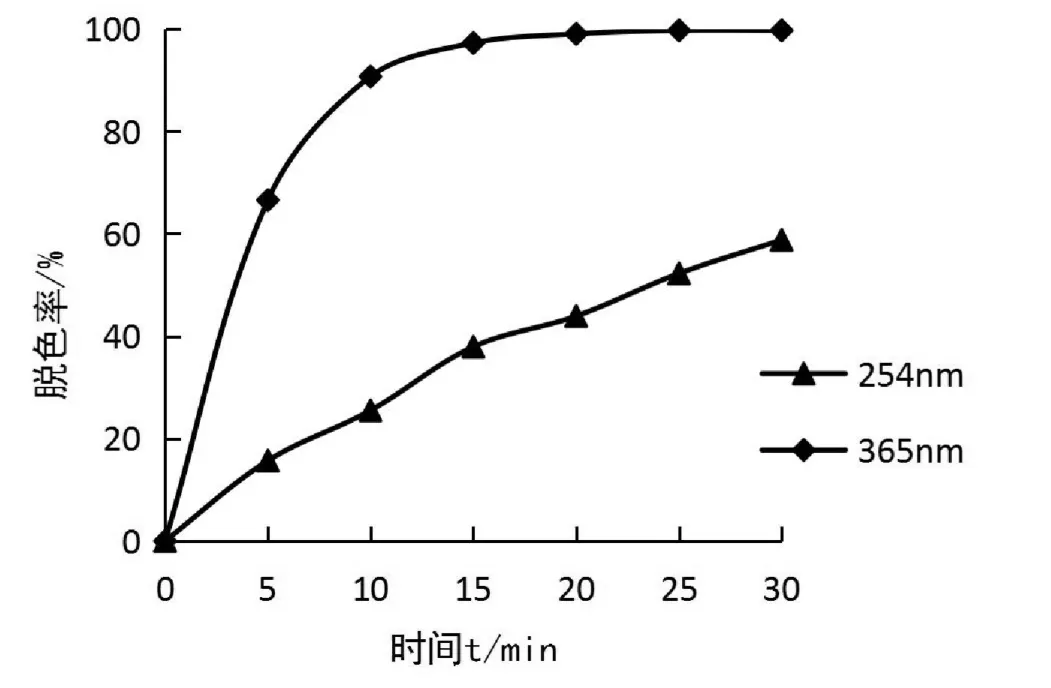
图2 紫外灯的光照波长对亮绿脱色率的影响
2.1.3 Fe2(SO4)3用量对亮绿脱色率的影响
改变5.0 g/L Fe2(SO4)3溶液的用量,分别为0.02、0.04、0.06、0.08、0.10、0.20、0.30、0.40、1.0、2.0 m L,按1.3试验方法,测定反应体系的吸光度,并计算脱色率,结果如图3所示。由图3可知,随着Fe2(SO4)3溶液用量的增加,脱色率发生明显变化。当Fe2(SO4)3溶液用量小于1.0 m L 时,随着Fe2(SO4)3溶液用量的增加,脱色率急剧增大,但当Fe2(SO4)3溶液用量大于1.0 m L时,脱色率则逐渐呈降低趋势。这主要是因为,当草酸溶液含量一定时,Fe2(SO4)3用量增加会使生成的草酸铁络合物的含量增加,使其催化能力增强,进而提高亮绿的脱色率[23]。但是,当Fe2(SO4)3用量大于1.0 m L 时,Fe2+会通过竞争作用争夺体系中产生的·OH,从而不利于亮绿染料的氧化分解。故选择5.0 g/L Fe2(SO4)3溶液的最佳用量为1.0 m L。
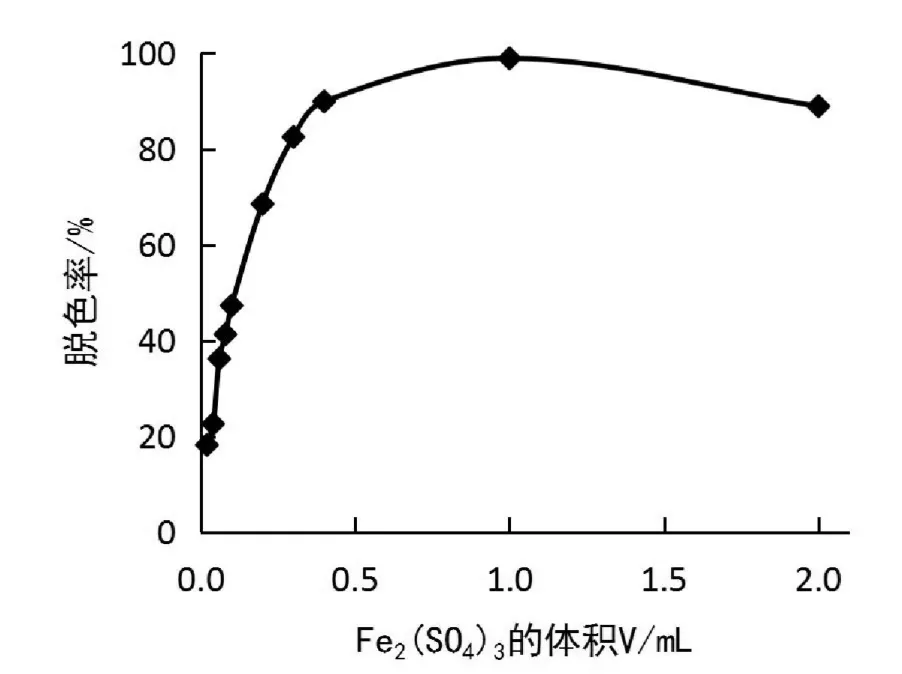
图3 Fe2(SO4)3用量对亮绿脱色率的影响
2.1.4 草酸用量对亮绿脱色率的影响
改变10.0 g/L 草酸溶液加入量,用微量进样器依次移取0.02、0.04、0.06、0.08、0.10、0.20、0.30、0.40 m L,由于草酸加入量的不同,导致p H 值发生变化,违背了单一变量原则,所以应保持反应体系p H 值为3.0±0.1左右,按1.3试验方法,测定反应体系的吸光度,并计算亮绿的脱色率,结果如图4所示。由图4可知,当Fe2(SO4)3溶液含量一定,草酸溶液加入量小于0.08 m L 时,随草酸加入量的增加,脱色率逐渐增大,这是因为草酸含量增加会使生成的草酸铁络合物的含量增加,使其催化能力增强,进而提高脱色率[23]。当草酸加入量超过0.08 m L时,脱色率逐渐下降,因为草酸根过量,它会争夺体系中产生的·OH,从而使体系的氧化能力减弱[23],过量的草酸也会阻碍这一过程中间产物的进一步分解。故本试验选择10.0 g/L草酸最佳用量为0.08 m L。
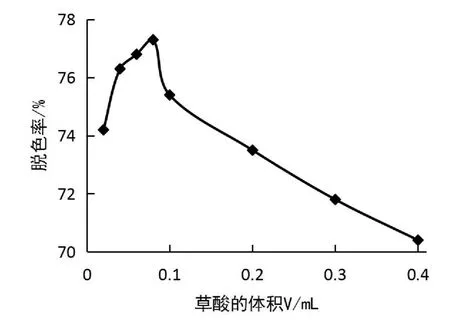
图4 草酸用量对亮绿脱色率的影响
2.1.5 H2O2用量对亮绿脱色率的影响
改变3%(质量分数)H2O2的加入量,用微量进样器依次移取0.02、0.04、0.06、0.08、0.10、0.20、0.30 m L,按1.3 试验方法,测定反应体系的吸光度,并计算脱色率,结果如图5 所示。由图5 可知,加入H2O2对反应体系的脱色率影响显著。在0.02-0.30 m L范围内,亮绿的脱色率随H2O2用量的变化先增大后减小,在H2O2用量为0.06 mL时,亮绿的脱色率最高,达73.6%[20]。因为H2O2本身也能吸收·OH[24],这样不但消耗·OH,还会导致H2O2的无效分解[25]。故本试验选择H2O2溶液的最佳用量为0.06 m L。

图5 H2 O2用量对亮绿脱色率的影响
2.1.6 p H 对亮绿脱色率的影响
用1.0 mol/L硫酸调节反应体系至不同p H 值,依次为2.0、2.1、2.2、2.3、2.4、2.5、3.0、3.5,按1.3试验方法,测定反应体系的吸光度,并计算亮绿的脱色率,结果如图6所示。由图6可见,p H 在2.0-3.0范围内,随着p H 的增加,脱色率急剧增大;当p H 大于3.0时,脱色率逐渐降低。当p H 为3.0时,亮绿的脱色率最大。这是因为p H 值过高时,又会生成过多HO2·自由基,这种基团对有机物没有活性[26]。但当p H 值很小时,会使溶液中H+浓度过高,使Fe3+不能顺利地被还原为Fe2+,催化反应受到阻碍,酸度过高也增加了氧化剂H2O2自身的分解[26]。故选最佳p H 为3.0。
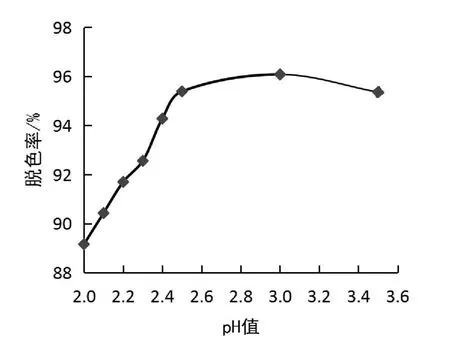
图6 pH 对亮绿脱色率的影响
2.2 正交试验
以亮绿的脱色率为研究指标,先选择Fe2(SO4)3投加量、草酸投加量、H2O2投加量、p H 值这四个对降解效果影响较大的因素[20],再将这四个影响因素分别选取3个水平,探究这四个因素对降解亮绿的效果,设计四因素三水平的因素分析表[20](见表1)。分别测定出各组条件下亮绿的脱色率(见表2);然后计算出各影响因素的极差R,选择最优水平方案[20](见表3)。

表1 因素分析表L 9(34)

表2 正交试验设计及结果
由表3可知,RA>RB>RC>RD,通过极差R 的大小可得出最大与最小的影响因素[27],即:Fe2(SO4)3投加量对亮绿的脱色率的影响最大,p H 的影响最小。由表3的试验结果得出最优水平设计方案为A2B2C2D1,即最佳试验条件:Fe2(SO4)3溶液的投加量为1.0 m L,H2C2O4溶液的投加量为0.08 m L,H2O2溶液的投加量为0.06 m L,p H 为3.0[20]。
2.3 验证试验
为验证正交所得的最优水平设计方案的可行性,将所得的最佳方案A2B2C2D1进行3次重复试验。由表4可知,亮绿染料的平均脱色率为98.68%,降解效果较好[20]。
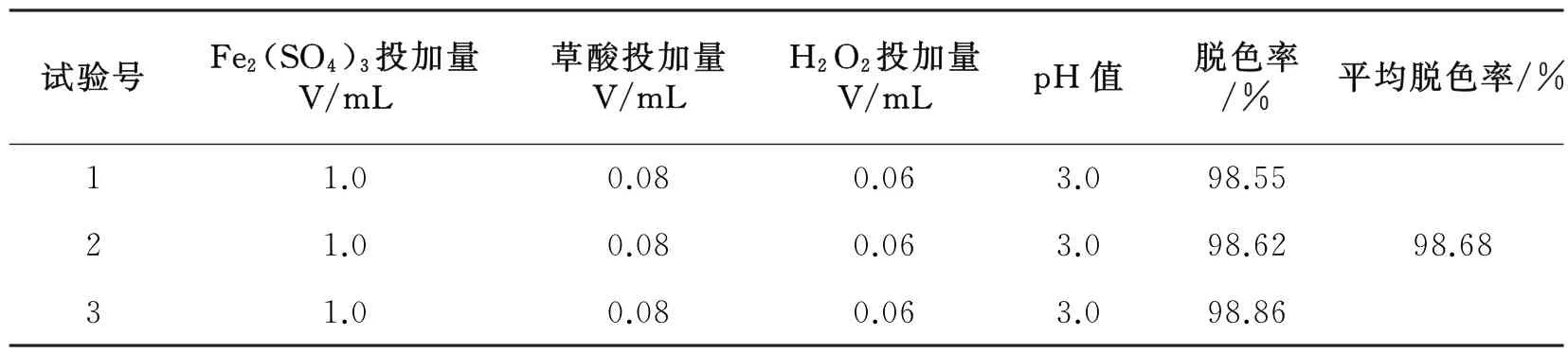
表4 最佳方案验证试验
3 结论
在632nm 紫外灯照射下,采用H2C2O4—Fe2(SO4)3—H2O2类Fenton体系降解亮绿染料,通过对各试剂使用量的优化,亮绿的平均脱色率可达98.68%,降解效果较好。此法操作简单,反应快捷安全,试剂消耗少,成本低,对环境污染小,在染料废水处理方面具有较好的应用前景。
