槲皮素通过抑制支气管哮喘大鼠miR-155表达重塑Th17/Treg细胞平衡的机制研究*
2023-10-10杨昊若
杨昊若 杨 斌
(1.天津中医药大学,天津 301617;2.中国中医科学院西苑医院,北京 100091)
支气管哮喘(简称哮喘)是一种常见的慢性呼吸道疾病,严重影响患者的正常生活。根据流行病学调查显示,近年来哮喘发病率不断攀升,全球哮喘患者已达3.58 亿,已成为全球性健康问题[1]。哮喘实质是由多种炎性细胞和炎性介质共同参与的慢性炎症气道反应,以气道重塑和气道高反应性为典型病理特征。辅助性T细胞(Th)是哮喘的气道炎症反应中重要的免疫细胞,其亚群Th1/Th2 的比例失调一直以来被认为是导致哮喘慢性气道炎症发生最主要的“罪魁祸首”。但随着当前对Th细胞的研究日益增多,这种观念已经无法充分阐释许多临床试验或预实验的结果。近年来研究发现[2],Th17 与调节性T 细胞(Treg)的比例关系在哮喘发生发展中亦发挥着至关重要的作用,Treg 细胞可分泌包括转化生长因子-β(TGF-β)、白细胞介素-10(IL-10)等在内的多种效应细胞因子以调节Th1/Th2的比例失衡,而与其同源的Th17 则通过分泌重要的促炎介质白细胞介素-17(IL-17)发挥着完全相反的作用。二者相互拮抗,共同维持着免疫的平衡。micro RNAs(miRNAs)是一种内源性非编码单链小分子RNA,以其对机体正常发育和免疫系统的重要调控作用为人们所熟知,而目前也已有相当数量的miRNAs 被证实在哮喘发病中起关键作用[3]。其中miR-155 是淋巴T细胞等多种免疫细胞发挥功能的必须miRNAs,其可通过多种信号通路及细胞效应因子调控Th17 和Treg 的分化,并在分子水平上调节两者的平衡,因此在未来治疗哮喘上将miR-155作为靶点具有很高的价值。
中医药在治疗哮喘上相较西药治疗具有多途径、多靶点、副作用少的显著优势。槲皮素(Quercetin)是一种植物衍生出的黄酮类化合物,来源于柴胡、菟丝子、甘草、旋覆花等多种中药材,具有止咳平喘和抗过敏等作用,在治疗哮喘上取得了不错的疗效[4]。前期动物实验发现[5],槲皮素可通过抑制microRNA-155(miR-155)表达,有效减缓哮喘气道炎症反应。但目前尚无关于槲皮素是否可通过下调microRNA-155(miR-155)表达,从而促使Th17/Treg 平衡以减缓哮喘症状的研究,具体作用机制仍不清晰。本研究拟通过OVA 激发致敏建立大鼠哮喘模型,检测槲皮素对哮喘大鼠IgE 及白细胞介素(IL-4、IL-5、IL-10、IL-17)水平、支气管病理形态变化及microRNA-155(miR-155)、Th17/Treg 平衡的关键蛋白维甲酸相关孤儿受体转录因子(RORγt)、叉状头/翅膀状螺旋转录因子(Foxp3)表达,以期探索槲皮素对哮喘的治疗作用及潜在机制。
1 材料与方法
1.1 动物
健康成年雄性SPF 级SD 大鼠60 只,体重150~200 g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2016-0001。饲养于中国中医科学院西苑医院实验中心动物房,温度20~24 ℃,湿度40%~60%。
1.2 药物与试剂
槲皮素(美国Sigma,货号PHR1488),卵蛋白(OVA)(美国Sigma,货号A5503,批号BC88709X),Al(OH)3凝胶(美国Thermo Fisher,货号77161,批号UE284411B),miR-155Antagomir 试剂(上海吉凯基因),地塞米松注射液(山东华信制药,批号37021466),白细胞介素(IL-4、IL-5、IL-10、IL-17)ELISA 试剂盒(武汉伊莱瑞特生物,批号分别为E-EL-R0014c、E-EL-R0558c、EEL-R0016c、E-EL-R0566c),苏木素-伊红染色试剂盒(北京索莱宝,货号G1120),RORγt、Foxp3 单克隆抗体(美国Abcam,货号分别为ab207028、ab215206),酶标山羊抗小鼠/兔IgG 聚合物(北京中杉金桥,货号PV6000),逆转录试剂盒和实时荧光定量PCR(美国Thermo Fisher)。402A 型超声雾化器(江苏鱼跃),LS-3750 型全自动高压灭菌器(日本三洋),LDZ5-2 型自动平衡离心机(北京京立),TP1020 型全自动脱水机(德国Leica),2016 型病理切片机(德国Leica),Olympus BX53型显微镜(日本Olympus),Image-Pro Plus 6.0(美国Media Cybernetics)。
1.3 模型制备
SD 大鼠分为正常组、模型组、地塞米松组、槲皮素低剂量组、槲皮素高剂量组、槲皮素+miR155 抑制剂组,每组10 只。除正常组外,其余各组于第1 天、第4天腹腔内注射10%OVA+10%AH(OH)3的PBS混合液1 mL 致敏,第7 天将大鼠依次置于超声雾化器中,1%OVA 雾化激发哮喘发作,空白组在相应时间点以PBS溶液代替OVA 进行腹腔注射及雾化吸入,当大鼠出现口唇发绀、呼吸加快、腹肌痉挛、点头呼吸或站立不稳等,表明造模成功[6]。
1.4 给药方法
地塞米松组每日给予地塞米松0.005 g/kg灌胃,槲皮素低、高剂量分别每日给予中药0.75、3.0 g/kg 灌胃,槲皮素组+miR155 抑制剂组除了每日槲皮素3.0 g/kg灌胃外,同时以miR-155Antagomir 100 mg/kg尾静脉注射,隔日1次,共3次。干预周期为2周。
1.5 标本采集与检测
1.5.1 支气管肺泡灌洗液(BALF)炎性细胞计数及分类 各组大鼠用2%戊巴比妥钠麻醉,剪去颈部毛发后剪开皮肤,去除气管周围组织,在气管上横行切口,插入气管插管。结扎右主支气管,经气管插管以PBS溶液10 mL 分3 次灌洗左肺后回收BALF,2 000 r/min离心15 min,弃上清液,取沉渣经生理盐水重悬,吸取少量细胞悬液置血细胞计数板下计算细胞总数。Diff-Quik染色涂片后,行炎性细胞分类并计数。
1.5.2 酶联免疫吸附法(ELISA)检测大鼠血清炎症介质水平 戊巴比妥钠麻醉大鼠,分离一侧颈总动脉,动脉取血5 mL,2 000 r/min 离心10 min,取上层血清,采用ELISA 检测血清中IL-4、IL-5、IL-10、IL-17、IgE 的水平,具体操作严格依照相应试剂盒说明书进行。
1.5.3 苏木精-伊红(HE)染色观察大鼠支气管病理学形态 取左肺组织固定于10%的甲醛溶液中,固定24 h,梯度乙醇脱水,常规石蜡包埋,4 μm 切片,HE 染色后,光镜下观察肺支气管病理形态学变化。
1.5.4 免疫组化(IHC)染色观察Foxp3、RORγ 蛋白表达 石蜡包埋后行厚度4 μm切片,烘箱70 ℃烤片1 h,二甲苯脱蜡,梯度乙醇脱水,3%H2O2避光10 min 灭活内源性酶,枸橼酸盐修复液(pH6.0)高压锅热修复3 min,滴加Foxp3、RORγ 抗体(浓度均为1∶200),4 ℃冰箱孵育过夜。次日PBS 冲洗后,滴加酶标山羊抗小鼠/兔IgG 聚合物,常温孵育30 min,DAB 显色,镜下控制反应时间,染色完成后自来水冲洗,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察,阳性信号为支气管黏膜及肺泡上皮细胞棕黄色颗粒,阴性对照用PBS 代替一抗,每张切片随机取5 个高倍视野(400倍),Image-Pro Plus 6.0软件测定阳性信号的平均光密度(IOD)值。
1.5.5 RT-PCR 法检测细胞中miR-155、Foxp3、RORγt表达 miR-155、Foxp3、RORγtmRNA 及内参基因βactin 的引物采用Primer5.0 软件设计,上海生工股份有限公司合成。引物序列为(miR-155 184 bp,上游5′-CCGTCGCTTCGGCAGCACG-3′,下游5′-GGCTAGCTTATGGCAGCC-3′;Foxp3 234 bp,上游-5′ACCTATGCCACCCTTATCC-3′,下游5′-GCTCCTCTTCTTGCGAA AC-3′ ;RORγt 150 bp,上游5′-CCTGGATGTGTAAAGAATG-3′,下游5′-TAGACTGCTAACGAATCTG-3′;β-actin 349 bp,上游5′-TGGAATCCTGTGGCATCCATGAAAC-3′,下游5′-TAAAACGCAGCTCAGTAACAGTCCG-3′)。肺组织总RNA 提取按照试剂说明书操作,逆转录后取cDNA。采用20 μL 体系,正反向引物各0.8 μL,cDNA 2 μL,双氧水6.4 μL进行扩增,反应条件为95 ℃预变性3 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸20 s,共设40个循环。结果计算:LC480检测得出的CT 值为cDNA 荧光强度达到所设定阈值的循环数,ΔCT=目的基因CT 值-内参基因CT 值。每个样品中mRNA相对表达量=2-ΔΔCT。
1.6 统计学处理
应用SPSS25.0 统计软件。符合正态分布的计量资料以(±s)表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠BALF总细胞数及分类细胞计数比较
见表1。与正常组相比,模型组大鼠BALF 中总细胞数、中性粒细胞及嗜酸性粒细胞计数均明显升高,差异具有统计学意义(P<0.05);而与模型组比较,槲皮素高、低剂量组、地塞米松组、槲皮素+miR155 抑制剂组大鼠BALF 总细胞数、中性粒细胞和嗜酸性粒细胞计数明显降低(P<0.05)。
表1 两组大鼠BALF总细胞数及分类细胞计数比较(×105/mL,±s)
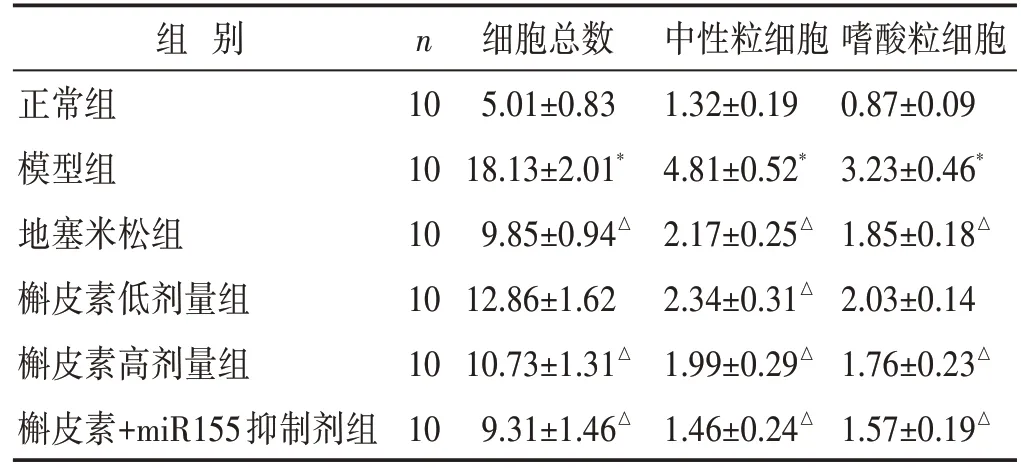
表1 两组大鼠BALF总细胞数及分类细胞计数比较(×105/mL,±s)
注:与正常组比较,*P <0.05;与模型组比较,△P <0.05。下同。
组 别正常组模型组地塞米松组槲皮素低剂量组槲皮素高剂量组槲皮素+miR155抑制剂组n 10 10 10 10 10 10细胞总数5.01±0.83 18.13±2.01*9.85±0.94△12.86±1.62 10.73±1.31△9.31±1.46△中性粒细胞1.32±0.19 4.81±0.52*2.17±0.25△2.34±0.31△1.99±0.29△1.46±0.24△嗜酸粒细胞0.87±0.09 3.23±0.46*1.85±0.18△2.03±0.14 1.76±0.23△1.57±0.19△
2.2 各组大鼠血清炎症介质水平比较
见表2。与正常组相比,模型组大鼠血清IL-4、IL-5、IL-17 及IgE 水平明显增加,IL-10 水平降低,差异具有统计学意义(P<0.05)。与模型组相比,槲皮素高、低剂量组及槲皮素组+miR155抑制剂组、地塞米松组IL-4、IL-5、IL-17 和IgE 水平减低,IL-10 水平上调,部分差异有统计学意义(P<0.05)。
表2 各组大鼠炎症介质水平比较(ng/mL,±s)
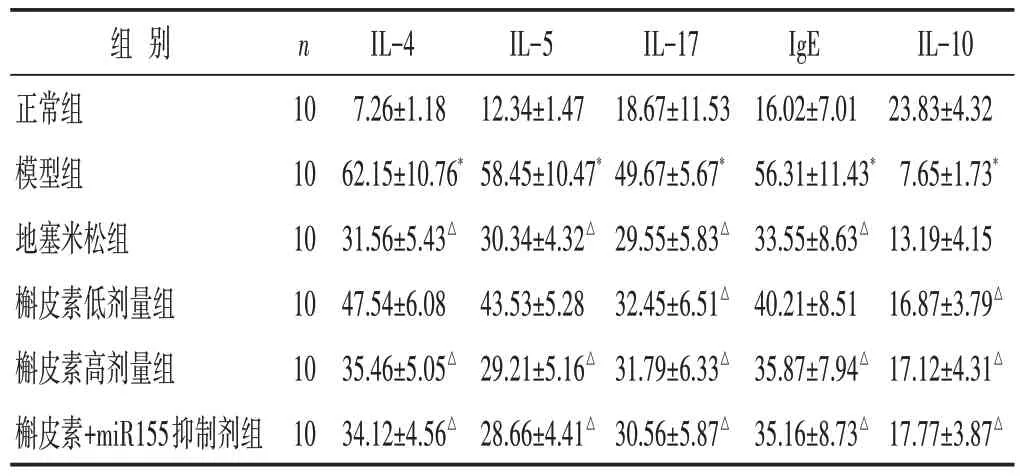
表2 各组大鼠炎症介质水平比较(ng/mL,±s)
组别正常组模型组地塞米松组槲皮素低剂量组槲皮素高剂量组槲皮素+miR155抑制剂组n 10 10 10 10 10 10 IL-4 7.26±1.18 62.15±10.76*31.56±5.43△47.54±6.08 35.46±5.05△34.12±4.56△IL-5 12.34±1.47 58.45±10.47*30.34±4.32△43.53±5.28 29.21±5.16△28.66±4.41△IL-17 18.67±11.53 49.67±5.67*29.55±5.83△32.45±6.51△31.79±6.33△30.56±5.87△IgE 16.02±7.01 56.31±11.43*33.55±8.63△40.21±8.51 35.87±7.94△35.16±8.73△IL-10 23.83±4.32 7.65±1.73*13.19±4.15 16.87±3.79△17.12±4.31△17.77±3.87△
2.3 各组大鼠支气管病理改变
正常组大鼠支气管管腔内管壁完整,未见上皮细胞脱落,无明显炎症细胞浸润,支气管黏膜平整,平滑肌呈正常厚度。与正常组相比,模型组大鼠支气管管腔狭窄,管腔内分泌物增多,管壁全层炎细胞浸润,支气管黏膜上皮脱落、变性,平滑肌层增厚明显。与模型组相比,槲皮素高、中剂量组和地塞米松组及槲皮素+miR155 抑制剂组大鼠支气管管腔内黏液减少,支气管黏膜上皮变性程度减轻,平滑肌增厚不明显。见图1。

图1 各组大鼠支气管病理改变(HE染色,100倍)
2.4 各组大鼠RORγt、Foxp3蛋白的免疫组化结果
见图2、表3。Th17/Treg 平衡的关键蛋白RORγt和Foxp3 在各组大鼠肺组织中均有表达,主要定位支气管黏膜上皮及肺泡上皮。结果显示:与正常组比较,模型组大鼠肺组织内RORγt表达水平显著升高,Foxp3表达降低,差异有统计学意义(P<0.05)。与模型组比较,槲皮素高、低剂量组大鼠肺组织内RORγt 表达受到抑制,Foxp3 表达水平上升;地塞米松组与槲皮素高、低剂量组实验结果趋同;相比其他干预组,槲皮素+miR155抑制剂组RORγt蛋白表达量下降,Foxp3蛋白表达量上升更显著。以上结果差异均具有统计学意义(P<0.05)。

图2 各组大鼠肺组织RORγt、Foxp3蛋白表达(IHC,200倍)
表3 两组大鼠肺组织RORγt、Foxp3免疫组化IOD值比较(±s)
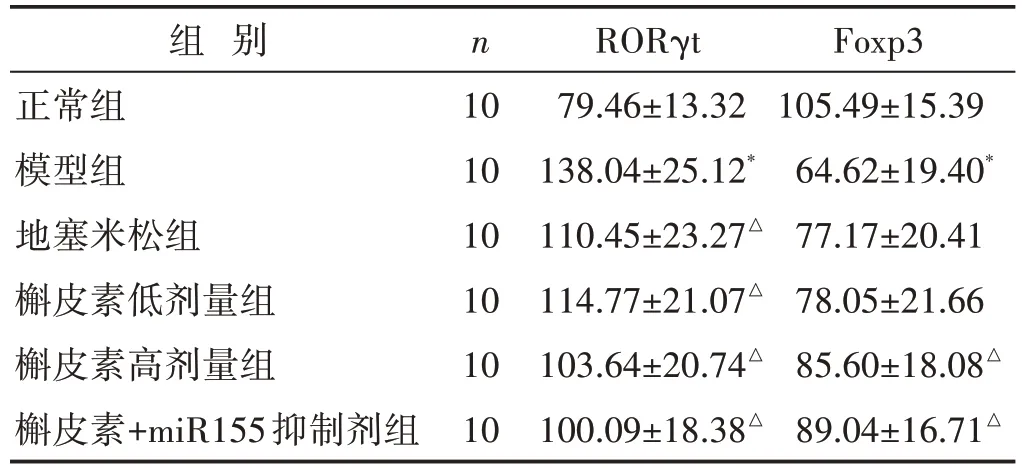
表3 两组大鼠肺组织RORγt、Foxp3免疫组化IOD值比较(±s)
组 别正常组模型组地塞米松组槲皮素低剂量组槲皮素高剂量组槲皮素+miR155抑制剂组n 10 10 10 10 10 10 RORγt 79.46±13.32 138.04±25.12*110.45±23.27△114.77±21.07△103.64±20.74△100.09±18.38△Foxp3 105.49±15.39 64.62±19.40*77.17±20.41 78.05±21.66 85.60±18.08△89.04±16.71△
2.5 各组大鼠肺组织RT-PCR 法检测细胞中miR-155、Foxp3、RORγtmRNA表达结果
与正常组比较,模型组大鼠肺组织miR-155、RORγtmRNA 相对表达量显著增强,Foxp3mRNA 表达减低,差异有统计学意义(P<0.05)。与模型组相比,槲皮素高、低剂量组、地塞米松组及槲皮素+miR155抑制剂组大鼠肺组织内miR-155、RORγtmRNA表达明显降低,Foxp3mRNA 表达活性明显提升,部分差异有统计学意义(P<0.05)。见图3。
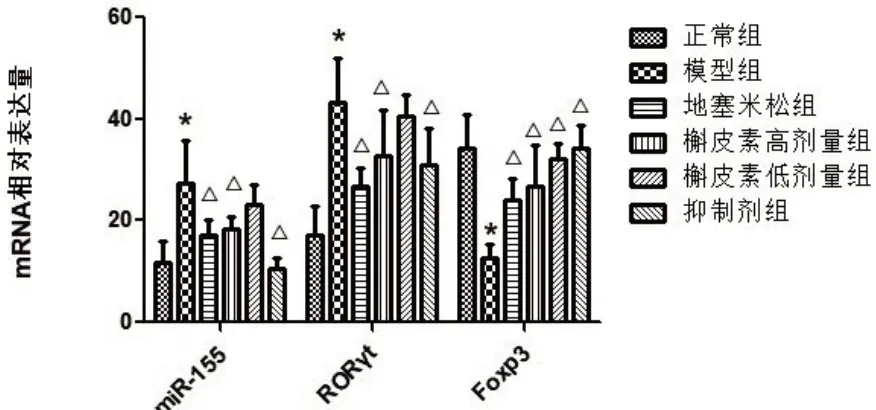
图3 各组大鼠肺组织miR-155、RORγt、Foxp3mRNA含量相对表达值比较
3 讨 论
哮喘是多种信号通路、炎性细胞、细胞因子共同参与的呼吸系统疾病,其实质是慢性炎症反应,以气道高敏性和重塑为主要病理特征。哮喘发病时[7],会引起嗜酸性粒细胞、淋巴细胞、中性粒细胞、肥大细胞等炎性细胞活化并向炎症部位聚集,释放IL-4、IL-5、IL-17等炎性介质,激活TGF-β/Smad3 等促炎通路,直接或间接损伤气道上皮细胞,引发气道炎症。同时嗜酸粒细胞等炎性细胞会在炎性介质的作用下过度活化,进一步产生病理损伤。因此,嗜酸粒细胞等炎性细胞总数也常用作临床诊断哮喘的关键指标。中医治疗哮喘的历史源远流长,早在近两千多年的《黄帝内经》中所记载的“喘鸣”就与本病发作特点相似,后经历代发展补充,最终将哮喘归纳为“哮病”的范畴。目前普遍认为其病机是肺失宣肃,主要表现为喘息、呼吸困难、咳嗽等肺系症状。槲皮素属黄酮类化合物含多种药理作用,具有抗炎、抗过敏、抗氧化、抗癌的作用[8]。先前研究发现[9],槲皮素能够有效缓解哮喘患者症状,提高患者生活质量。本次实验同样发现,模型组相较空白组大鼠BALF 中中性粒细胞等炎性细胞总数更多,促炎分子IL-4、IL-5、IL-17 含量显著上升,抑炎分子IL-10水平降低,支气管出现严重病理损伤。而相比模型组,槲皮素相关剂量组及地塞米松组大鼠BALF 中炎性细胞总数均较模型组降低,IL-4、IL-5、IL-17水平与槲皮素剂量呈反比关系,IL-10 水平升高。根据HE 染色结果显示,相比模型组,槲皮素相关剂量组及地塞米松组大鼠的哮喘病理损伤均得到不同程度改善,证明了槲皮素对哮喘的有效治疗作用。
近年来多项研究均证明[10-11],一方面Th17和调节性T 细胞及其效应因子本身就与哮喘关系密切,另一方面二者间的免疫失衡也在气道炎症和重塑这两个重要哮喘病理进程中发挥极大作用。Th17 细胞作用主要通过其分泌的IL-17 实现,IL-17 是一种强大的促炎细胞因子,可以引起严重气道炎症,此外其还可与气道平滑肌细胞(ASMC)上的受体结合,促进ASMC 增殖及迁移引发气道重塑和高反应性。Treg细胞是一类可抑制或调节免疫系统的T 细胞,其分化数目的减少可导致多种免疫相关疾病的发生。其在哮喘中通过释放IL-10,抑制嗜酸性粒细胞等炎症细胞在气道内的浸润,避免过敏反应和自身炎症反应过度激活。RORγt、Foxp3分别是Th17细胞和Treg细胞重要的相关转录因子[12-13]。RORγt 可诱导Th17 细胞产生及分化并促进IL-17 的分泌,Foxp3 是Treg 细胞核中特异性转录因子,可调控Treg 细胞分泌IL-10 等抑炎因子负性调节免疫反应。因此RORγt/Foxp3 的表达活性在维持Th17/Treg免疫动态平衡中的作用举足轻重,即RORγt/Foxp3可调控Th17/Treg的免疫偏移。本此实验结果显示,槲皮素相关各剂量组Foxp3 蛋白的表达增强、IL-10 水平升高,RORγt 蛋白的表达量明显下降、IL-17 水平降低,说明槲皮素可调节Th17/Treg的平衡。
miR-155是一种可调节机体免疫及炎症的重要的microRNAs(miRNAs),因其是T 细胞、B 细胞等多种免疫细胞发挥生物学作用所必需的miRNA,所以在包括哮喘、肺纤维化、肺结核、慢性肺阻塞、肺癌等多种呼吸系统疾病的发生发展中,miR-155 均参与其中并发挥重要的作用[14]。在哮喘中miR-155 除可通过调节免疫细胞以影响疾病进程外,还可导致气道上皮细胞和平滑肌细胞功能异常加重病理损伤。以往研究者们多聚焦于miR-155 通过削弱Th2 细胞过度激活恢复CD4+T 细胞的正常活化以治疗哮喘的作用,而忽视了miR-155 通过调控Th17/Treg 细胞比例在哮喘致病中的重要作用。研究表明[15],通过在CD4+T 细胞内转染miR-155 激动剂可以明显提高Th17 和Treg 的比例并抑制Foxp3的表达,而在转染miR-155抑制剂后,CD4+T 细胞中Th17 和Treg 的比例则显著降低,Foxp3 的表达明显增强,提示miR-155 可增加Th17 的数目,减少Treg 的数目,同时削弱其免疫抑制的功能,实现对Th17/Treg 平衡的调控。那么槲皮素可否通过抑制miR-155 表达重塑Th17/Treg 失衡以发挥抗支气管哮喘的作用呢?本实验发现槲皮素高剂量+miR155抑制剂组与槲皮素高剂量组(阴性对照组)相比,Foxp3 蛋白表达更强、IL-10 水平更高,RORγt 蛋白活性更弱、IL-17 的水平更低,表明槲皮素与miR-155 抑制剂合用能够显著抑制RORγt蛋白表达、减少IL-17分泌,增强Foxp3表达、促进IL-10 的分泌,以调节Th17/Treg 的免疫平衡。此外最新研究表明,Th17/Treg 动态平衡的地位在多种免疫紊乱的慢性炎症中均举足轻重,特别是在儿童患新冠肺炎后引起的儿童多系统炎症综合征(MIS-C)中,维持Th17/Treg 的免疫平衡可显著改善炎症病理进程[16]。而在肥胖与代谢性疾病中,Th17/Treg 似乎又是连接肠道微生物群与宿主代谢紊乱的桥梁[17]。再次说明了研究Th17/Treg免疫平衡的必要性。
综上,槲皮素对哮喘拥有良好的治疗作用。其通过抑制miR-155 表达,进而调节Th17/Treg 平衡可能是其发挥作用的关键。本次仅通过相关细胞因子层面初探槲皮素对于下调miR-155 表达以重塑Th17/Treg 平衡的机制,仍存在许多不足,后续将进一步深入,从信号通路角度进一步探求其具体机制。
