不同烹饪方式的羊肚菌在体外消化过程中营养成分溶出差异比较
2023-10-10薛淑静卢琪王轶姚芬史德芳杨德
薛淑静,卢琪,王轶,姚芬,史德芳,杨德
(湖北省农业科学院农产品加工与核农技术研究所,国家食用菌加工技术研发分中心,湖北省农业科技创新中心农产品加工分中心,湖北武汉 430064)
羊肚菌(Morchella esculenta),别名蜂窝蘑、狼肚菜[1],属子囊菌亚门盘菌纲盘菌目羊肚菌科[2],是一种享誉世界的珍稀食用菌。羊肚菌味道鲜美、营养丰富,富含蛋白质、氨基酸、多糖、矿物质等成分[3],具有抗肿瘤、抗氧化、抗病毒和提高免疫活性等多种作用[4]。随着羊肚菌人工栽培技术的成熟以及人们对羊肚菌营养和保健功能的认知,羊肚菌的食用量正在逐步增长。
大部分食品原材料需经烹饪后方能食用。烹饪方式通常包括煮、蒸、炒、煎、烘焙、微波等[5],不同的烹饪方式对食材的影响不一样。一般认为水煮可降低可溶性营养物质,如酚类[6]、水溶性维生素以及糖类[7]等。周浩宇等[8]研究表明水煮、油炸和微波处理显著降低了香菇中多糖、膳食纤维、蛋白质、多酚含量以及DPPH自由基清除率,而汽蒸和高温高压处理则能较好的保留其营养成分。Tan等[9]研究发现,高压可以提高3种侧耳属蘑菇的抗氧化能力,微波提高了杏鲍菇的还原力,且总酚和抗氧化能力之间不存在相关性。
不仅仅烹饪,人体的消化系统同样会影响食物的营养及功能成分的消化、吸收。胃被认为是一个生物反应器,在那发生着许多化学和生物反应[10]。食材烹饪后,脂肪、蛋白质等营养成分以及烹饪后的氧化产物等会受到胃、肠的pH值、溶氧量以及食物释放的活性因子如金属离子等的影响[11]。氧化不仅仅发生在烹饪过程中,还可能会沿着胃肠道持续进行[12]。进入血液的营养物质的质量和对健康的影响直接取决于食材消化的生理过程[13]。不同烹饪方式的羊肚菌被人体消化后,其主要营养成分和抗氧化活性有什么不同,还未见报道。体外模拟消化相对于体内研究来说,更加快速、方便和易于控制,是研究食物消化特性的重要研究方法[14]。因此,本文利用体外消化方法比较了煮制、蒸制以及烤制处理的不同粒度羊肚菌粉主要营养成分溶出量及模拟消化液抗氧化活性的变化,以期为羊肚菌的科学食用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜羊肚菌,购于湖北武汉超市;盐酸、碳酸氢钠、氯化钾、磷酸二氢钾、氯化钠、氯化镁、碳酸氨、氯化钙,国药集团化学试剂有限公司;胃蛋白酶(30 000 U/g)、胰蛋白酶(4 000 U/g)、猪胆粉、抗坏血酸、2,2-二苯基-1-苦基腈基(DPPH)、1,3,5-三(2-吡啶基)-2,4,6-三嗪(TPTZ),上海源叶生物科技有限公司;ABTS+·试剂盒、还原糖测定试剂盒、蛋白质测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
LG-500A型植物粉碎机,瑞安百信药机械厂;SQW-100DF超微粉碎机,济南易辰超微粉碎技术有限公司;Multiskan GO酶标仪,美国Thermo Fisher公司;XSP-63XDV荧光显微镜,上海光学仪器厂;HZ150L恒温培养摇床,武汉瑞华仪器设备有限责任公司;KS42LY烤箱,广东格兰仕集团有限公司;Winner2000型全自动智能型激光粒度分析仪,济南微纳仪器有限公司;MJ33快速水分活动测定仪,瑞士METTLER-TOLEDO公司。
1.3 试验方法
1.3.1 样品处理
新鲜羊肚菌60 ℃热风干燥后,粉碎,过60目筛,取部分60目筛下物,超微粉碎10 min,即得到羊肚菌粗粉[CM,D90为(206.36±2.35)μm]和超微粉[SM,D90为(40.63±1.05)μm]。
CM和SM样品分别进行(1)煮制:按1:50倍质量加入去离子水,沸水煮制15 min,5 000 r/min离心15 min,取沉淀,获得样品CMB和SMB;(2)烤制:上下温度150 ℃,预热10 min,上样,厚度约1~2 mm,烤制时间约2 min,以烤制均匀,无明显异味为准,获得样品CMR和SMR;(3)蒸制:水沸腾后,置于蒸锅中,水沸腾后蒸汽蒸制15 min,获得样品CMS和SMS。烹饪后的样品冷却至室温后,分别通过快速水分活度仪测定含水量。试验重复三次。
1.3.2 体外模拟消化
采用体外消化方法[15],胃电解质溶液(GES)、肠电解质溶液(IES)配比如表1所示。消化方法分为体外胃消化和体外肠消化。体外胃消化:取2 g烹饪后的样品,加入50 mL GES,用6 mol/L HCl溶液调pH值至3.0,加入264 mg胃蛋白酶(使混合物中胃蛋白酶活性达到2 000 U/mL)。避光,在37 ℃、60~250 r/min震荡孵育2 h,将混合物用2 mol/L NaHCO3调pH值7,终止酶消化作用,将胃消化产物在4 ℃ 8 000 r/min离心15 min,上清液和沉淀各作为羊肚菌粉模拟胃消化液和模拟胃消化残渣,-20 ℃冷冻备用。体外肠消化:重复体外胃消化过程得到胃消化产物,加入45 mL IES,包含2.5 mL胰酶(用0.9 mol/L NaHCO3配置10 mg/mL),2.5 mL猪胆粉溶液(用0.9 mol/L NaHCO3配置65 mg/mL),用2 mol/L NaHCO3调pH值至7,在37 ℃水浴以60~250 r/min震荡培养2 h,之后70 ℃水浴5 min,灭酶活,4 ℃ 8 000 r/min离心15 min,上清液和沉淀各作为模拟肠消化液和模拟肠消化残渣,-20 ℃冷冻备用。
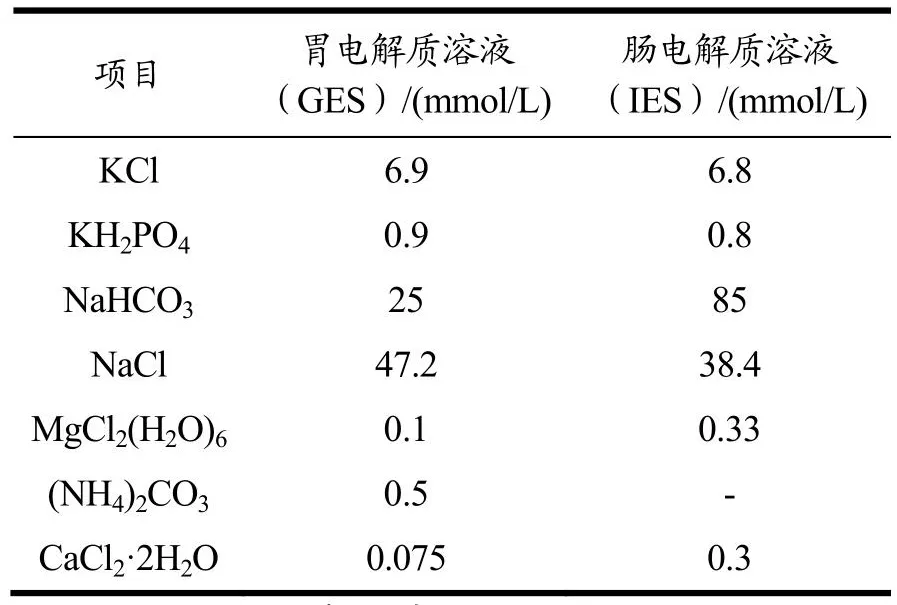
表1 体外消化液电解制配方Table 1 Preparation of stock solutions of in vitro digestion fluids
1.3.3 显微形态学观察
取模拟胃、肠消化后的残渣于载玻片上,用蒸馏水稀释后盖上盖玻片,显微观察并拍照,并和相对应的消化前的样品对照。
1.3.4 羊肚菌粉在模拟消化液中营养物质溶出量测定
1.3.4.1 还原糖测定
采用DNS法进行测定。参考南京建成还原糖试剂盒说明方法。结果以每克干重羊肚菌还原糖含量表示。
1.3.4.2 可溶性蛋白测定
采用考马斯亮蓝法测定。参考南京建成蛋白质试剂盒说明方法。结果以每克干重羊肚菌蛋白质含量表示。
1.3.4.3 游离氨基酸测定
采用茚三酮显色法[16],吸取1.2 mL羊肚菌模拟消化液加入2 mL磷酸盐缓冲液(pH值8),摇匀后加入2 mL茚三酮溶液,混合后在沸水中加热15 min,冷却至室温,于620 nm波长下测定。以甘氨酸(0~0.8 mg/mL)作为对照。结果以每克干重羊肚菌甘氨酸当量表示(mg/g)。
1.3.4.4 总酚测定
采用Folin-Ciocalteu法测定[17],25 μL羊肚菌模拟消化液加入125 μL(0.2 mol/L)福林酚溶液,静置10 min后,再分别加入125 μL 10% Na2CO3,混匀,室温下避光反应2 h,酶标仪765 nm波长下测定吸光度。200 mg/L没食子酸标准溶液[梯度范围40~200 mg/L(μg/mL)]作为对照。结果以每克干重羊肚菌没食子酸当量表示(mg/g)。
1.3.5 羊肚菌不同阶段模拟消化液抗氧化活性测定
1.3.5.1 DPPH自由基清除能力
20 μL羊肚菌模拟消化液加入280 μL DPPH·乙醇溶液(65 μmol/L),室温暗处反应30 min,用酶标仪在517 nm波长处测量吸光度[16]。抗坏血酸(100~500 μmol/L)作为对照。结果通过计算以每毫升羊肚菌模拟消化液中毫摩尔抗坏血酸当量表示(mmol VcE/mL)。
1.3.5.2 铁离子还原能力FRAP
将乙酸盐缓冲液(300 mmol/L,pH值3.6)、TPTZ溶液(10 mmol/L溶解在40 mmol/L HCl中)和FeCl3·6H2O溶液(20 mmol/L)按10:1:1(V/V/V)的比例混合制备Ferric-TPTZ溶液。20 μL羊肚菌模拟消化液与280 μL Ferric-TPTZ试剂混合,室温下避光反应30 min,使用酶标仪在593 nm处测量样品吸光度。以抗坏血酸(100~600 μmol/L)为对照。FRAP值以每毫升羊肚菌模拟消化液中微摩尔抗坏血酸当量表示(μmol VcE/ mL)。
1.3.5.3 阳离子自由基清除能力ABTS
2.4 mmol/L过硫酸钾溶液和7 mmol/L ABTS溶液等体积混合,室温避光反应12 h,然后用0.1 mol/L磷酸缓冲液按1:50的体积比稀释,使其在734 nm波长处的吸光度约0.70,得到ABTS工作溶液。将10 μL羊肚菌模拟消化液与200 μL ABTS溶液混合,室温静置反应6 min,用酶标仪在734 nm波长测量吸光度。Trolox(100~800 μmol/L)作为对照。结果以每毫升羊肚菌模拟消化液中微摩尔Trolox当量表示(μmol TE/mL)。
1.3.6 数据统计与分析
采用SPSS 20.0统计分析试验数据,数据重复三次,计算平均值和标准偏差,结果以平均值±标准偏差表示,并进行单因素方差分析,采用Duncan进行事后差异性分析。Origin 2021进行作图分析。
2 结果与分析
2.1 显微形态学观察
由图1可知,经过体外胃、肠消化后,羊肚菌颗粒数量明显减少。蒸制处理后,羊肚菌粉末有明显的抱团现象,特别是超微粉,表现更为明显。经过胃、肠模拟消化后,烤制处理比煮制以及汽蒸,颗粒数目明显更少且细,说明烤制处理后羊肚菌粉消化得更完全。

图1 不同烹饪方式羊肚菌对照粉、体外胃消化粉、体外肠消化粉的显微形态图Fig.1 Microscopic morphology of morchella control powder,gastric digestive powder, and intestinal digestive powder with different cooking methods
2.2 羊肚菌粉在模拟消化液中营养物质溶出量变化
2.2.1 还原糖
不同烹饪处理、不同粉碎程度的羊肚菌粉在模拟消化液中的还原糖溶出量见图2。经过模拟胃、肠消化后,还原糖溶出量比只经过模拟胃消化的量有了少许的提升,说明胃是羊肚菌还原糖溶出的主要部位。除了羊肚菌含有的还原糖外,一些碳水化合物在消化酶的催化下,也可生成含有醛基的还原糖。另外,大多数非淀粉多糖不可以被人体消化酶消化,但一部分可以被胃消化液的低pH值水解[18],多糖聚合物破裂或者糖苷键断裂,形成寡糖或单糖,暴露出更多的还原糖末端[19]。不同的烹饪方式,对消化液中还原糖的溶出有着显著的影响(P<0.05),经过胃、肠模拟消化后,溶出最低的是CMB和SMB,也就是煮制处理。烤制和蒸制比煮制有明显的提高,平均提高62.87%,但烤制和蒸制处理的羊肚菌粉,差异不显著。Xu等[20]认为煮制过程中,可溶性糖流失在水中,是红球甘蓝还原糖损失的主要原因。段秀辉等[21]发现杏鲍菇、香菇预煮液中含有大量溶出的可溶性糖。煮制过程和水直接接触,造成可溶性糖、多糖损伤,可能是煮制的羊肚菌消化后还原糖含量偏低的主要原因。在胃模拟消化阶段,超微粉碎能提高还原糖的溶出,特别是SMR和SMS,比相应的CMR和CMS有了显著的提高(P<0.05),但是肠模拟消化后,差异变得不显著。这和吴伟[22]报道的破壁促进胃肠道对蜂花中糖类物质的利用不一致。这可能与羊肚菌多糖的糖苷键以及构象有关。
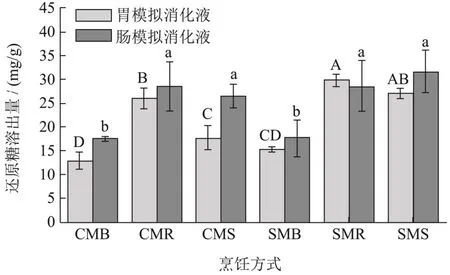
图2 不同烹饪处理、不同粉碎程度对羊肚菌粉在模拟消化液中还原糖溶出量的影响Fig.2 Effects of different cooking methods and crushing degrees on the reducing sugar dissolution rates of Morchella esculenta in in vitro digestivejuices
2.2.2 可溶性蛋白
从图3中也可以看出经过体外胃、肠消化后,羊肚菌粉可溶性蛋白溶出量要明显大于体外胃消化阶段。这和Jennifer等[23]报道的食物中蛋白质的消化大部分发生在肠阶段一致。不同的烹饪方式之间有着显著性差异(P<0.05),其中CMR和SMR样品可溶蛋白溶出量最大,其次是CMS和SMS,最少的是CMB和SMB;经过体外胃、肠消化后,CMR可溶性蛋白质溶出量分别比CMS和CMB提高29.14%、74.18%,SMR分别比SMS和SMB提高20.74%、42.98%。Samadi等[24]得出湿热处理改变了大豆的化学组成和营养组成,显著降低了可溶性蛋白含量。煮制是和水直接接触,以水为介质进行热量的传递;蒸制是以气态水为介质,将热量传递到羊肚菌粉的内部;烤制是以空气为介质,进行热量的传递。羊肚菌粉在这三种条件下,受到的热量和湿度各不相同,烤制处理促使可溶性蛋白在模拟消化液中的溶出量更高,可能与羊肚菌蛋白质的结构改变以及抗营养因子的失活有关。这还需要进一步研究。另外,煮制处理由于和水直接接触,造成可溶性蛋白损失,这也可能是煮制处理的羊肚菌可溶性蛋白溶出量较低的原因之一。超微粉碎可以促进羊肚菌粉在模拟消化液中蛋白质的溶出,这和吴伟研究的破壁明显促进蜂花粉蛋白的消化结论一致[22]。但是在不同的消化阶段,提高程度不一样,在体外胃消化阶段表现不显著,在体外肠消化阶段有显著性差异,经煮制后,超微粉比粗粉提高了41.83%,最低的是烘制后,超微粉比粗粉也提高了16.42%。
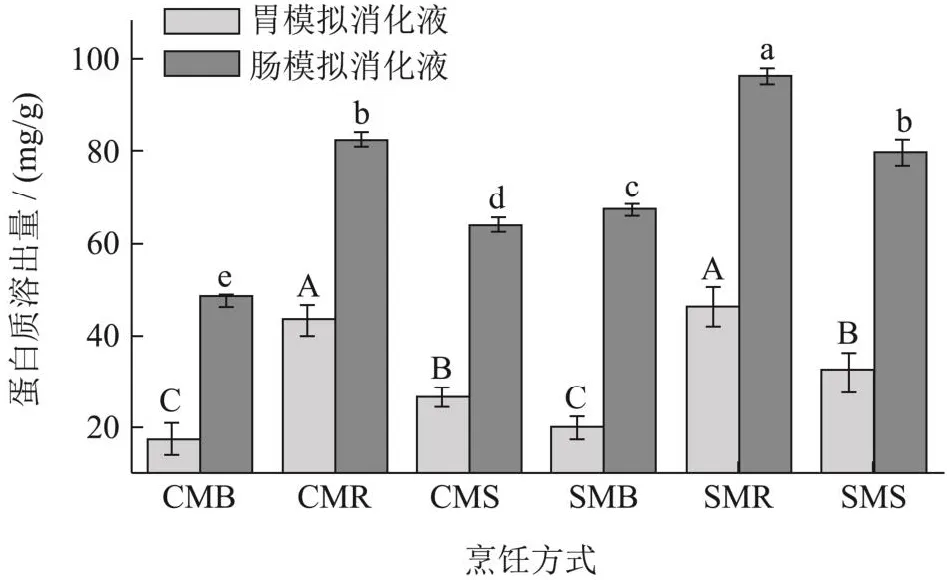
图3 不同烹饪处理、不同粉碎程度对羊肚菌粉在模拟消化液中可溶性蛋白溶出量的影响Fig.3 Effects of different cooking methods and crushing degrees on the protein dissolution rates of Morchella esculenta in in vitro digestivejuices
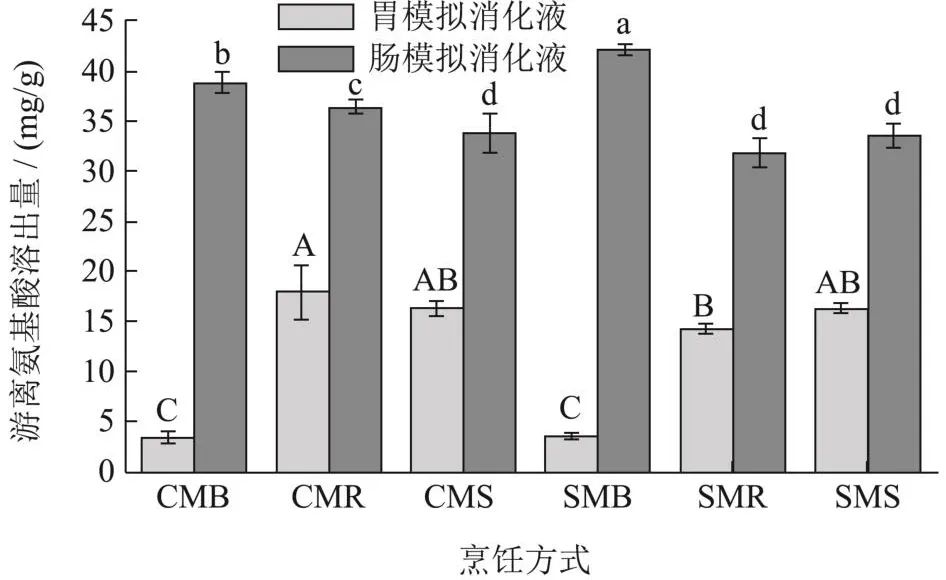
图4 不同烹饪处理、不同粉碎程度对羊肚菌粉在模拟消化液中游离氨基酸溶出量的影响Fig.4 Effects of different cooking methods and crushing degrees on the free amino acids dissolution rates of Morchella esculenta in in vitro digestivejuices
2.2.3 游离氨基酸
随着消化的进行,羊肚菌粉溶出的游离氨基酸量增加。这和陈再德等[25]研究的紫菜体外模拟消化的趋势相同。在每个消化阶段,不同烹饪方式的羊肚菌,溶出的游离氨基酸量不同。特别是CMB和SMB样品,在体外胃消化阶段,溶出的游离氨基酸量在所有处理中最低,但经过体外肠消化后,溶出的游离氨基酸量在所有处理中最高,粗粉、细粉平均为40.40 mg/g,分别比烤制、蒸制高出18.77%、19.81%。蛋白质经过胃消化产生肽和少量氨基酸,经过肠进一步消化,蛋白质和肽进一步分解成二肽、三肽和游离氨基酸[26]。大部分氨基酸通过小肠上皮细胞运输,被人体吸收利用[27]。煮制、蒸制、烤制三种烹饪方式,通过不同的加热方式,使蛋白质水解和变性。高于100 ℃的烹饪温度会导致蛋白质羰基化和聚集,蛋白酶的作用效果变差[28],从而降低了游离氨基酸的溶出,这可能是烤制处理的羊肚菌游离氨基酸溶出量较低的原因之一。煮制过程中羊肚菌蛋白质的水解和变性,可能更容易和肠道中的胰蛋白酶等酶作用,并且超微粉碎加强了这种作用,经过煮制后,超微粉在肠模拟消化液中的溶出量比粗粉提高了8.41%。
2.2.4 多酚
从图5可以发现,羊肚菌粉在肠模拟消化液中多酚溶出量要明显大于胃模拟消化液,这说明多酚的溶出大部分是在模拟肠消化过程中,这和周浩宇等[8]发现的多酚在香菇体外肠消化过程中释放量大的结果一致。经过体外模拟消化后,不同的烹饪方式对多酚的溶出有显著影响(P<0.05)。烤制处理明显高于煮制和蒸制,煮制最低,在肠模拟消化液中,烤制处理的羊肚菌多酚溶出量平均比蒸制处理提高了4.69倍。高温破坏了食用菌的细胞基质,促进结合型多酚的释放[29],并可降解为容易溶解的低分子量酚类化合物[30]。煮制处理多酚的溶出量低可能是亲水性多酚或降解的酚类化合物释放到沸水中,造成煮制后原料本身的多酚含量低。另外,从图5中还可以看出不论是体外胃阶段还是体外肠阶段,SMB比CMB都有显著的提升(P<0.05),也就是说超微粉碎可以促进煮制的羊肚菌粉多酚的溶出;但烤制、蒸制,超微粉碎处理后多酚溶出量反而降低。

图5 不同烹饪处理、不同粉碎程度对羊肚菌粉在模拟消化液中总多酚溶出量的影响Fig.5 Effects of different cooking methods and crushing degrees on the total phenolic contents dissolution rates of Morchella esculenta in in vitro digestivejuices
2.3 羊肚菌模拟消化液的抗氧化性
羊肚菌模拟消化液的DPPH自由基清除能力,铁离子还原能力FRAP,ABTS阳离子自由基清除能力被研究,结果如图6。DPPH是基于氢原子转移(HAT)与单电子转移(SET)机制结合作用,通过给出氢原子或电子与氧自由基结合,达到清除自由基的目的[31]。图6a显示,体外胃、肠消化比之经过体外胃消化,羊肚菌粉的DPPH值有了明显的提升,可能是因为羊肚菌粉消化液的DPPH更适用于高pH环境。但单看各个模拟消化阶段,不同处理均无显著性差异,这说明蒸、烤、煮三种处理方式处理后的羊肚菌,经体外消化后DPPH无显著性差异,超微粉碎对DPPH也无显著性影响(P<0.05)。
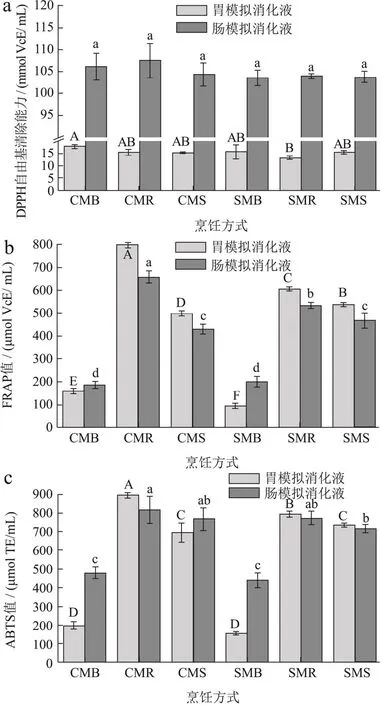
图6 不同烹饪处理、不同粉碎程度对羊肚菌模拟消化液的抗氧化能力的影响Fig.6 Effects of different cooking methods and crushing degrees on the antioxidant ability of in vitro digestive juices using Morchella esculenta
FRAP是基于单电子转移(SET)机制,反映了体系的还原能力[31]。不同于DPPH自由基清除能力,经过模拟胃、肠消化后和只经过模拟胃消化相比,FRAP值变化不明显。不同烹饪方式对FRAP值影响显著(P<0.05),烤制处理后的FRAP值最大,其次是蒸制处理,煮制处理最小,其中粗粉烤制处理经过体外胃、肠消化后,均值是蒸煮处理的3.51倍。超微粉碎不能有效提升消化后的FRAP值,烤制处理反而有所降低。羊肚菌的抗氧化作用可能来源于多酚[32]、多糖[33]等成分。卢琪等[34]在进行研究不同加工方式对羊肚菌水提液鲜味及抗氧化性能的影响时,发现随着菌粉粒径减小,抗氧化能力也呈下降趋势,这可能是因为超微粉碎破坏了酚类、多糖等活性成分。
ABTS是基于单电子转移(SET)机制,反映了体系的总抗氧化能力[31]。ABTS值的趋势和FRAP值类似。烤制最大,蒸制其次,煮制最小,超微粉碎不能有效提升消化后的ABTS值。
食用菌的抗氧化性能力通常与低分子量化合物有关,特别是酚类化合物[35]。因此,对羊肚菌模拟消化液的抗氧化能力与总酚含量进行相关性分析,其结果如图7所示。DPPH与总酚之间存在显著正相关性(P<0.05),而FRAP值和ABTS值和总酚含量之间的相关性不显著(P<0.05)。DPPH的优点是不受某些副反应的影响,如金属离子螯合和酶抑制[36]。但羊肚菌的抗氧化不仅仅与多酚有关,膳食纤维、多糖等也具有一定的抗氧化性[37],这可能是ABTS与多酚之间相关性不显著的原因。FRAP反映将Fe3+还原为Fe2+的能力,而包含-OH、-SH、-COOH、-PO3H2、-COO、-NR2、-S-和-O-两种或两种以上官能团的化合物具有金属螯合能力[35],这可能造成FRAP与多酚不显著相关。
3 结论
本研究结果表明烹饪方式对羊肚菌粉体外消化后营养成分的溶出有不同的影响,还原糖、蛋白质、多酚溶出量在烤制处理时最高,蒸制其次,煮制最低。其中烤制处理的还原糖、蛋白质、多酚溶出量比蒸制平均依次高62.87%、58.58%、4.69倍。游离氨基酸溶出量,煮制最高,其次是烤制,蒸制最低,蒸制处理的羊肚菌,粗粉、细粉平均为40.40 mg/g,分别比烤制、蒸制高出18.77%、19.81%。超微粉碎不能有效提高模拟消化液中还原糖、多酚的溶出,但可以显著提高蛋白质、游离氨基酸的溶出。模拟消化液的DPPH·清除能力没有显著差异,但FRAP和ABTS+·清除能力差异显著,烤制处理的最高,其次是蒸制,煮制最低。超微粉碎不能有效提升羊肚菌模拟消化液的抗氧化水平。本研究有望为羊肚菌的加工以及科学食用提供理论支撑。另外,本试验只是基于体外进行消化研究,还需要进一步对动物、体内试验进行研究。食材,特别是高碳水化合物低蛋白食材,在加热过程,易发生美拉德反应,产生丙烯酰胺等有害化合物。虽然羊肚菌属于高蛋白、高膳食纤维食材,但是基于热加工的烹饪方式对其的影响,特别是有害物质的产生,依旧要引起重视,相关还需要进一步研究。
