黑果枸杞花青素提取物的初步毒性评价
2023-10-10闫淑萍王硕陈涛申诚张永兰赵景阳冯斌罗芳李玉林
闫淑萍,王硕,陈涛,申诚,张永兰,赵景阳,,冯斌,罗芳,李玉林*
(1.中国科学院西北高原生物研究所,青海西宁 810001)(2.中国科学院大学,北京 100049)(3.青海柴达木职业技术学院生物工程系,青海德令哈 817099)(4.青海金麦杞生物科技有限公司,青海西宁 810003)
黑果枸杞(Lycium ruthenicumMurr.)是茄科枸杞属多棘刺落叶灌木,根系发达,耐旱耐盐碱,可以防风固沙,广泛种植于我国青海、宁夏、新疆、内蒙古等地[1]。《四部医典》、《晶珠本草》等藏药经典中记载,黑果枸杞成熟果实可用于治疗心脏病、心热病、月经不调、停经等,民间认为黑果枸杞有滋补强壮、明目、降压等功效。黑果枸杞在我国西北地区有着悠久的使用历史,是一种珍贵的药食两用资源。黑果枸杞果实富含花青素、原花青素、生物碱、多糖等活性成分[2],其中总花青素鲜果含量高达6.38 mg/g,是天然花青素的丰富来源[3,4]。现代药理研究表明,花青素具有抗炎[5,6]、抗氧化[7]、抗疲劳[8]、调节血脂[9]、肥胖抑制[10]、抗衰老[11]、抗肿瘤[12,13]、改善神经退行性疾病[14]等多种生物活性。基于花青素的生理活性和保健作用,黑果枸杞俨然已经成为西北地区的特色经济植物。但目前对黑果枸杞花青素研究主要集中在提取纯化工艺以及药理活性方面,黑果枸杞花青素作为食品、保健品开发,缺乏明确的毒理安全评价资料[15]。
急性毒性试验通过单次大剂量或24 h内多次给予受试物后,在一定时间内观察动物所产生的毒性反应和死亡过程,进而测定引起动物急性中毒的剂量,揭示动物在中毒过程中出现的毒性反应和可能作用的靶器官,一般采用半数致死量(LD50)、最小致死量(LD5)和最大给药量(MTD)等方法测定供试品的毒性剂量。天然产物的毒副作用一般较小,常常无法测出LD50,因此天然产物的急性毒性试验常采用最大剂量试验或固定剂量试验[16,17]。前期预实验中无法测出LD50,故本文采用固定剂量法进行小鼠经口急性毒性试验和大鼠30 d喂养毒性试验,初步了解黑果枸杞花青素提取物(Anthocyanins Extract ofLycium ruthenicum,AEL)的食用安全性,以期为黑果枸杞功能性食品的深度挖掘和开发利用提供安全性理论依据。
1 材料与方法
1.1 材料与试剂
黑果枸杞由青海金麦杞生物科技有限公司提供,经提取后得到质量分数为30.1%的深紫色黑果枸杞花青素提取物备用。乌拉坦,国药集团化学试剂有限公司;血液学检查试剂、SIMENS ADVIA三合一正常值质控全血,德国SIMENS公司;血清指标测定试剂盒,北京中生北控生物科技股份有限公司;电解质测定试剂,日本常光株式会社;凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)测定试剂盒和质控血浆,美国laboratory仪器公司;尿液检测试纸,桂林优利特医疗电子有限公司。
1.2 主要仪器
ADVIA2120型血液分析仪,西门子医疗诊断有限公司;ACL9000型凝血分析仪,Instrumentation Laboratory公司;7180型全自动生化分析仪,日本日立高新技术株式会社;EX-180型电解质分析仪,日本常光株式会社;URITEST-500B型尿液分析仪,桂林优利特电子集团有限公司;ML6001/02、PL203、ML104/02型电子天平,梅特勒-托利多仪器(上海)有限公司;E3000-0.5型天平,常熟市双杰测试仪器厂;CTXNW-110B型循环超声提取机,北京宏祥隆生物技术开发有限公司;GQ105B型管式离心机,上海浦东天本离心机械有限公司;GLZ-1B型冷冻干燥机,上海浦东冷冻干燥设备有限公司;SJN-150-00型双效浓缩器,浙江温兄机械阀业有限公司;BM-40型纯水机,北京中盛茂源科技发展有限公司。
1.3 实验动物
SPF级ICR小鼠20只,雌雄各半,实验动物质量合格证号为:11400700321072,用于急性毒性实验。SPF级SD大鼠36只,雌雄各半,7~8周龄,实验动物质量合格证号:11400700322000,用于30 d喂养实验。实验动物均由北京维通利华实验动物技术有限公司提供,生产许可证号:SCXK(京)2016-0006。实验动物饲养于屏障环境,12 h光照模拟昼夜循环,光照时间,6:00~18:00。自由进食饮水,饲料为60Co辐照灭菌饲料,饮水瓶和水每天更换,使用后饮水瓶经脉动真空灭菌器高压消毒后再次使用。动物适应性饲养一周后用于实验。
1.4 实验方法
1.4.1 黑果枸杞花青素提取物样品的制备
称取10 kg黑果枸杞干果去梗、破碎,过60目筛,置于超声提取机中,加150 L去离子水提取30 min,重复两次,合并水提液,2 000 r/min离心5 min,收集上清液。上清液以100 L/h流量泵入大孔树脂柱(树脂柱规格:100 L,树脂型号:AB-8,树脂量:35 kg),用100 L去离子水洗脱后,再用300 L体积分数为50%乙醇洗脱,收集乙醇洗脱组分,在45 ℃、-0.07 MPa条件下用双效浓缩器减压浓缩得到浓缩液10 L,冷冻干燥得到黑果枸杞花青素提取物595.2 g,经鉴定该组分花青素质量分数为30.1%[18]。
1.4.2 急性毒性试验
SPF级ICR小鼠20只,雄性体质量23.6~25.5 g,雌性体质量21.4~23.1 g,根据受试样品特点,采用固定剂量法进行急性毒性试验[19],设置对照组和实验组,每组10只,雌雄各半。一次灌胃给予AEL 8 000 mg/kg,灌胃体积40 mL/kg,溶媒为超纯水,对照组给予等量超纯水。小鼠灌胃前禁食4 h,自由饮水。灌胃后持续观察小鼠的一般状况,包括自主行为、精神状况、饮食饮水、呼吸、口鼻分泌物、排泄物等。灌胃当天持续观察2 h,以后每天观察一次,记录动物一般状况、死亡情况、体质量,连续观察14 d。第14天处死小鼠作大体观察。
1.4.3 30 d喂养试验
1.4.3.1 实验动物分组与处理
SPF级SD大鼠36只,雄性172~190 g,雌性186~212 g,按体质量随机分为对照组和AEL低剂量组(500 mg/kg)、AEL高剂量组(2 000 mg/kg),每组12只,雌雄各半。连续灌胃30 d,灌胃体积均为10 mL/kg,对照组给予等量去离子水。
1.4.3.2 实验观察
实验期间,每天观察动物死亡数和一般症状,包括大鼠在灌胃后的外观体征、行为活动、腺体分泌、呼吸、眼睛等。在灌胃1、8、15、22、25、29 d称量大鼠体质量及饲料消耗量,并在剖杀前称取待剖杀动物的空腹体质量。计算大鼠平均进食量,见式(1)。
式中:
Fm——为平均食料量,g;
F0——为加料量,g;
F1——为预料量,g;
n——为每笼动物只数,只。
1.4.3.3 样本收集及指标检测
实验第30天,动物禁食12 h。采集新鲜尿液,用自动尿液分析仪检测大鼠尿液指标。各组动物用20%乌拉坦4 mL/kg腹腔注射麻醉,腹主动脉采血。取新鲜的EDTA-K2抗凝血,4 h内采用多物种血液分析仪测定血液学常规指标。将新鲜血液置入带分离胶和促凝剂的真空采血管,两小时内分离血清,进行血清生化分析及电解质分析。采血结束后进行剖检,取心、肝、脾、肾、脑、肾上腺、胸腺、睾丸和附睾/子宫和卵巢等脏器组织称质量,计算脏体系数(mg/g)和脏脑系数(g/g),并进行组织病理学观察。
1.5 数据分析
采用SPSS 20.0分析软件,以平均值和标准差(¯x±s)表示各计量结果,单因素方差分析(ANOVA)、Dunnett检验、K样本非参数检验进行结果的比较与分析。因性别差异对各项指标影响较大,雌性大鼠和雄性大鼠分开计算。
2 结果与讨论
2.1 急性毒性试验
急性毒性试验过程中,小鼠以AEL 8 000 mg/kg剂量灌胃后连续观察2 h,小鼠无闭目、蜷缩、抽搐、震颤、流涎等明显中毒反应。14 d观察期内,小鼠饮食饮水正常,被毛光滑,精神状态良好,活动、行为无明显异常,口、鼻、眼分泌物、排泄物(尿液、粪便)等情况正常,观察期内未出现小鼠死亡。小鼠体质量变化如图1所示,与对照组比较,14 d内小鼠体质量正常增长,生长状况良好。实验结束对小鼠进行大体解剖,观察小鼠的心、肝、脾、肺、肾、胃、肠、脑、子宫及卵巢(睾丸及附睾)等脏器,实验组所有动物脏器颜色、形态均未见明显异常改变。结果显示:本试验状态下,小鼠单次灌胃AEL的最大耐受剂量不小于8 000 mg/kg。
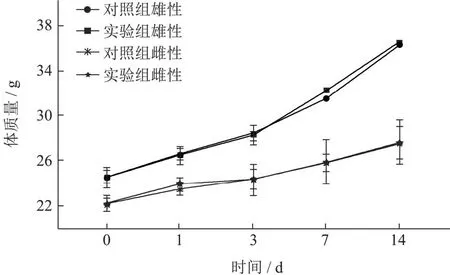
图1 黑果枸杞花青素提取物灌胃给药对小鼠体质量的影响Fig.1 Effects of AEL on body weight of mice
2.2 30 d喂养试验
实验期间动物健康状况良好,被毛顺滑有光泽、活动正常、精神状况良好、体质量持续增长,口、鼻眼、分泌物、排泄物(尿液、粪便)等情况正常,AEL高、低剂量组均无动物死亡或濒死。AEL高剂量组动物粪便呈黑紫色,与供试品颜色相近,可能与供试品颜色较深有关。
2.2.1 黑果枸杞花青素提取物对大鼠进食量、体质量的影响
AEL灌胃30 d,每周对大鼠进行一次进食量、体质量称量。如图2和图3所示,与对照组比较,各组动物每周进食、体质量均无显著差异(P>0.05),表明AEL对大鼠的一般生长状况无明显影响。

图2 黑果枸杞花青素提取物对大鼠进食量的影响Fig.2 Effects of AEL on food intake in rats

图3 黑果枸杞花青素提取物对大鼠体质量的影响Fig.3 Effects of AEL on body weight of rats
2.2.2 尿液生化检查
实验结束时采集大鼠新鲜尿液,观察尿液外观并检测各项尿液生化指标,结果见表1。检测结果显示除高剂量组动物尿液呈淡蓝色外,实验组其他各项指标与对照组比较无明显异常(P>0.05)。综合分析尿液呈淡蓝色可能与供试品颜色较深有关,但对大鼠其他尿液生化指标无影响。
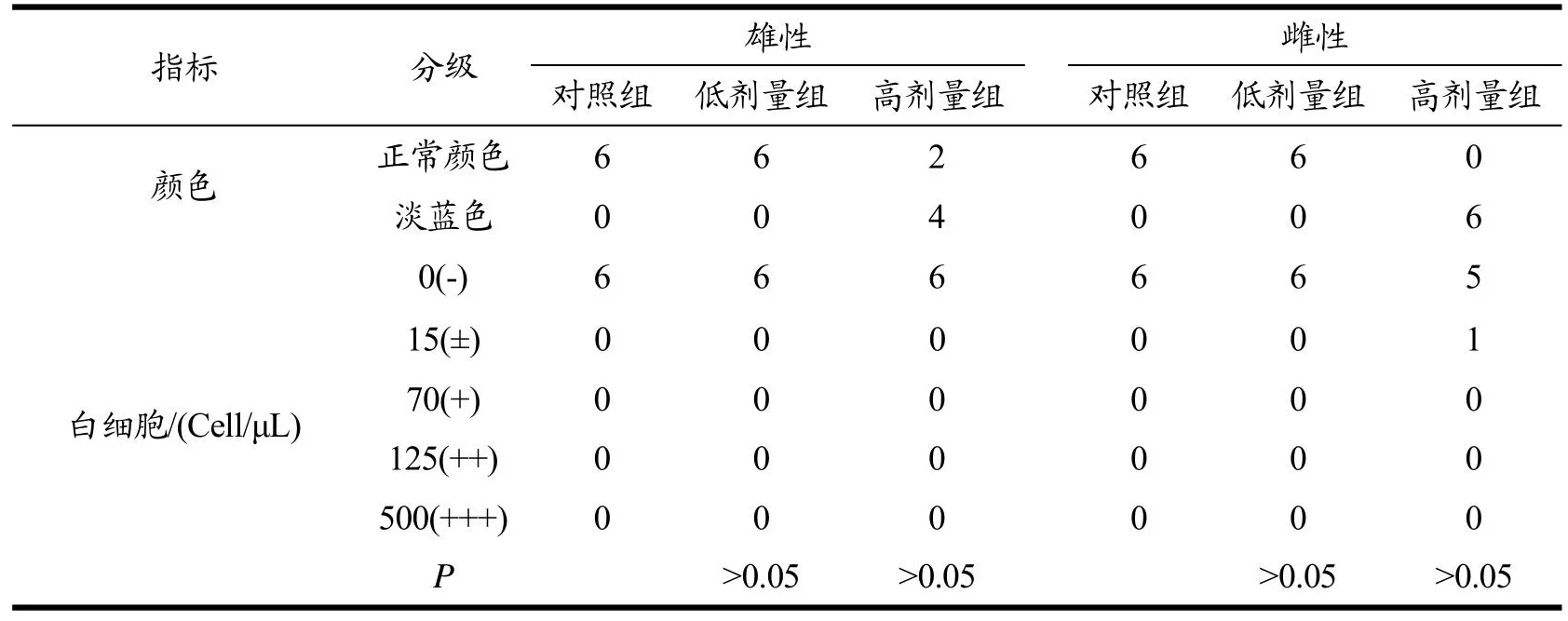
表1 黑果枸杞花青素提取物对大鼠尿液生化指标的影响Table 1 Effect of AEL on urine biochemical indexes of rats
2.2.3 血液学常规检查
血液系统是诊断个体生理和病理状态最敏感的指标,可用于判定受试物对动物血液系统、营养代谢及健康状况的影响[20]。大鼠血液学常规检查结果见表2。结果显示,高剂量组雌性动物单核细胞百分比(M%)较对照组显著升高(P<0.05),但与之相关的白细胞计数(WBC)、中性粒细胞(N%)、淋巴细胞(L%)、嗜酸性粒细胞(E%)与对照组比较无显著差异;高剂量组雄性动物M%较对照组升高,但未显示出统计学意义。与对照组比较,各实验组大鼠的凝血酶原时间(PT)、部分活化凝血酶原时间(APTT)无明显变化,表明黑果枸杞花青素对大鼠的凝血功能无影响。血液学常规检查结果显示AEL连续灌胃30 d,对大鼠血液常规指标无明显不良影响。
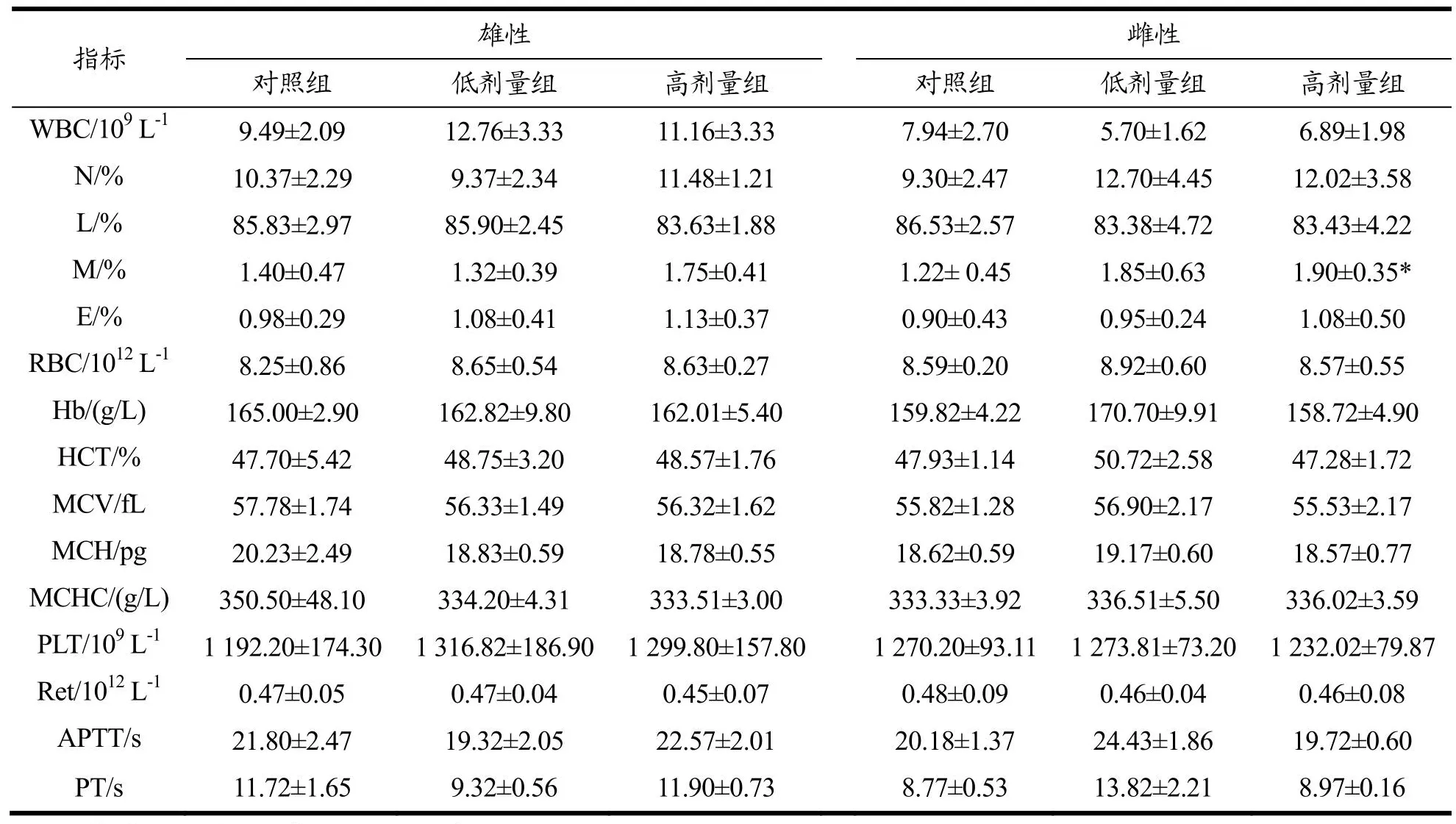
表2 黑果枸杞花青素提取物对大鼠血液指标的影响Table 2 Effects of AEL on hematological indexes in rats
2.2.4 血清生化指标检查
肝、肾是动物生物转化的重要场所,也是物质代谢的主要器官,肝脏功能可由其特异酶(ALT、AST、ALP、T-BIL)、总蛋白(TP)、白蛋白(ALB)、甘油三酯(TG)、总胆固醇(TCHO)等来检测[21,22];肾脏是体内最大的过滤器官,血清肌酐(Cr)、尿素氮(BUN)是检测肾功能常见的指标[23]。灌胃30 d后大鼠血清生化指标检查结果见表3。高剂量组雌性大鼠AST与ALT的比值低于对照组(P<0.05),但AST和ALT检查结果与对照组比较无显著差异。
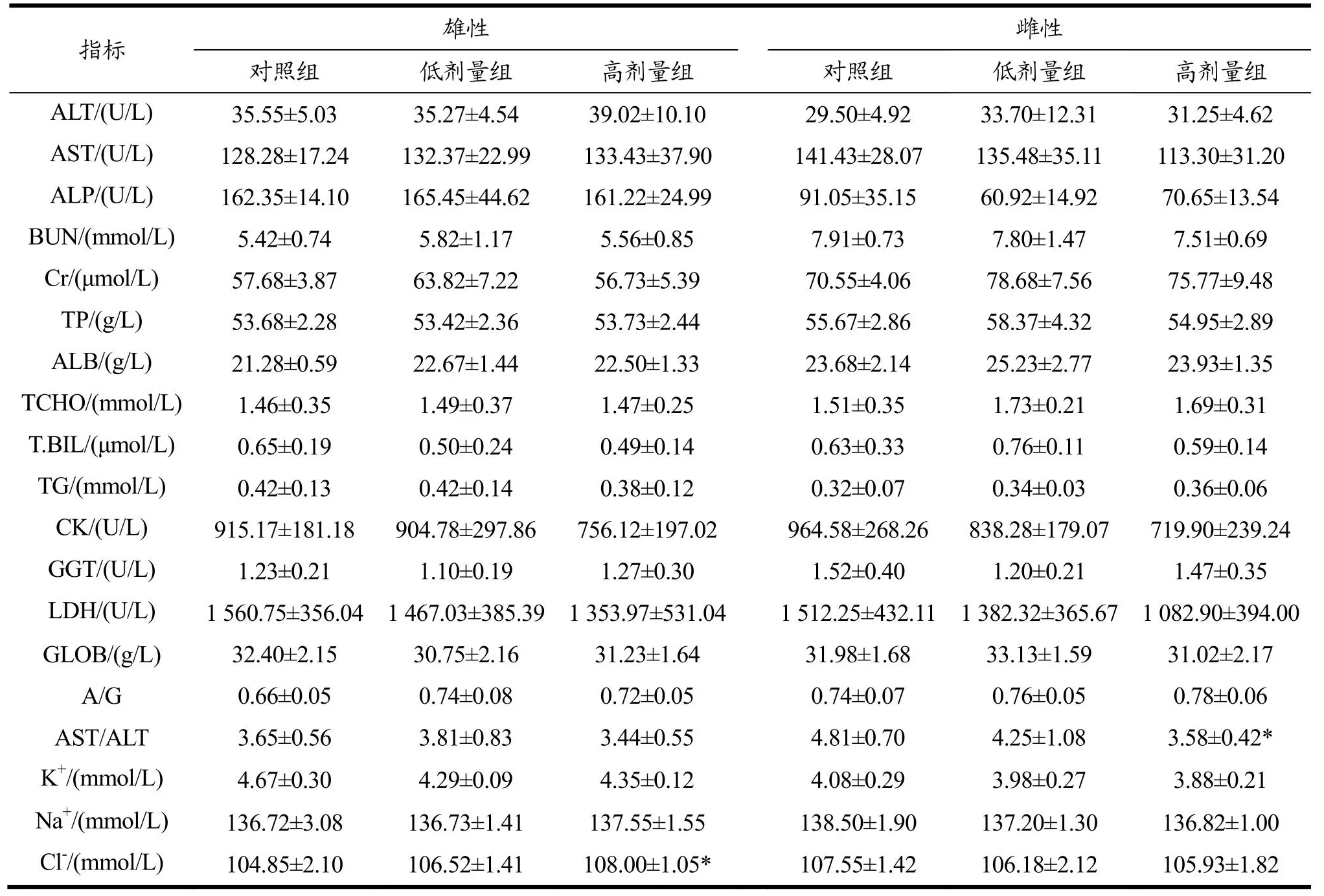
表3 黑果枸杞花青素提取物对大鼠血清生化指标的影响Table 3 Effects of AEL on serum biochemical indices of rats
电解质检查结果显示高剂量组雄性动物Cl-较对照组升高(P<0.05,改变率为2.9%),其他各项指标与对照组相比无显著差异。血清生化检查结果说明在此实验条件下,AEL对大鼠的血清生化指标无不良影响。
2.2.5 大体解剖及病理学检查
脏器质量和脏器系数可以帮助判断外源受试物对动物特定脏器的影响,有时候受试物会影响动物的摄食量、消化吸收能力从而影响受试动物的体质量,导致脏体系数偏差,但通常成年动物的脑质量是基本不变的,因此可以用脏脑系数综合判断受试物的毒性作用[24,25]。实验结束后,各组大鼠剖检可见胸、腹膜光滑,胸、腹腔内未见积液、粘连,心、肝、脾、肺、肾、胃、肠、脑、睾丸及附睾/子宫及卵巢等脏器形态、颜色、位置等未见可见病理改变。称取脏器质量,计算主要脏器系数及脏脑系数。由表4可见,与对照组比较,高剂量组雄性大鼠脾脏系数升高(P<0.05),其余脏器无明显改变。由表5可见各组大鼠脏脑系数与对照组比较无显著差异。脏体系数检查和脏脑系数检查结果显示连续灌胃30 d,AEL对大鼠的脏器发育无不良影响。
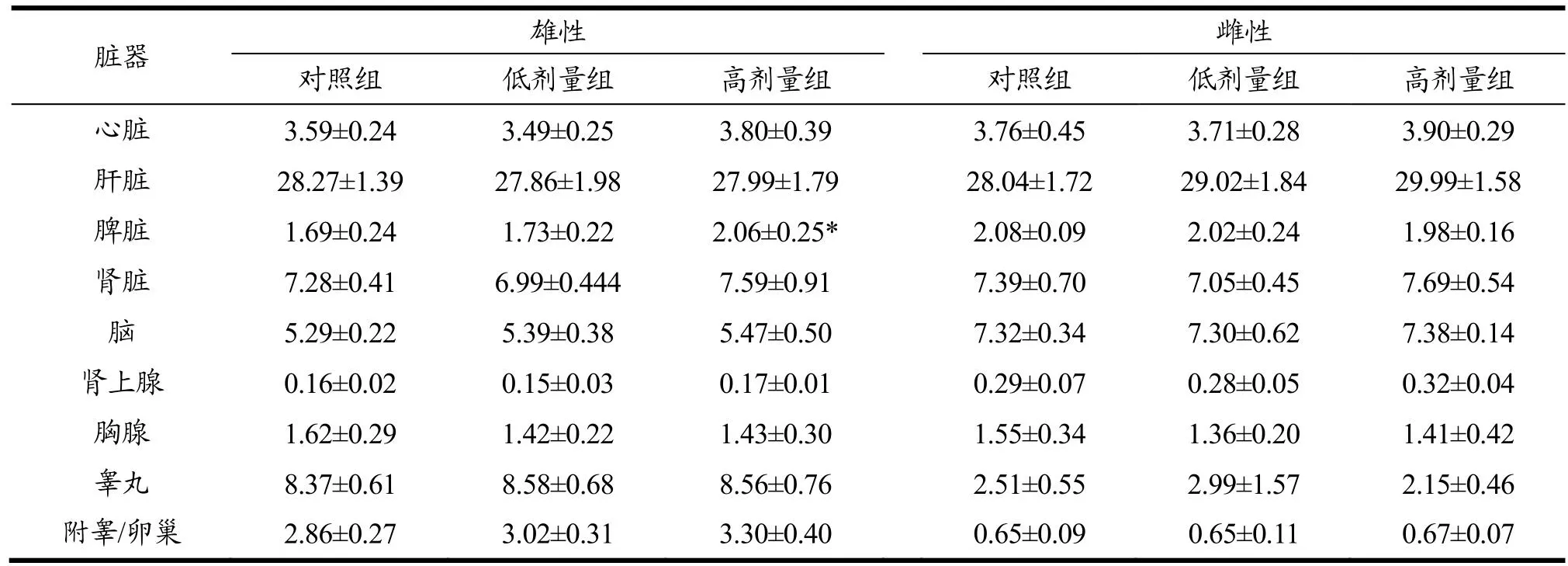
表4 黑果枸杞花青素提取物对大鼠脏体系数的影响Table 4 Effects of AEL on viscera coefficient in rats
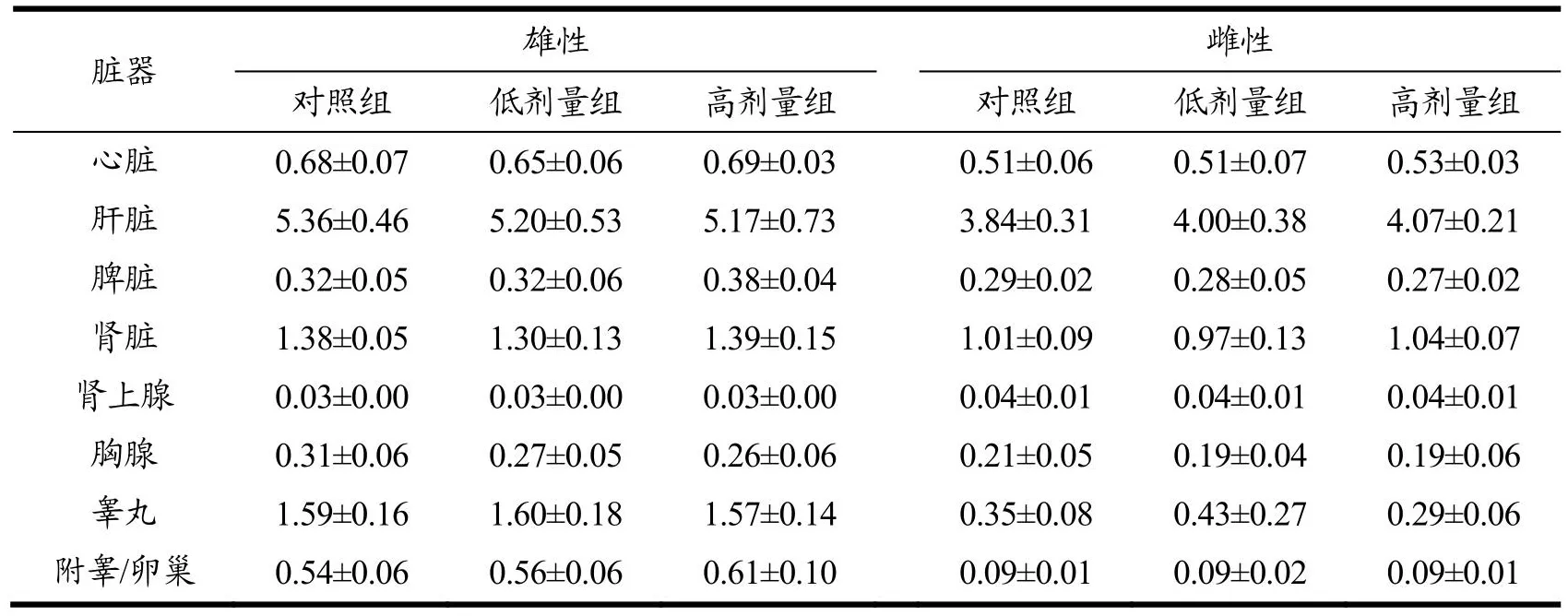
表5 黑果枸杞花青素提取物对大鼠脏脑系数的影响Table 5 Effects of AEL on viscera brain coefficient in rats
3 结论
急性毒性试验中,给予小鼠8 000 mg/kg AEL,实验组动物灌胃当天及随后的一般观察中,均未出现明显的毒性反应,体质量正常增长;14 d观察期结束后,实验组所有动物均未见明显异常,解剖脏器未见明显生理变化,说明小鼠对黑果枸杞花青素提取物的单次灌胃最大耐受剂量不低于8 000 mg/kg。
连续灌胃30 d,实验组大鼠未见明显异常反应,体质量、摄食量与对照组比较无显著差异。高剂量组动物出现的粪便和尿液颜色改变,可能与受试物较深的颜色有关,或与机体随之激发的吞噬功能增强相关,为机体的适应性反应。
综合分析,在本实验条件下,黑果枸杞花青素提取物对实验动物无急性、亚急性毒性,具有较高的安全性。本实验结果可以为黑果枸杞花青素功能性食品的开发利用提供一定的实验基础和理论依据。
