基于巢式PCR 技术对玉米种子携带禾谷镰刀菌的检测体系
2023-10-10朱倩丽赵官涛张洋洋王常清聂江山陈秀蓉
朱倩丽,赵官涛,王 露,何 翔,张洋洋,王常清,聂江山,陈秀蓉
(甘肃亚盛农业研究院有限公司, 甘肃 兰州 730030)
玉米茎基腐病在全国各玉米(Zea mays)产区均有危害,大田发病率一般在10%~15%,严重地块在80%以上,几近绝收[1],已成为继大、小斑病和丝黑穗病之后我国玉米生产上又一重要的玉米病害[2]。而引起玉米茎基腐病的病原菌比较复杂,已报道的病原菌有20 余种,我国玉米茎基腐病主要病原菌有镰孢菌(Fusariumsp.)和腐霉菌(Pythiumsp.)两大类[3],不同地区或不同生态区的主要病原菌种类有很大差异。其中禾谷镰刀菌(Fusarium graminearum)在我国玉米种植区普遍存在,早在20 世纪80 年代,陕西省、山东省就报道了禾谷镰刀菌是引起当地玉米茎基腐病的主要病原菌[4-5],后来类似的情况在东北地区及吉林、辽宁、江苏、新疆等省陆续出现[6-10],近年来在甘肃、河南、云南及安徽省也发现有禾谷镰刀菌引起玉米茎基腐病[11-15]。
玉米茎基腐病通常从灌浆至乳熟期开始发病,从始见病叶到全株发病一般仅7 d 左右,短的只有2~3 d,前期地上部分无明显症状,显症时根部早已被病原菌侵染,田间化学防治效果有限,影响玉米产量和品质[16]。由于玉米茎基腐病显症晚、病程快,而带菌种子又是翌年的主要侵染源之一[7],若想从源头减少该病害的传播,前期的种子带菌快速检测显得尤为重要,但目前针对玉米茎基腐病的分子生物学研究主要是对病原菌的分子鉴定[13,17]及发病组织中的病原菌类型检测[18-19],而种子带菌的检测技术几乎没有报道。已有报道中,植物病原菌检测中应用最广泛的是ITS-PCR (Internal Transcribed Spacer-Polymerase Chain Reaction)技术[20],该技术利用真菌的核糖体基因ITS 序列在种间的高度变异性和种内的稳定性[21-23],针对ITS 区设计特异引物进行特异性PCR 扩增,可直接通过分析ITS 序列对真菌进行分类鉴定[24-26];也可针对ITS 序列设计特异性引物进行特定病原菌检测[27-28],是国际上对病原真菌分类鉴定、监测及病害诊断使用最广泛的分子技术[20]。但有学者研究发现,ITS 序列并不是镰刀菌属鉴定的最优基因序列选择,存在鉴定结果不准确的情况[29];本研究也曾针对禾谷镰刀菌的ITS 序列设计引物进行了PCR 扩增,但因为镰刀菌属的核糖体DNA 高度保守,同属不同种ITS 序列中的碱基间差异不是很大,所以引物的特异性不高,不能从多种镰刀菌属菌株中准确区分出禾谷镰刀菌。
为解决上述问题,本研究将突破点转向了巢式PCR (Nested PCR)技术,该技术是一种常规PCR 技术的改良模式。常规PCR 只使用一对特异性引物进行扩增,但巢式PCR 由外引物和内引物两对特异性引物组成,降低了扩增多个靶位点的可能性,极大地提高了特异性和灵敏性,多用于检测症状不明显、寄主内病原物采用普通检测方法难检测的真菌病害[20],是建立快速、灵敏且高度特异种子检测的理想方法,故本研究基于巢式PCR 分子技术,针对禾谷镰刀菌设计特异性引物,构建了玉米种子携带禾谷镰刀菌的检测体系,为该病的早期诊断和及时防治提供技术支持和理论依据,以期减少该病造成的经济损失,也为其他作物同类致病菌的早期诊断提供参考。
1 材料与方法
1.1 供试材料
供试菌株:禾谷镰刀菌(TS-3)及其他参试菌株(表1)均来源于实验室分离。另于田间采集种子样品16 份备用。

表1 参试菌株及来源Table 1 Source of tested isolates
以上供试菌株均为实验室分离后得到的菌株,已结合形态学及分子生物学鉴定后确认了菌株类型。选择供试菌株的依据:由于本研究是针对禾谷镰刀菌的检测体系,故另外又选择了6 种镰刀菌属的菌株作为对照;同时还选用了玉米种子上较为常见的青霉菌(Penicilliumsp.)和链格孢菌(Alternariasp.)以及玉米内生真菌球毛壳菌(Chaetomium globosum);除上述9 种子囊菌外,另外选用了一种半知菌-菜豆壳球孢(Macrophomina phaseolina);以上参试菌株均作为特异性检测对照菌株。
1.2 主要试剂和设备
2 × Taq PCR Master Mix II (TIANGEN,版本号:180813)、T-Vector pMDTM19 (Simple)连 接 试 剂 盒(TAKARA Code:3271)购于甘肃仪泰克科技服务有限公司,胶回收试剂盒(BW-DC3511)购于杭州倍沃医学科技有限公司,TreliefTM5α Chemically Competent Cell (目录号:TSC-C01)购于北京擎科生物科技有限公司。
Buffer A:100 mmol·L-1NaOH,2% Tween 20,现配现用。
Buffer B:100 mmol·L-1Tris-HCl,2 mmol·L-1EDTA,pH = 2.0。
PCR 扩增仪(伯乐,T100)、电泳仪电源(北京六一仪器厂,DYY-6D)、水平电泳槽(北京六一仪器厂,DYCP-31DN)、凝胶成像系统(北京六一仪器厂,WD-9413B)。
1.3 供试菌的处理及DNA 提取
将菌株活化后,在PSA 平板上25 ℃暗培养5 d,小心收集菌丝体,使用真菌基因组DNA 提取试剂盒(OMEGA Fungal DNA Kit)提取菌丝DNA,方法按试剂盒说明书进行。
参试菌株也可用NaOH 裂解法[30]快速提取DNA:取适量菌丝至PCR 管中,加入50 μL Buffer A 溶液,PCR 仪内95 ℃温育10 min,向PCR 管内加入50 μL Buffer B 溶液,轻轻震荡混匀,得到含有gDNA 的溶液,不可长时间保存(不能超过14 d),应尽快使用。
1.4 禾谷镰刀菌PCR 产物测序
以刘金华等[19]报道的禾谷镰刀菌的特异性引物HG-F/R (如表2)对菌株TS-3 进行PCR 扩增,扩增体系(参照2 × Taq PCR Master Mix II 说明书)为25.0 μL:2 × Taq Master Mix 12.5 μL,上下游引物各1.0 μL,模板1.0 μL,补足灭菌水至25.0 μL。扩增条件:94 ℃预变性3 min;94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸23 s,共35 个循环;72 ℃总延伸5 min;4 ℃保存。

表2 引物序列Table 2 Primer sequences
参照胶回收试剂盒(BW-DC3511)试剂盒说明书先将PCR 扩增产物回收纯化,再按照pMD19-T vector 连接试剂盒说明书及感受态细胞(TreliefTM5α Chemically Competent Cell)说明书将回收纯化后的扩增产物连接到T 载体上转化至感受态细胞中,经培养筛选到PCR 扩增验证正确的阳性菌落后送至北京擎科生物科技有限公司测序。
1.5 特异性引物的设计与合成
以HG-F/R 为内引物,根据内引物在菌株TS-3的扩增测序结果,在GenBank 中进行序列比对,根据比对结果定位其在整个基因组中的位置,并根据该位置向两侧延伸至扩增产物为600~1 000 bp,设计特异性外引物。设计所用到的软件为SnapGene,引物序列如表3,引物位置如(图1)。设计的引物均由北京擎科生物科技有限公司合成并纯化。
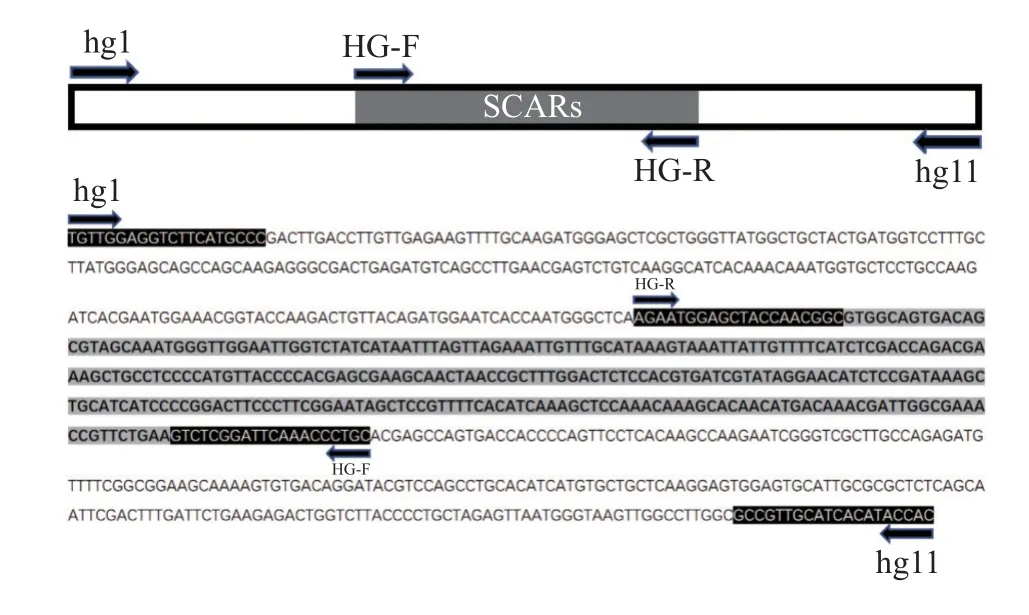
图1 巢式PCR 体系引物示意图Figure 1 Schematic Diagram of Primers used in Nested PCR System
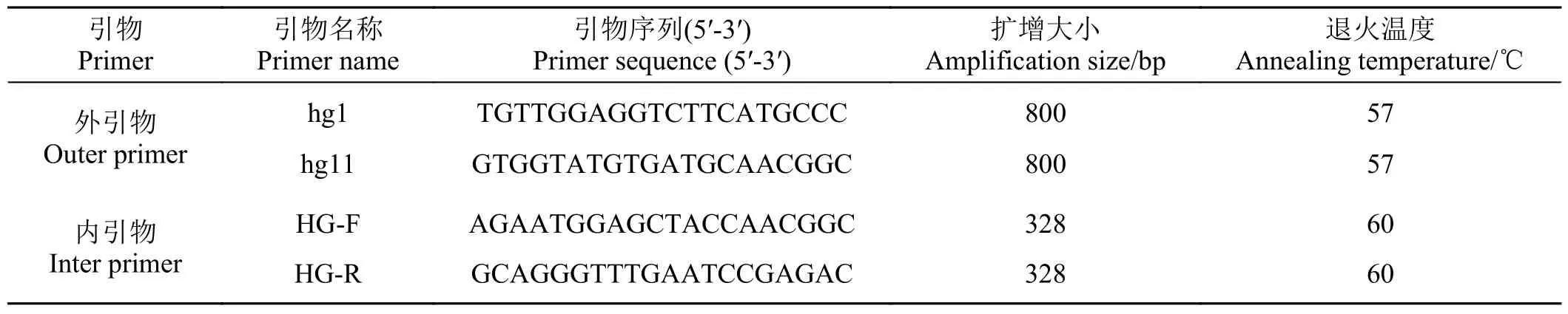
表3 巢式PCR 扩增引物Table 3 Amplification primers for nested PCR
1.6 巢式PCR 反应体系
扩增体系同1.4。首先用外引物hg1/hg11 扩增,反应程序如下:94 ℃预变性3 min;94 ℃变性30 s,57 ℃复性30 s,72 ℃延伸54 s,共35 个循环;72 ℃总延伸5 min;4 ℃保存。
将扩增后的产物稀释500 倍后取1 μL 为模板,以内引物HG-F/HG-R 进行第2 轮扩增,反应程序如下:94 ℃预变性3 min;94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸20 s,共32 个循环;72 ℃总延伸5 min;4 ℃保存。PCR 产物用1%琼脂糖电泳检测,结束后在凝胶成像系统上观察结果并拍照。
1.7 特异性检测
以巢式PCR 反应体系分别扩增各参试菌株,无菌水作阴性对照,同时以巢式PCR 反应体系中的第2 轮扩增反应作为常规PCR 对照,与巢式PCR 反应体系对比效果,PCR 产物用1%琼脂糖电泳检测,结束后在凝胶成像系统上观察结果并拍照。试验重复3 次。
1.8 灵敏度检测
将菌株TS-3 所提取的gDNA 浓度稀释至13.2 ng·μL-1作为模板1,再将其5 倍梯度稀释分别得到浓 度为2.64 ng·μL-1、0.528 ng·μL-1、0.105 6 ng·μL-1、21.12 pg·μL-1、4.224 pg·μL-1、0.844 8 pg·μL-1的模板gDNA,用巢式PCR 和常规PCR 反应体系分别进行扩增,以检验和分析其灵敏度。试验重复3 次。
1.9 模拟玉米带菌种子检测
样品制备:菌株TS-3 活化后培养15 d 后制备孢子悬浮液,浓度约为3 × 104个·mL-1孢子。取15 g健康玉米种子(约45 粒)放入50 mL 离心管中,分别加入200、100、80、60、40、20、10、5、1 μL 孢子悬浮液,震荡混匀,完成接菌。
样品总DNA 的提取:向装15 g 带菌玉米种子及装有15 g 健康玉米种子的50 mL 离心管中分别加入灭菌水至40 mL 刻度线,震荡均匀后浸泡4 h,然后将浸出液于3 000 r·min-1离心10 min,弃上清取离心后的沉淀,以NaOH 裂解法(参照1.3)快速提取DNA。
巢式PCR 体系检测:取沉淀提取的含gDNA 的溶液各1 μL,以菌株TS-3 提取的gDNA 为阳性对照,无菌水为阴性对照,用1.6 中所述巢式PCR 反应体系进行扩增。
PCR 扩增产物分析:PCR 产物用1%琼脂糖电泳检测,结束后在凝胶成像系统上观察结果并拍照。试验重复3 次。
1.10 田间玉米种子检测
在田间不同地块采集当年的玉米种子16 份,每份取适量种子进行巢式PCR 体系检测。样品总DNA 提取、巢式PCR 体系检测及PCR 扩增产物分析等步骤同1.9。
1.11 田间玉米种子样品PCR 产物序列分析
将田间玉米种子样品PCR 扩增产物送至北京擎科进行测序,并将测序结果在GenBank 中进行BLAST 分析以验证其特异性。
2 结果与分析
2.1 禾谷镰刀菌PCR 产物测序结果
以禾谷镰刀菌的特异性引物HG-F/R (表2)进行PCR 扩增,经连接转化单克隆后测序,得到分子量大小为328 bp 的序列,具体如下:
>GCAGGGTTTGAATCCGAGACTTCAGAACG GTTTCGCCAATCGTTTGTCATGTTGTGCTTTGTTT GGAGCTTTGATGTGAAAACGGAGCTATTCCGAA GGGAAGTCCGGGGATGATGCAGCTTTATCGGAG ATGTTCCTATACGATCACGTGGAGAGTCCAAAG CGGTTAGTTGCTTCGCTCGTGGGGTAACATGGG GAGGCAGCTTTCGTCTGGTCGAGATGAAAACAA TAATTTACTTTATGCAAACAATTTCTAACTAAAT TATGATAGACCAATTCCAACCCATTTGCTACGCT GTCACTGCCACGCCGTTGGTAGCTCCATTCT//
2.2 特异性检测结果
将菌株TS-3 与另外10 种参试菌株(表1)用巢式PCR 反应体系进行扩增,同时用该体系第2 轮PCR 扩增作为常规PCR 对照,从图2a 可以看出常规PCR 特异性差,除TS-3 有条带之外,还有Fusarium verticillioides、F.acuminatum、Macrophomina phaseolina都扩增出了约330 bp 大小的条带,而巢式PCR 反应体系特异性强(图2b),只有菌株TS-3 有328 bp 大小的明亮条带,其他参试菌株均无条带。
2.3 灵敏度检测结果
将菌株TS-3 所提取的gDNA 浓度稀释至13.2 ng·μL-1作为模板1,再将其5 倍梯度稀释后用巢式PCR 反应体系和常规PCR 反应体系分别进行扩增,以检验和分析其灵敏度。结果显示:常规PCR 反应体系在模板浓度为0.105 6 ng·μL-1时只能看到隐约条带(图3a),而巢式PCR 反应体系在模板浓度为4.224 pg·μL-1还能检测出明亮条带(图3b),其明亮程度同常规PCR 在浓度为13.2 ng·μL-1时相近;根据模板浓度计算可得,巢式PCR 反应体系较常规PCR 反应体系的灵敏度提高了25 倍,从条带亮度对比来看,巢式反应体系的灵敏度较常规PCR 反应体系大有提高。
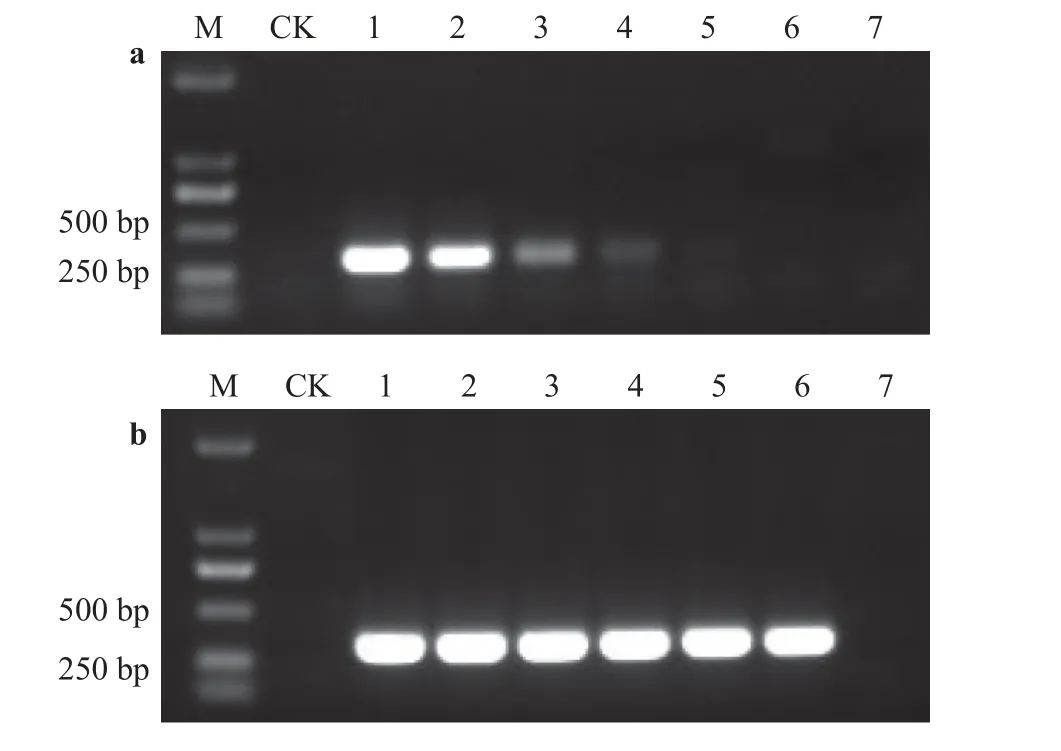
图3 常规PCR 反应体系(a)和巢式PCR 体系(b)灵敏度测试对比图Figure 3 Comparison of sensitivity of conventional PCR reaction system (a) and nested PCR system (b)
2.4 模拟玉米带菌种子检测结果
在15 g 健康玉米种子(约45 粒)中分别接种浓度约为3 × 104个·mL-1的孢子悬浮液200、100、80、60、40、20、10、5、1 μL,即分别携带约6 000、3 000、2 400、1 800、1 200、600、300、150、30 个孢子(表4),结果显示:以上接种量的玉米种子均可检测出明亮的目的条带,而未接菌的健康种子未检测出条带(图4),说明当15 g 玉米种子(约45 粒)携带约30 个孢子时即可被巢式PCR 反应体系成功检测。
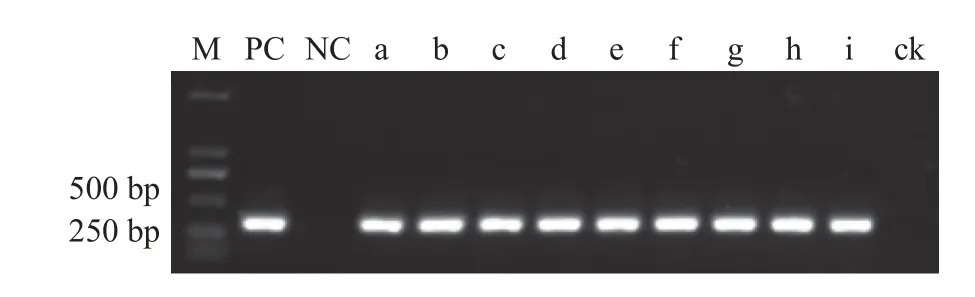
图4 巢式PCR 体系检测不同接菌量的种子电泳图Figure 4 Electrophoretic images of seeds with different amounts of inoculation as detected by nested PCR system
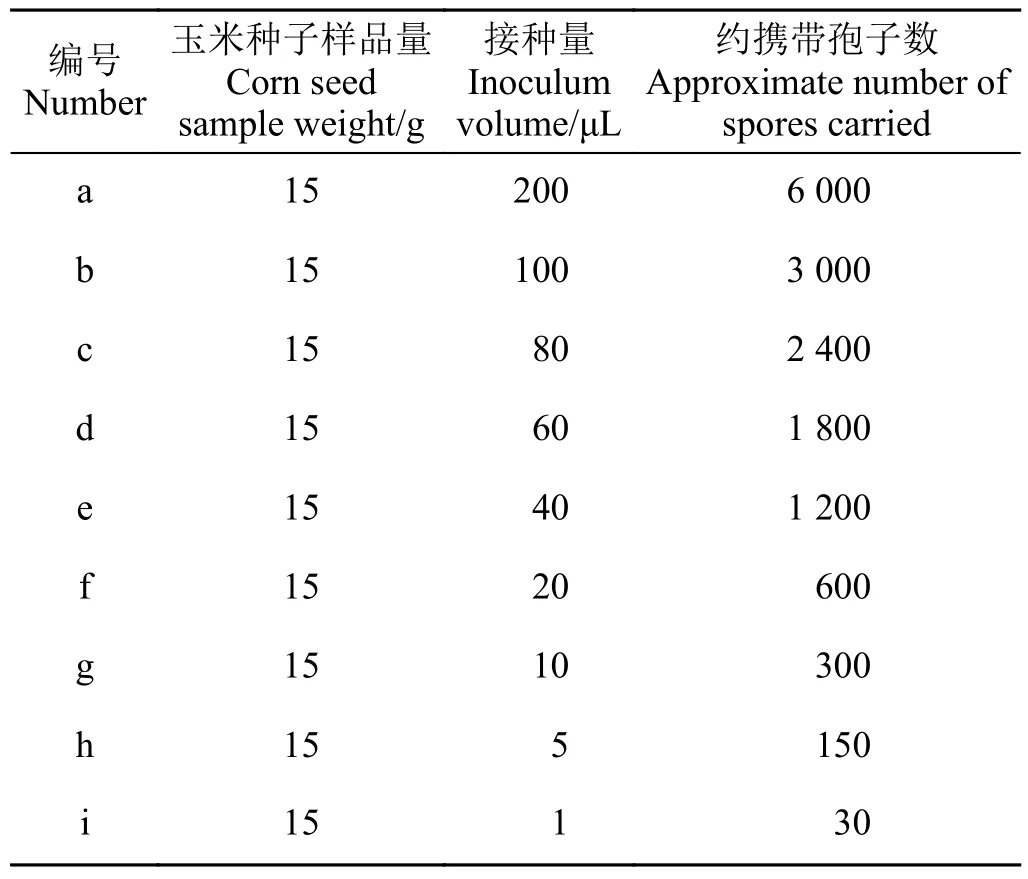
表4 健康玉米种子接菌量Table 4 Inoculation amounts in heathy maize seeds
2.5 玉米种子检测结果和序列分析
将田间采集的16 份玉米种子用巢式PCR 体系检测,结果显示有2 份呈阳性反应(编号X1及W2),阳性检出率为12.5%,将这2 种PCR 产物进行测序,测序结果在GenBank 中进行BLAST 分析,结果(图5)显示2 种PCR 产物测序结果一致,且该序列与Fusarium graminearum相似度均为100%。测序结果进一步验证了检测引物的特异性和检测结果的准确性,同时也表明本研究从田间样品中检出的确实属于禾谷镰刀菌的相关DNA 片段。

图5 巢式PCR 体系检测田间种子样品电泳图Figure 5 Electrophoretic diagram of field seed samples as detected by nested PCR system
3 讨论与结论
据报道,刘金华等[19]发现通过对禾谷镰刀菌基因组中的特异序列SCARs 片段[31]进行常规PCR 技术扩增,可检测霉变玉米、玉米穗腐病、茎腐病组织中的禾谷镰刀菌。本研究对该报道中涉及到的引物进行了特异性检测,但结果显示其不仅在禾谷镰刀菌中可扩增出阳性条带,在轮枝镰刀菌(Fusarium verticillioides)、锐顶镰刀菌(Fusarium acuminatum)和菜豆壳球孢(Macrophomina phaseolina)中也能扩增出片段大小相似的阳性条带,这还只是本研究中所涉及到的参试菌株,说明该报道中的引物特异性不是很强,且常规PCR 检测存在假阳性的结果,误检的可能性较大。想要建立快速、灵敏、高度特异的检测体系需要更为精准的技术,巢式PCR 技术就是理想的选择之一,其在病害检测方面的应用近年来有不少报道,如刘晓妹等[32]利用巢式PCR 技术建立了杧果露水斑病主要致病菌Cladosporium cladosporioides的快速准确检测方法,比常规PCR灵敏度提高了1 万倍,且能实现对潜伏期果实的特异性检测;陈杰和朱天辉[33]利用巢式PCR 技术建立了引起核桃枝枯病的小新壳梭孢Neofusicoccum parvum检测体系,灵敏度达30 fg·μL-1,为核桃枝枯病的田间检测提供了新思路。
基于以上报道,本研究针对禾谷镰刀菌加入了另一对特异性引物,建立了一种快速、灵敏、高度特异的巢式PCR 检测体系,并将检测范围扩大至前期的种子检测,不仅解决了常规PCR 中存在的假阳性和误检的问题,还提高了检测的灵敏性;同时,本研究还优化了检测流程,在种子检测时采用NaOH 裂解法快速提取DNA,进一步缩短了检测时间,是国内首次基于巢式PCR 技术对玉米茎基腐病病原菌-禾谷镰刀菌进行种子检测的报道,为玉米种子带菌检测提供了新方法、新思路。
近年来,对禾谷镰刀菌的其他分子检测方法也有报道。史亚娟等[34]建立了引起玉米穗腐病的两种镰孢菌的双重PCR 快速检测体系,DNA 模板的检测灵敏度为6.25 ng·μL-1,可一次性检测出禾谷镰刀菌和拟轮枝镰孢菌,节约了检测时间和成本,但也不可避免因DNA 浓度较低、易受污染、条件控制不好的缺点,从而导致结果不理想;王芝涵等[35]建立了引起玉米穗腐病的禾谷镰刀菌LAMP 快速检测方法,灵敏度可达100 pg·μL-1,该方法操作简便,检出效率高,用时短,不需要复杂的仪器设备,但是容易造成假阳性现象;本研究建立了基于巢式PCR技术对禾谷镰刀菌的检测体系,进一步提高了检测灵敏度,可检浓度达4.224 pg·μL-1,相对于其他分子检测方法更为准确,也将检测范围从发病组织扩大至玉米种子,在实验室可实现精准检测。
