茶树菇多糖通过ROS-线粒体功能障碍通路诱导结直肠癌细胞凋亡
2023-10-09汪紫薇陈坤英胡婕伦聂少平周兴涛
汪紫薇,陈坤英,张 珂,胡婕伦,聂少平,周兴涛
(南昌大学食品科学资源挖掘全国重点实验室,江西 南昌 330047)
结直肠癌是一种全球性消化道恶性肿瘤,同时也是医学史上巨大的挑战之一[1]。2020年,WHO国际癌症研究机构公布的数据表明,全球人口中有193多万人被诊断为结直肠癌,占全球所有新诊断癌症的9.7%。中国人口总数中被新确诊为结直肠癌的患者超过55万,占中国新确诊癌症人数的12.2%,另外,在中国女性群体中,因为结直肠癌而死的人数仅次于肺癌致死人数[2]。结直肠癌已成为中国女性癌症死亡的第二大杀手。由于结直肠癌的症状多出现在中晚期,因此大多数患者在中晚期才被确诊,错过最佳治疗时机,这导致结直肠癌的死亡率居高不下[3]。研究表明,结直肠癌的致死率和发生率在癌症中排名前三[4]。结直肠癌的常见治疗方法是手术切除和化疗,但是手术切除无法彻底清除肿瘤,而且化疗伴有肠功能障碍和神经病变等副作用,严重损害患者的身体[3]。因此,开发低副作用的天然来源活性成分是对抗结直肠癌症的当务之急[5,6]。
茶树菇(Agrocybecylindracea)隶属真菌界,又名柱状田头菇、茶菇、杨树菇、茶薪菇、柱状环锈伞[7]等,广泛分布在亚热带和北温带地区[7]。我国设有多个茶树菇生产地,比如主要生产干菇的福建古田县和江西、生产鲜菇的昆明和成都等地[8]。茶树菇是一种兼具口感、香味、营养和药用价值的食用菌[9],富含多种人体必需氨基酸、大量的蛋白质、丰富的B族维生素和多种矿质元素钾、钠、镁、锌[8],号称“中华神菇”。大量研究发现,茶树菇在抗肿瘤、抗氧化、抑菌和免疫调节等方面具有非常好的潜在研究价值[10-13]。茶树菇多糖是从茶树菇中提取出的主要活性成分之一[14]。研究证明茶树菇多糖对人类疾病的研究表现出重要的生理研究价值。例如,茶树菇多糖显著地抑制了小鼠体内的腹水瘤和植入的肉瘤,升高了环磷酰胺作用的小鼠体内白细胞数[15]。茶树菇多糖通过腹腔注射进入小鼠,显著增加了小鼠免疫器官脾脏的重量,同时显著增强了小鼠腹腔巨噬细胞的吞噬功能,提高了小鼠免疫功能[12]。在体外,热水法提取的茶树菇多糖对多种癌细胞具有明显的抗增殖的活性作用[16]。
线粒体是参与能量供应、生存信号传递、铁和钙缓冲、活性氧信号传递以及类固醇激素合成的多任务细胞器[17]。为了确保所有这些任务都能有效地完成,线粒体在任何时候都需要保持稳态。ROS是细胞内超氧阴离子、羟自由基和过氧化氢的统称,主要来源于线粒体呼吸链[18]。研究发现,正常水平的ROS是维持细胞稳态的一个必要条件,而过量的ROS产生则会引发细胞凋亡、损伤及死亡[19]。其中ROS积累诱导的凋亡是通过触发线粒体通透性过渡孔的开放,影响线粒体功能,释放促凋亡因子造成的[20]。
本课题组前期的研究中,对茶树菇多糖的组成成分和多糖结构进行了研究[14]。已有研究表明茶树菇多糖具有抗肿瘤活性,但其对结直肠癌细胞的功能活性作用机制尚不清楚[16]。本研究通过体外细胞实验探究了茶树菇多糖抑制结直肠癌细胞增殖的分子机制。
1 材料与设备
1.1 材料与试剂
小鼠结直肠癌细胞CT26和大鼠正常肠上皮细胞IEC-6,中国上海科学院细胞库;人结直肠癌细胞HCT-116和HCT-116细胞专用培养基,中国武汉普诺赛生物公司;茶树菇多糖(糖含量81%、蛋白含量4.7%,提取方法和检测方法已报道[14]),南昌大学食品科学与技术国家重点实验室;CCK-8试剂盒,上海Dojindo Molecular Technologies公司;DMEM培养基、RPMI培养基、胰蛋白酶-EDTA消化液(0.25%)、4%多聚甲醛、吖啶橙-溴化乙锭(AO-EB)、结晶紫染液、Hochest、Trizol试剂和PBS缓冲液片剂,北京索莱宝公司;牛血清蛋白(FBS),以色列Bioind公司;双氧水,中国西陇公司;线粒体压力测定试剂盒,美国Agilent Technologies公司;Mito-Tracker Red荧光探针,美国Thermo Fisher Scientific公司;Dihydroethidium(DHE)荧光染料,英国Abcam公司;N-acetyl-L-cysteine(NAC),上海碧云天公司。
1.2 仪器与设备
生化培养箱(SHP-150),上海森信实验仪器公司;CO2培养箱(HERACELL 150、BB150)和酶标仪(Variouskan Flash),美国Thermo Fisher Scientific公司;低温高速离心机(3K15),德国Sigma公司;倒置荧光显微镜(CKX41),日本奥林巴斯公司;超纯水净化系统(Milli-Q),美国Milipore公司;超净工作台,苏州AIRTECH公司;凝胶成像系统(Chemi XRS+),美国Bio-rad公司;海马能量分析仪(Seahorse XF),美国Agilent Technologies公司。
2 实验方法
2.1 细胞培养
IEC-6、CT26和HCT-116细胞分别使用DMEM培养基(含10% FBS)、RPMI培养基(含15% FBS)和HCT-116细胞专用培养基培养。传代步骤:待细胞汇合率达到80%左右,倒掉旧培养基,无菌PBS清洗两遍,胰蛋白酶消化(不同细胞消化时间不一样,细胞开始缓慢脱落时终止消化),再离心收集细胞,按一定比例进行传代。细胞在37 ℃、5% CO2和饱和湿度的培养箱中培养。
2.2 细胞增殖活性检测
2.2.1 CCK-8实验
细胞接种于96孔板中(IEC-6:1.5×104个细胞/孔/多糖培养24 h,0.75×104个细胞/孔/多糖培养48 h;HCT-116:2.5×104个细胞/孔/多糖培养24 h,1.25×104个细胞/孔/多糖培养48 h;CT26:2×104个细胞/孔/多糖培养24 h,1×104个细胞/孔/多糖培养48 h)培养过夜使其贴壁,每组设置5个平行,然后将旧培养基更换成茶树菇多糖浓度分别为0、200、300和400 μg·mL-1的培养基继续培养24 h或48 h。吸走旧培养基,加入含10% CCK-8的培养基混合液,继续孵育40 min。使用酶标仪在450 nm波长下测定各孔吸光度值(OD)。
2.2.2 细胞克隆形成实验
CT26细胞(800个/孔)接种于六孔板中,每组设置3个平行。细胞在培养箱中培养4 d后,将培养基更换成茶树菇多糖浓度分别为0、200、300和400 μg·mL-1的培养基继续培养48 h。吸走旧培养基,加入4%多聚甲醛作用10 min。用PBS洗两遍细胞,加入结晶紫染液作用3 min。用PBS再次洗两遍细胞后,使用凝胶成像系统拍照。
2.3 转录组分析(RNA-seq)
HCT-116细胞接种于细胞培养皿中(4.5×106个细胞)培养过夜使其贴壁,每组设置3个平行,然后将旧培养基更换成茶树菇多糖浓度分别为0和400 μg·mL-1的培养基继续培养24 h。吸走旧培养基,细胞用PBS洗一遍,加入Trizol试剂。通过吹打细胞使其破裂,释放RNA。最后所有样本通过干冰运送至天津诺禾生物信息科技有限公司完成后续测序步骤。
通过HTSeq 0.12.4软件计算测序数据,根据| log2(fold change) | ≥ 0.3786和P-value<0.05筛选得到差异表达基因。在KOBAS(http://kobas.cbi.pku.edu.cn/index.php)网站上分析信号通路变化[6]。利用TBtools v1.108软件绘制热图[21]。
2.4 ROS检测
HCT-116细胞接种于十二孔板中(3×105个细胞/孔)培养过夜使其贴壁,每组设置3个平行,然后将旧培养基更换成茶树菇多糖浓度分别为0、200、300和400 μg·mL-1的培养基继续培养24 h。H2O2(400 μmol·L-1,预处理2 h)作为阳性对照。吸走旧培养基,加入含1 μmol·L-1DHE荧光染料的培养基混合液,避光孵育30 min。使用倒置荧光显微镜观察ROS生成情况。若ROS增加,红色荧光将增强;若ROS减少,红色荧光将减弱。使用Image J软件进行半定量分析。
2.5 线粒体膜电位检测
HCT-116细胞接种于十二孔板中(3×105个细胞/孔)培养过夜使其贴壁,每组设置3个平行,然后将旧培养基更换成茶树菇多糖浓度分别为0、200、300和400 μg·mL-1的培养基继续培养24 h。H2O2(400 μmol·L-1,预处理2 h)作为阳性对照。吸走旧培养基,加入预热10 min后的含100 nmol·L-1Mito-Tracker Red的培养基混合液,继续孵育30 min。吸走培养基,加入Hoechst孵育30 min。在倒置荧光显微镜下观察线粒体膜电位变化。若线粒体膜电位上升,红色荧光将增强;若线粒体膜电位下降,红色荧光将减弱。使用Image J软件进行半定量分析。
2.6 线粒体压力测试
通过海马能量分析仪测量氧消耗率(OCR),基于OCR分析线粒体各项指标(ATP产生量、基础呼吸值、质子漏、最大呼吸值、非线粒体呼吸值和线粒体备用呼吸能)[22]。HCT-116细胞接种在海马能量分析仪配套的细胞培养小孔板中(8×103个细胞/孔)培养过夜使其贴壁,每组设置3个平行,然后将旧培养基更换成茶树菇多糖浓度分别为0和400 μg·mL-1的培养基继续培养24 h。按照线粒体压力测定试剂盒说明书操作,在测量前一天晚上活化探针板。测量当天,细胞使用含10 mmol·L-1葡萄糖、1 mmol·L-1丙酮酸、2 mmol·L-1谷氨酰胺的RPMI(pH为7.4,37 ℃预热)清洗,随后放入探针板,将寡霉素、FCCP、抗霉素A和鱼藤酮以终浓度为1.5、1、0.5和0.5 μmol·L-1注射到相应的细胞培养孔中,细胞放入海马能量分析仪中测量各项指标。最后采用软件Wave 2.6.0对OCR数据进行分析。
2.7 吖啶橙-溴化乙锭(AO-EB)染色实验
HCT-116细胞接种于十二孔板中(3×105个细胞/孔)培养过夜使其贴壁,每组设置3个平行,然后将旧培养基更换成茶树菇多糖浓度分别为0、200、300和400 μg·mL-1的培养基继续培养24 h。每孔加入20 μL AO-EB染料(AO与EB等体积混合)染色5 min。使用倒置荧光显微镜拍照。凋亡细胞的荧光明显更亮。共有四种细胞:活细胞(染色质呈绿色、结构正常)、早期凋亡细胞(染色质呈绿色、结构收缩)、晚期凋亡细胞(染色质呈橙红色、结构收缩)和非凋亡的死亡细胞(染色质橙红色、结构正常)。
2.8 茶树菇多糖联合NAC作用于HCT-116细胞
采用AO-EB染色法检测茶树菇多糖联合NAC(ROS抑制剂)对HCT-116细胞凋亡的影响,方法同2.7。共设立4个组别:正常组(NC);茶树菇多糖处理组(200、300、400 μg·mL-1);抑制剂组(NAC):100 μmol·L-1的NAC预处理30 min;茶树菇多糖联合NAC处理组(200、300、400 μg·mL-1+NAC):100 μmol·L-1的NAC预处理30 min后,然后加入茶树菇多糖浓度分别为0、200、300和400 μg·mL-1的培养基。
2.9 数据处理
采用GraphPad Prism 8软件对各组进行方差分析(双或单因素),显著性采用Dunnett或Tukey多重比较检验确定。P<0.05:均值差异有统计学意义。统计差异显著性为:*,P<0.05,显著;**,P<0.01,极显著;#,P<0.001,超显著。结果以至少3次独立实验的均数±标准差(Mean±SD)表示。
3 结果与分析
3.1 茶树菇多糖抑制结直肠癌细胞增殖活性
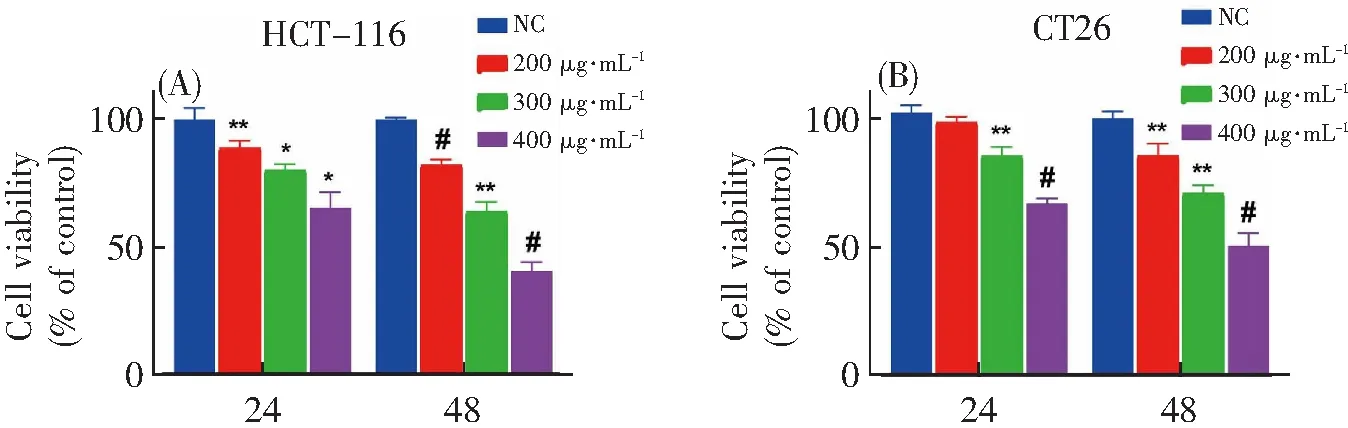
大量研究表明,多糖具有抗肿瘤活性[23]。本研究中CCK-8检测结果表明,茶树菇多糖显著抑制结直肠癌细胞HCT-116和CT26增殖活力,并呈浓度和时间依赖关系。与正常组相比,HCT-116细胞在400 μg·mL-1茶树菇多糖处理24和48 h后,细胞活力分别降低至65%和40%(图1A),CT26细胞在400 μg·mL-1茶树菇多糖处理24 h和48 h后,细胞活力分别降低至66%和50%(图1B)。此外,细胞克隆形成实验结果表明,CT26细胞增殖能力在300和400 μg·mL-1茶树菇多糖组受到明显抑制(图1C和D)。有趣的是,茶树菇多糖对正常肠上皮细胞IEC-6增殖无抑制作用(图1E)。上述结果表明,茶树菇多糖具有抑制结直肠癌细胞增殖的活性,且对正常肠上皮细胞无副作用。
3.2 茶树菇多糖下调HCT-116细胞氧化磷酸化通路
为了探究茶树菇多糖抑制HCT-116细胞增殖的机制,本研究进行了RNA-seq实验。结果表明茶树菇多糖显著下调了氧化磷酸化和呼吸电子传递等通路(图2A)。此外,如图2B所示,MT-ND1、MT-ND2等氧化磷酸化相关基因的转录水平显著下降(离散色阶:红色表示基因高表达,蓝色表示基因低表达)。研究表明,氧化磷酸化通路的下调会导致肿瘤细胞增殖能力下降[24]。例如,Sara等研究发现白藜芦醇通过损害氧化磷酸化途径阻止转移性HeLa癌细胞生长[25]。综上分析,茶树菇多糖抑制HCT-116细胞增殖的机制可能涉及氧化磷酸化通路的下调。
t/h t/h

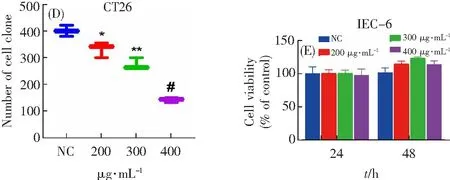
将茶树菇多糖(0、200、300、400 μg·mL-1)作用于HCT-116细胞(A)、CT26细胞(B)和IEC-6(E)细胞24、48 h,采用CCK-8法检测细胞活力;(C)CT26细胞克隆形成实验的代表性图像;(D)细胞克隆数定量。
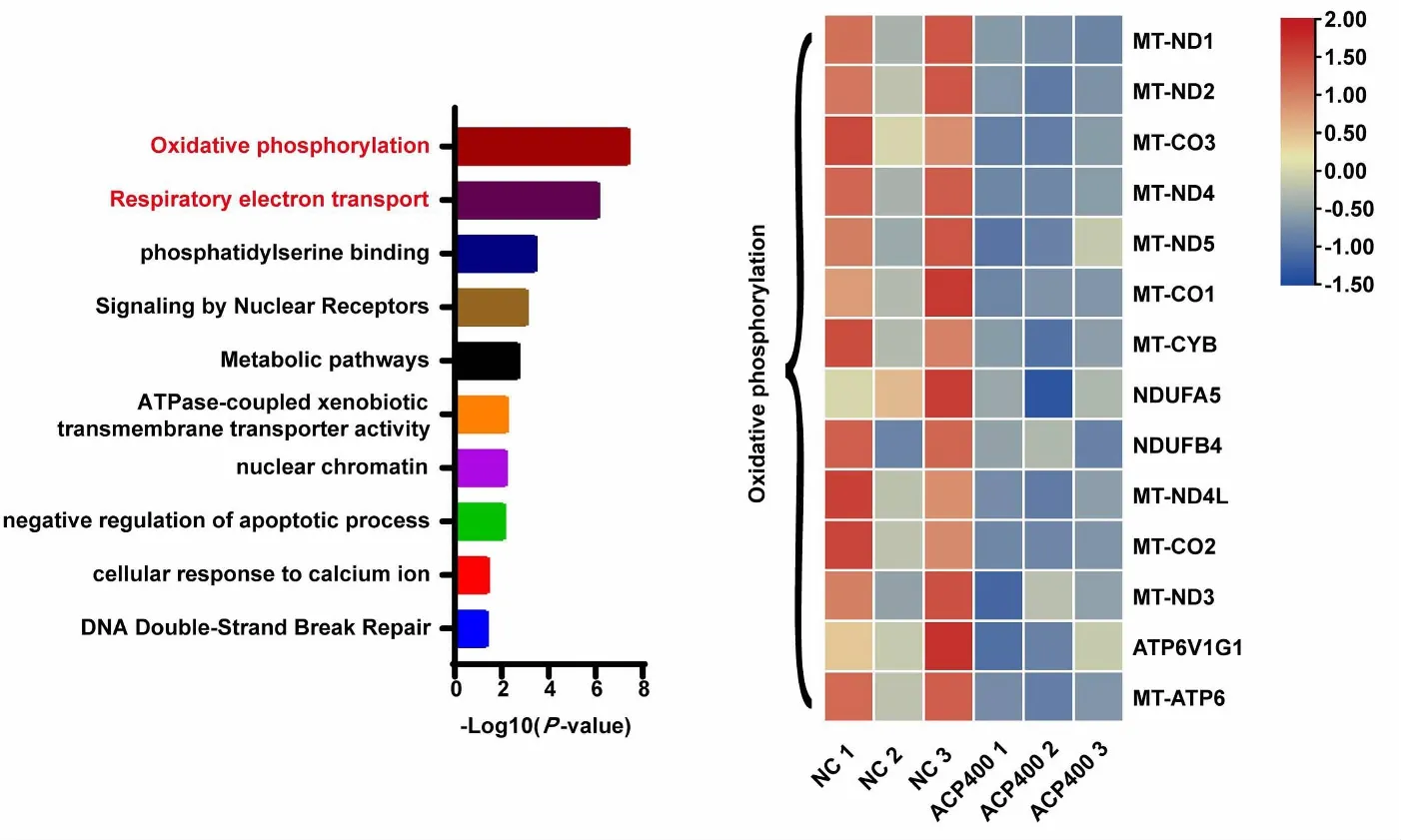
(A)茶树菇多糖抑制HCT-116细胞增殖的相关下调通路;(B)茶树菇多糖影响HCT-116细胞中氧化磷酸化通路的热图。
3.3 茶树菇多糖诱导HCT-116细胞ROS积累
研究表明,氧化磷酸化受损通常会引起ROS过度产生,而ROS积累又会破坏线粒体电子传递链,进而抑制氧化磷酸化,形成一个“恶性循环”[26-27]。因此,为了探究RNA-seq分析结果中茶树菇多糖下调的氧化磷酸化通路是否与ROS积累之间存在关系,本研究采用DHE荧光染料检测HCT-116细胞中ROS的变化。结果如图3A所示,随着茶树菇多糖浓度增加,荧光明显增强。经定量统计分析发现,300和400 μg·mL-1茶树菇多糖在HCT-116细胞中分别诱导了1.4、1.7倍以上的ROS(图3B)。综上分析,茶树菇多糖显著诱导了ROS的积累。
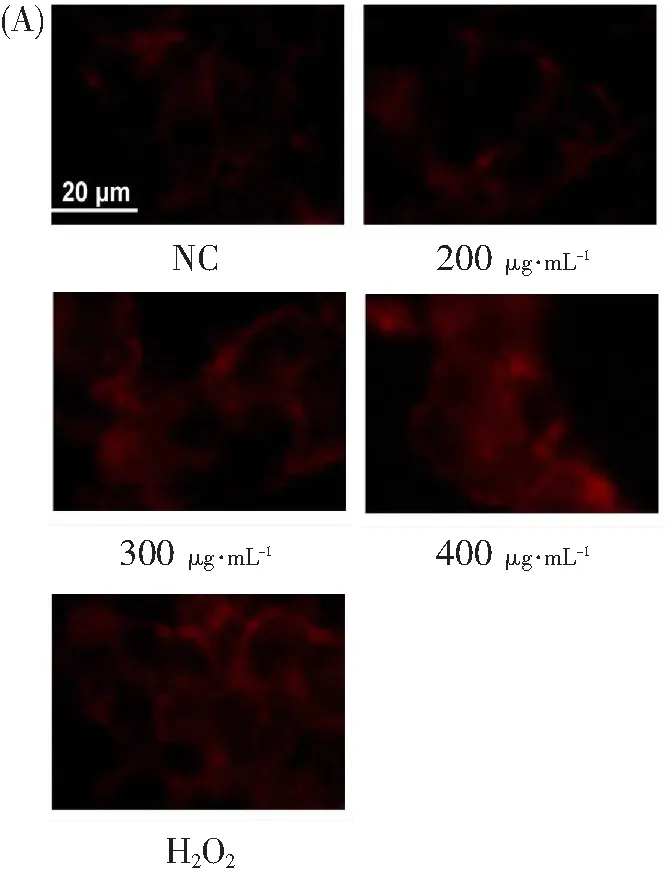
(A)DHE荧光染料染色后的代表性图像

μg·mL-1(B)ROS平均荧光强度的定量
3.4 茶树菇多糖诱导HCT-116细胞线粒体膜电位丧失
在癌细胞中,高水平的ROS表明线粒体功能可能已经受损[28]。此前,Zhang等人发现芦荟凝胶葡甘露聚糖诱导结直肠癌细胞CT26中ROS积累和线粒体膜电位下降进而导致线粒体功能障碍[29]。线粒体膜电位是评估线粒体功能的常用参数。因此,本研究采用Mito-Tracker Red荧光探针检测线粒体膜电位变化。结果如图4A所示,随着茶树菇多糖浓度增加,红色荧光明显减弱。经定量统计分析发现,茶树菇多糖显著降低了HCT-116细胞线粒体膜电位,尤其是300和400 μg·mL-1茶树菇多糖组线粒体膜电位分别为正常组的0.5倍和0.4倍左右(图4B)。综上分析,茶树菇多糖显著诱导了HCT-116细胞线粒体膜电位丧失。
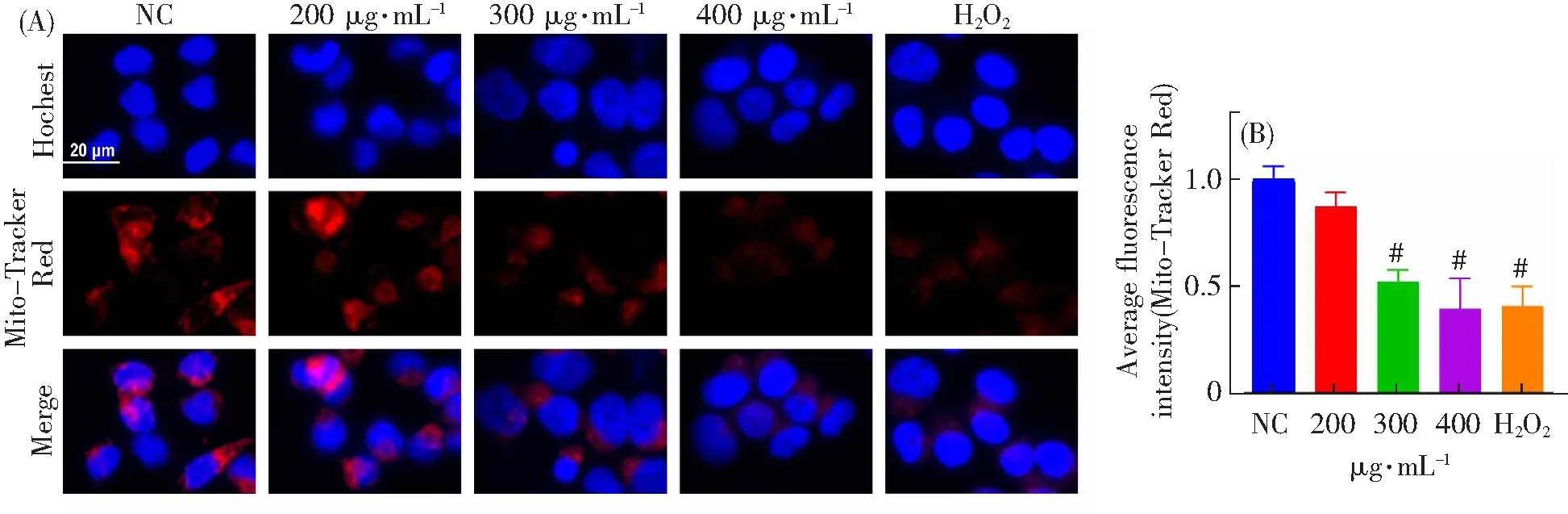
(A)Mito-Tracker Red和Hoechst染色后的代表性图像;(B)线粒体膜电位定量分析。
3.5 茶树菇多糖诱导了HCT-116细胞线粒体功能障碍
线粒体是细胞内产能细胞器。线粒体氧化磷酸化是细胞获取能量的主要途径之一[30]。ROS增加以及氧化磷酸化抑制可能导致细胞能量供应不足[31]。因此,本研究采用海马能量分析仪检测OCR完成线粒体压力测试。OCR检测原理如图5A。结果如图5B-H所示,400 μg·mL-1茶树菇多糖明显降低了HCT-116细胞中ATP产生量、基础呼吸值、最大呼吸值、非线粒体呼吸能和线粒体备用呼吸能。上述结果表明,茶树菇多糖导致HCT-116细胞线粒体的产能能力、能量储备等功能下降,即功能发生障碍。

t/min(A)OCR原理图 t/min (B)400 μg·mL-1 茶树菇多糖处理HCT-116细胞后OCR的变化
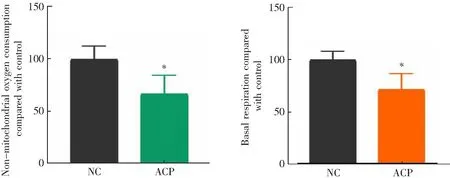
(C)非线粒体呼吸能定量分析 (D)基础呼吸值定量分析

(E)线粒体备用呼吸能定量分析 (F)最大呼吸值定量分析

(G)质子漏定量分析 (H)ATP产生量定量分析
3.6 茶树菇多糖通过ROS-线粒体功能障碍通路诱导HCT-116细胞凋亡
线粒体功能障碍会导致促凋亡因子(细胞色素c等)释放从而引起凋亡的发生[32,33]。因此,本研究采用AO-EB染色法检测细胞凋亡的发生。如图6A所示,随着茶树菇多糖浓度的增加,HCT-116细胞的形态发生明显皱缩并且橙色荧光明显增强。统计分析(图6B)结果表明,茶树菇多糖诱导了HCT-116细胞凋亡。为了进一步验证茶树菇多糖诱导的ROS在HCT-116细胞凋亡中的作用,使用NAC预处理来抑制ROS的产生。结果如图6A和B所示,400 μg·mL-1茶树菇多糖组中细胞凋亡比例为24%,经NAC预处理的400 μg·mL-1茶树菇多糖组中的细胞凋亡比例为18.6%,两组之间的差异具有统计学意义。以上结果表明,茶树菇多糖通过促进ROS过量积累导致线粒体功能障碍,进而诱导HCT-116细胞凋亡。
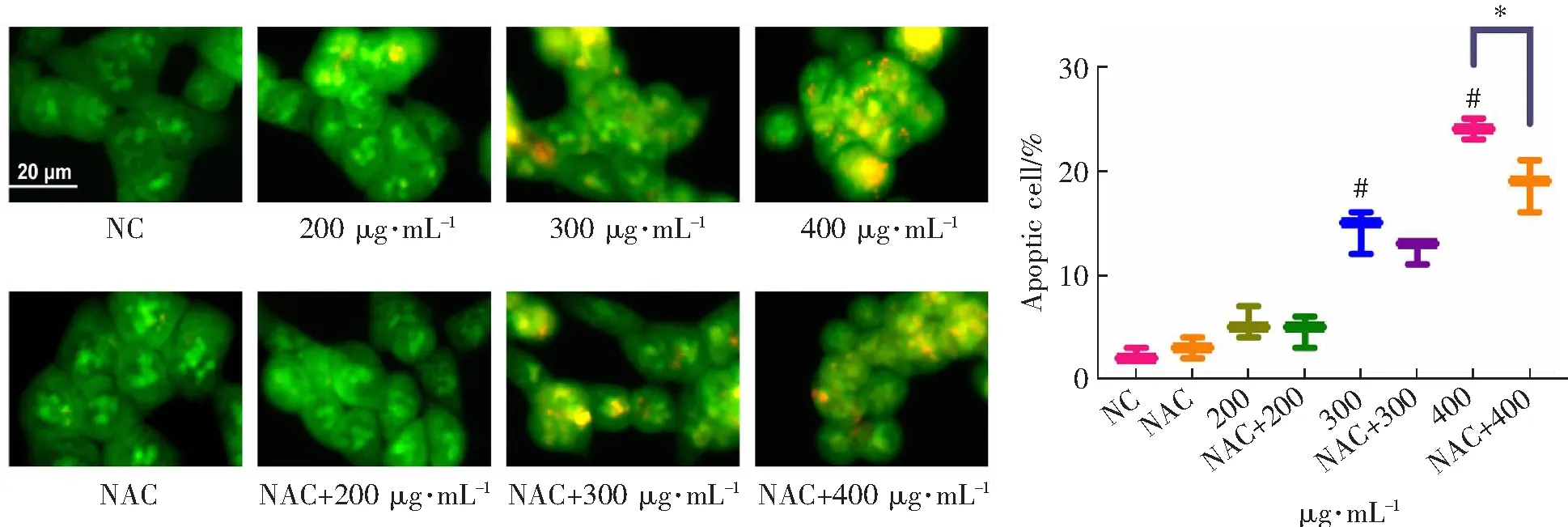
(A)AO-EB染色检测细胞凋亡 (B)AO-EB染色定量
4 结论
由于结直肠癌的高发率和不断上升的死亡率,开发治疗结直肠癌的新药物迫在眉睫。相对于化疗药物的高毒副作用,高效、安全的天然活性物质逐渐进入研究者的视野。本研究发现天然来源的茶树菇多糖具有显著抑制结直肠癌细胞HCT-116和CT26增殖的功能活性作用,并且抑制效果随多糖浓度和处理时间增加而增强。值得注意的是,茶树菇多糖对正常肠上皮细胞IEC-6无毒害作用。此外,茶树菇多糖显著下调了HCT-116细胞氧化磷酸化通路以及诱导了ROS的生成。ROS过量积累导致线粒体膜电位丧失以及线粒体功能障碍,从而诱导HCT-116细胞凋亡,并最终抑制其增殖。重要的是,抗氧化剂NAC通过清除ROS验证了茶树菇多糖通过ROS-线粒体功能障碍通路诱导HCT-116细胞凋亡这一结果。本研究为进一步开发和应用茶树菇多糖提供了理论基础。
