香叶木素抑制多酚氧化酶的分子机制
2023-10-09洪鑫月张国文
洪鑫月,张国文
(南昌大学食品科学资源挖掘全国重点实验室,江西 南昌 330047)
多酚氧化酶(Polyphenol oxidase,PPO),也被称为酪氨酸酶,广泛存在于蔬菜、水果和许多其他生物体中[1]。如图1A所示,多酚氧化酶通常以四聚体形式存在[2]。作为一种金属氧化酶,其双核铜活性中心的两个铜离子分别与3个组氨酸配位(图1B)[3]。PPO催化氧化酚类物质形成黑色素:在氧分子存在下,PPO将单酚邻羟基化,随后将邻二酚氧化为多巴醌,并最终形成黑色素,这个过程通常伴随着体系颜色的加深[4]。在食品工业中,由PPO导致的褐变会降低食品的营养价值,不良的颜色变化也使消费者难以接受,使食品丧失其商业价值,造成巨大的经济损失[5]。目前,人们对典型的PPO抑制剂如对苯二酚、熊果苷和曲酸等使用的安全性仍存在一些争论[6]。因此,从天然产物中发掘高效、安全的PPO抑制剂已成为食品和医药领域的研究热点之一。
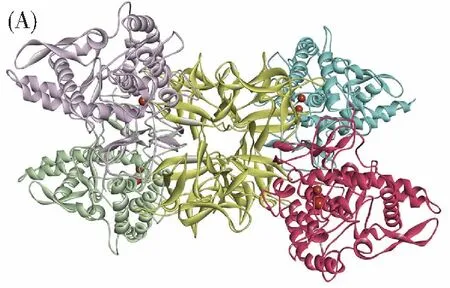
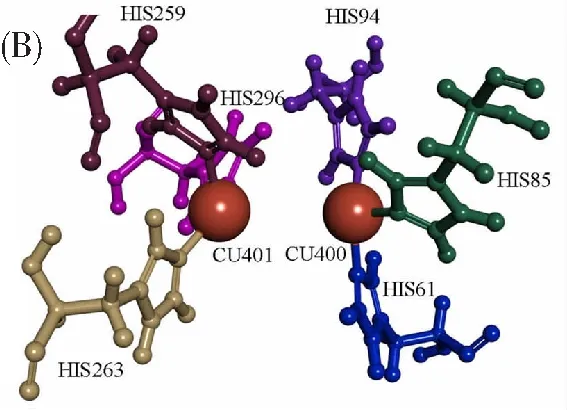
图1 (A) 四聚体形式的多酚氧化酶;(B) 多酚氧化酶的双核铜活性中心Fig.1 (A) PPO in the form of tetramer;(B) The binuclear copper active center of PPO
香叶木素(Diosmetin)是一种常见于各种柑橘类果实中的膳食黄酮,具有抗炎抑菌、抗氧化、抗肿瘤等多重生物活性[7,8],其作为酶抑制剂也有较大潜力。Liu等[9]报道香叶木素以可逆竞争的方式抑制黄嘌呤氧化酶的活性,抑制机制可能是香叶木素能够与酶结合并改变酶的构象从而降低酶的催化活性。同时,许多黄酮类化合物已被证实具有PPO抑制能力。桑色素[10]和槲皮素[11]是可逆竞争型的PPO抑制剂,二氢杨梅素[12]和芹菜素[13]对PPO表现出较强的混合型抑制活性,柚皮素是一种非竞争型PPO抑制剂[14]。Si等[15]运用分子模拟发现橙皮素可以螯合活性中心的铜离子并推测这可能是其具有抑制活性的原因之一。Jeong等[16]报道黄芩苷可能通过控制细胞中酪氨酸酶的含量从而抑制黑色素的合成。然而,有关香叶木素对PPO的抑制效果及抑制机制的研究却十分有限。因此,本文运用多种光谱学方法联合计算机模拟技术,系统研究了香叶木素对PPO的抑制作用及机制,以期为香叶木素作为新型PPO抑制剂的应用提供实验依据和理论基础。
1 实验部分
1.1 仪器与试剂
紫外-可见分光光度计(UV-2450型,岛津公司,日本);荧光分光光度计(F-7000型,日立公司,日本);圆二光谱仪(MOS-450型,Bio-Logic公司,法国);电子天平(BSA224S型,Sartorius公司,德国);酸度计(pHS-3C型,雷磁公司,上海);恒温水浴锅(HH-6型,上海腾林)。
PPO(EC 1.14.18.1,128 kDa,Worthington公司,美国);香叶木素(纯度≥98%)和左旋多巴(纯度≥98%)均购自阿拉丁生化科技有限公司(中国上海);曲酸(纯度≥99%)购自奥德福尼生物技术有限公司(中国南京)。用DMSO配制香叶木素溶液(40.0 mmol·L-1);PPO储备液(20.0 μmol·L-1)和左旋多巴溶液(5.0 mmol·L-1)用PBS(50.0 mmol·L-1,pH 6.8)配制,底物现用现配。其他药品试剂的纯度均为分析纯,实验用水均为超纯水。
1.2 实验方法
1.2.1 香叶木素对PPO的抑制活性测定
采用Li等[17]的方法,对香叶木素的抑制能力进行测定。在总体积为2 mL的PBS(50.0 mmol·L-1,pH 6.8)反应体系中,分别加入20 μL PPO储备液(20.0 μmol·L-1)和不同体积(2.5、5.0、7.5、10.0、15.0、20.0、25.0、30.0、35.0、40.0、45.0、50.0 μL)的香叶木素(40.0 mmol·L-1),置于30℃水浴中孵化1 h。随后加入200 μL左旋多巴溶液(5.0 mmol·L-1)开启反应。使用紫外-可见分光光度计中的时间-动力学程序,每5 s测定一次475 nm处的吸光度,测定41次,共200 s。使用相对酶活来表示样品的抑制能力。不加抑制剂时PPO的活性定义为100%。阳性对照为曲酸。
相对酶活性(100%)=(K1/K0)×100%
(1)
K0和K1分别表示未加入和加入抑制剂后反应体系的吸光度随时间变化的斜率。
1.2.2 香叶木素对PPO的抑制动力学
抑制可逆性的测定:在不同浓度(0、200、400、700 μmol·L-1)的香叶木素存在下,加入不同体积(10、15、20、25、30 μL)的PPO储备液(20.0 μmol·L-1),于30 ℃水浴中孵化1 h后加入200 μL左旋多巴溶液(5.0 mmol·L-1)开启反应。吸光度的测定同1.2.1。以酶促反应速率(v=ΔOD/min)对酶浓度作图,根据曲线特性判定香叶木素的抑制可逆性。
抑制类型的判断:在不同浓度(0、200、400、700 μmol·L-1)的香叶木素存在下,加入20 μL的PPO溶液(20.0 μmol·L-1),于30 ℃水浴中孵化1 h后加入不同体积(100、150、200、250、300 μL)的左旋多巴溶液(5.0 mmol·L-1)开启反应。吸光度的测定同1.2.1。以酶促反应速率(v=ΔOD/min)对底物浓度作图并结合Lineweaver-Burk双倒数方程对香叶木素的抑制类型进行判断。
1.2.3 荧光光谱法
荧光猝灭实验:不同温度(298、301、310 K)下,在2 mL PPO溶液(2.0 μmol·L-1)中,逐次加入5 μL的香叶木素(1.0 mmol·L-1),共10次。每次加入香叶木素,溶液需混匀并静置3 min,然后扫描290~500 nm范围内的荧光发射光谱。激发波长280 nm,狭缝宽度2.5 nm。
同步荧光实验:将激发波长和发射波长始终保持在15 nm(60 nm)的差值条件下,扫描酪氨酸(或色氨酸)的同步荧光光谱,分析香叶木素的加入对PPO中这两种氨基酸残基的影响。在298 K,发射波长扫描范围为200~400 nm,其他实验条件同荧光猝灭实验。
三维荧光实验:在2 mL实验体系中,PPO和香叶木素浓度分别为2.0 μmol·L-1和15.0 μmol·L-1,分别扫描PPO和香叶木素-PPO体系的三维荧光光谱。激发波长和发射波长的扫描范围均为200~600 nm,步长为5 nm。Matlab软件绘制三维荧光图。
香叶木素的紫外吸收可能会产生“内滤光效应”,因此,实验测得的荧光数据用下式进行校正[18]:
(2)
FM和FC分别是荧光的测量值和校正值。A1和A2分别是香叶木素在280和340 nm处的紫外吸收值。
1.2.4 CD光谱法
扫描不同反应体系(c香叶木素:c多酚氧化酶=0:1、1:1和4:1)的CD光谱,扫描范围设置为190~250 nm。CD光谱仪在室温下运行,氮气流保持在5 MPa左右。扫描光谱时应扣除背景吸收(PBS,50.0 mmol·L-1,pH 6.8)。利用SELCON3程序对数据进行处理后获得多酚氧化酶各二级结构的含量。
1.2.5 分子对接及分子动力学模拟
应用分子对接软件(Discovery Studio 2016 v16.1.0)预测香叶木素与PPO的结合位点。PPO(PDB ID:2Y9X)的晶体结构来自RCSB PDB蛋白质数据库,香叶木素的3D结构(Compound CID:5281612)来自PubChem数据库。PPO进行预处理(去水,加氢,加极性)后被定义为受体,与配体香叶木素进行100次的分子对接模拟。选取最优构象(最低的CDOCKER结合能和最低的CDOCKER相互作用能量)进行结果分析[19]。
使用GROMACS 5.1软件进行分子动力学模拟,采用Acpype Server程序对香叶木素的拓扑文件进行预处理。香叶木素与PPO分别使用AMBER和AMBER99SB-ILDN protein力场。加入Na+和Cl-中和电荷后进行能量最小化操作,随后在300 K温度下分别进行100 ps的NVT和NPT平衡。分子动力学模拟时间为150 ns[20]。
2 结果与讨论
2.1 香叶木素对PPO的抑制作用分析
图2A显示香叶木素和曲酸均具有PPO抑制能力,随着体系内二者浓度的增加,PPO的相对酶活性不断下降。香叶木素的浓度从50.0 μmol·L-1增加至1 000.0 μmol·L-1时,PPO的相对活性从85.24%降至21.5%,而50.0 μmol·L-1的曲酸使PPO的活性降低至27.50%。香叶木素和曲酸的IC50值分别为(302.9±1.82) μmol·L-1和(15.0±0.24) μmol·L-1,尽管香叶木素对PPO的抑制活性要弱于经典抑制剂曲酸,但也显示出较好的PPO抑制能力。
图2B显示,在不同浓度的香叶木素体系中,PPO浓度与酶促反应速率的拟合直线都经过原点,且香叶木素浓度增大,拟合直线斜率下降。以上结果表明香叶木素可逆地抑制PPO的催化活性,而不是使酶完全失活[21]。
利用双倒数曲线判断香叶木素对PPO的抑制类型。图3A中四条拟合直线均有良好的线性关系且相交于第二象限。香叶木素浓度增加,Km值增加而Vmax值减小。由此判断香叶木素为PPO的混合型抑制剂。下列公式通常用以描述混合型抑制[22]:
(3)
(4)
(5)
计算得到抑制常数Ki为327.9±2.46 μmol·L-1,表观系数α为2.78,α>1意味着香叶木素与单独PPO的结合亲和力强于香叶木素与PPO-底物复合物的结合,即香叶木素更倾向于与游离酶结合[3,12]。图3B和C中斜率和截距分别对香叶木素浓度作图,曲线均显示出良好的线性关系,表明香叶木素在PPO上只有一个或一类抑制位点。

[Diosmetin]/(μmol·L-1) [PPO]/(μmol·L-1)
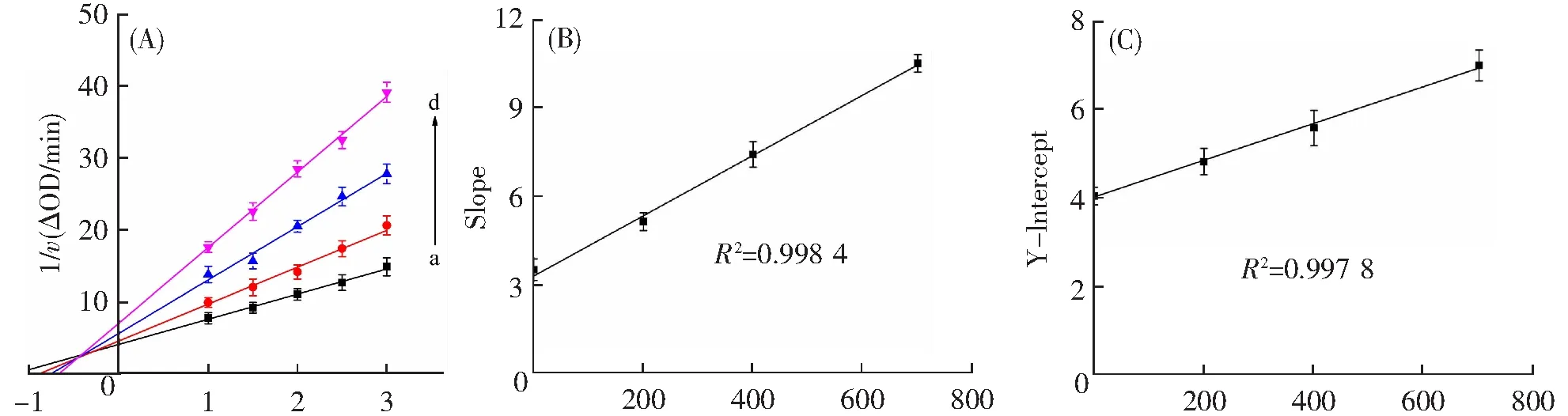
1/[L-DOPA/(μmol·L-1)] [Diosmetin]/(μmol·L-1) [Diosmetin]/(μmol·L-1)c(PPO)=0.2 μmol·L-1;c(diosmetin)=0、200、400、700 μmol·L-1 for curves a→d。
2.2 香叶木素对PPO荧光光谱的影响
2.2.1 荧光猝灭机制分析
当λex=280 nm时,由于PPO含有色氨酸(Trp)和酪氨酸(Tyr)等芳香族氨基酸,其在340 nm处有一个特征荧光发射峰。图4A中香叶木素的加入令酶的荧光强度从570.2下降至323.1,这意味着香叶木素能够通过影响PPO中的Trp和Tyr残基而猝灭PPO内源荧光。
香叶木素对PPO的猝灭方式可利用Stern-Volmer方程[23]进行描述:
(5)
F0、F分别表示PPO和PPO-香叶木素体系的荧光强度,[Q]为香叶木素浓度。计算得到的荧光猝灭常数Ksv和生物分子猝灭常数Kq均列与表1中。在未添加猝灭剂时,荧光团平均寿命τ0约为10-8s[11]。
图4B所示,不同温度下F0/F对[Q]作图,三条拟合直线都表现出很好的线性关系。温度升高,Ksv值增大,但Kq值远大于2.0 1010L·mol-1·s-1,表明香叶木素对PPO的猝灭方式为单一的静态猝灭[24]。
aR为Ksv的相关系数,bR为Ka的相关系数。
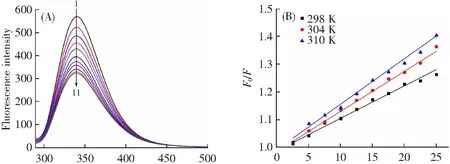
λ/nm >[Diosmetin]/(μmol·L-1)
2.2.2 结合常数和结合位点数
用下列方程求得不同温度下香叶木素与PPO的结合常数Ka与结合位点数n[10]:
(6)
[Qt]和[Pt]分别是香叶木素和PPO的浓度。在实验温度(298、304和310 K)下,Ka值分别为1.20×104、1.80×104和2.28×104L·mol-1(表1),即香叶木素和PPO显示出中等强度的结合亲和力。温度升高,Ka值增加,意味着PPO-香叶木素复合物的形成与温度正相关。实验温度下的n值均接近1,表明PPO中仅存在一个或一类香叶木素的结合位点,这些结果与酶促动力学结论一致。
2.2.3 热力学分析
通过van’t Hoff方程[3]计算香叶木素与PPO结合过程中的热力学参数值,并列于表1:
(7)
ΔG°=ΔH°-TΔS°
(8)
R是气体常数(8.314 J·mol-1·K-1)。吉布斯自由能(ΔG°)为负值,表明香叶木素与PPO是自发结合;熵变(ΔS°)和焓变(ΔH°)均为正值,表示疏水相互作用是二者结合的主要驱动力[25]。
2.3 香叶木素对PPO结构的影响
2.3.1 同步荧光光谱分析
同步荧光光谱是检测PPO中Tyr和Trp残基微环境变化的常用手段。向PPO溶液中不断加入香叶木素,Tyr和Trp残基的荧光强度分别从108.8降至70.26,和435.4减少到233.2,二者的特征峰无显著改变,表明香叶木素对这两种氨基酸残基微环境的极性和疏水性基本没有影响(图5A和B)[18]。图5C所示,Trp残基的同步荧光猝灭比率(RSFQ=1-F/F0)高于Tyr残基,表明在香叶木素猝灭PPO时Trp残基的贡献更大。
2.3.2 三维荧光光谱分析
通过三维荧光光谱分析了PPO与香叶木素相互作用引起的构象变化。图6A是PPO的三维荧光光谱。峰a(λex=λem)是瑞利散射峰,峰b(2λex=λem)是二阶散射峰。峰1(λex=280 nm,λem=340 nm)为Tyr和Trp残基的特征峰,峰2(λex=230 nm,λem=340 nm)主要反映多肽链骨架结构的荧光特征吸收峰。表2中,香叶木素的加入使得峰1的荧光强度下降28.87%,但不改变其峰位置,表明香叶木素几乎不影响Tyr和Trp残基的微环境,这与同步荧光结果一致。峰2的荧光强度降低了66.60%,且其峰位也发生变化,意味着香叶木素与PPO的相互作用影响了酶的结构[22]。
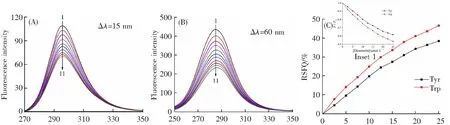
λ/nm λ/nm [Diosmetin]/(μmol·L-1)(A) Δλ=15 nm (B) Δλ=60 nm (C) 同步荧光猝灭百分比(RSFQ)

c(PPO)=2.0 μmol·L-1,c(diosmetin)=15.0 μmol·L-1。
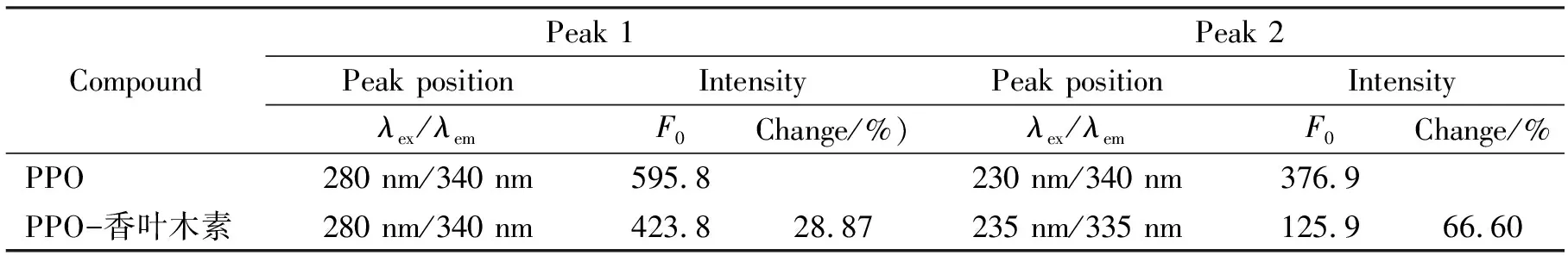
表2 PPO和PPO-香叶木素体系的三维荧光光谱特征峰Tab.2 haracteristic peaks in 3D fluorescence spectra of PPO and PPO-diosmetin systems
2.3.3 圆二色谱分析
CD光谱对蛋白质二级结构的变化非常敏感,是检测香叶木素对PPO构象影响的有力手段。210和220 nm处的两个负峰被认为是α-螺旋结构的特征峰[18]。当香叶木素与PPO的浓度比增加时(0:1→1:1→4:1),图7A中负峰强度增强峰形改变暗示着香叶木素与PPO的相互作用影响了酶的二级结构。PPO的α-螺旋含量增加(32.81%→36.00%→42.38%),β-折叠(19.11%→18.10%→13.82%)和无规则卷曲(27.28%→26.50%→23.78%)含量降低(图7B),表明香叶木素可能诱导PPO的结构部分紧缩,使底物更难进入活性中心,从而降低了PPO的催化活性。
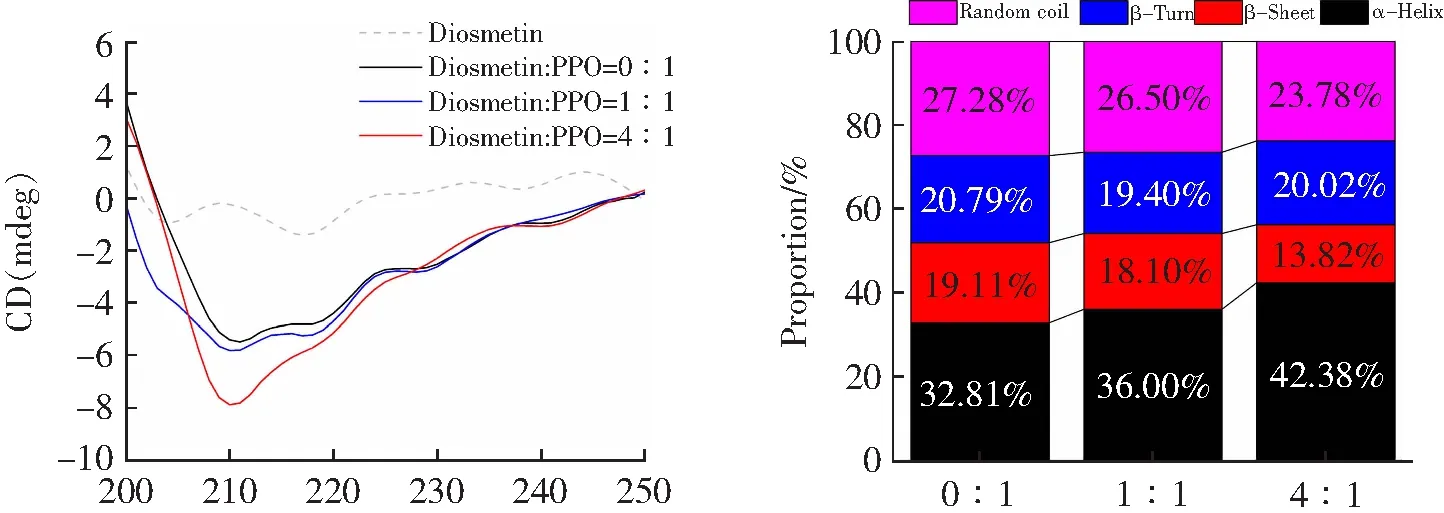
λ/nm The molar ratio of [diosmetin]vs.[PPO]
2.4 香叶木素与PPO的结合模式
2.4.1 分子对接
分子对接可以直观地观察香叶木素与PPO的结合,通过分析二者结合的优势构象得到结合位点、结合方式和作用力类型等信息。结果显示,香叶木素插入PPO的疏水空腔(图8A),结合在酶的双核铜活性中心附近(图8B),并与周围的氨基酸残基His244、Asn260、His85、Val248、Phe264、Val283及His263等发生疏水相互作用(图8C),且香叶木素的A环C-7位OH还能与Met280形成一个氢键,结合距离为4.82 Å。另外两个氢键在香叶木素C环的羰基与His85和His259之间形成,结合距离

图8 (A)香叶木素结合于PPO的疏水空腔(蓝色和橙色分别代表酶的亲水和疏水部分);(B)香叶木素与PPO的最佳结合构象;(C)香叶木素与PPO结合的2D图Fig.8 Diosmetin binds in the hydrophobic cavity of PPO.Blue and orange represent the hydrophilic and hydrophobic parts of the enzyme surface,respectively;(B) Optimal binding conformation of diosmetin and PPO;(C) 2D image of diosmetin binding to PPO
分别为4.39 Å和5.64 Å。香叶木素还能与His244、Asn260、Glu256、Phe90、His61、Phe292、Phe264、Gly281及Ser282等通过范德华力发生相互作用。此外,香叶木素的A环与氨基酸残基Val283和Ala286,B环与残基Val248以及C环与残基Val283之间均存在π-烷基键,其A环还与His263形成酰胺-π堆积(图8C)。因此,氢键、疏水相互作用和范德华力在香叶木素与PPO的结合过程中都发挥着重要作用。由此推断,香叶木素结合于酶的疏水空腔,与酶活性中心周围的氨基酸相互作用,诱导酶的构象发生改变,阻碍底物进入酶的活性中心,因而降低PPO的催化活性[3]。
2.4.2 分子动力学模拟
分子动力学模拟直观展示了PPO及PPO-香叶木素复合物结构的动态变化。均方根偏差(RMSD)可以用来评估体系的稳定性,其值波动越小体系越稳定[26]。图9A显示PPO-香叶木素复合物的RMSD值波动较大,其值最终稳定在约0.25 nm处,整体上略高于单独酶体系,这表示复合体系更不稳定。均方根波动(RMSF)有助于了解结合过程中蛋白质的局部构象变化,其值越高表示氨基酸残基的灵活性越好[27]。图9B中氨基酸残基65~75,180~185,245~253,320~330,354~360的RMSF值波动较大,表明这些残基积极参与了香叶木素与PPO的结合过程,并通过调整自身构象来形成PPO-香叶木素复合物。回旋半径(Rg)的值与酶的结构致密性呈负相关[28]。图9C显示,PPO-香叶木素复合物的Rg值在前20 ns内高于PPO,表明这t/ns Residues

t/nst/ns
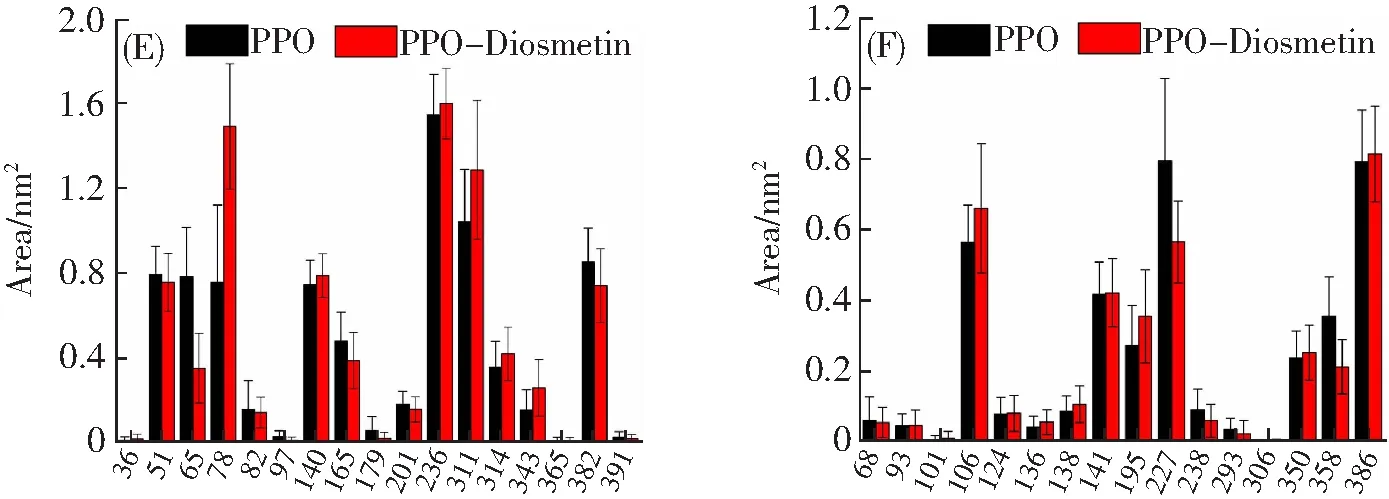
Tyr Trp
段时间内PPO的结构伸展以容纳香叶木素。在20 ns后,复合物的Rg值整体上低于PPO表明酶与香叶木素的结合令酶的结构更加紧密,与圆二结果具有一致性。溶剂可及表面积(SASA)反映了体系与溶剂接触表面积的变化,其值增大酶的疏水性降低[29]。图9D中PPO-香叶木素复合物的SASA值整体上低于PPO,表明PPO与香叶木素结合后亲水性降低疏水性增加,香叶木素诱导了酶结构紧缩。图9E和F中Tyr和Trp残基的SASA值整体上没有显著改变,说明与香叶木素结合对PPO中Tyr和Trp残基的极性和疏水性的影响不明显,分子动力学模拟验证了同步荧光的实验结果。
3 结论
香叶木素可逆混合地抑制PPO的催化活性,并能以静态方式猝灭PPO的内源荧光,疏水相互作用是稳定PPO-香叶木素复合物结构的主要作用力,两者之间只有一个结合位点。香叶木素进入PPO的疏水空腔,结合在PPO的双核铜活性中心附近,并与其周围的氨基酸残基主要通过氢键、疏水作用力和范德华力相互作用,使得PPO的稳定性和亲水性下降,结构的致密性增加。香叶木素抑制PPO活性的机制可能主要是由于该黄酮化合物结合在PPO活性中心附近,与其周围的一些氨基酸残基相互作用,占据了底物进入酶活性中心的通道,诱导了PPO二级结构发生变化,阻止了底物被酶催化,从而降低了PPO的活性。研究结果为香叶木素作为新型PPO抑制剂应用于食品工业提供科学依据。
