壮药狗蚁草中槲皮素的含量测定
2023-10-02凌庆辉陈路
凌庆辉 陈路

【摘 要】目的:探索建立狗蚁草中槲皮素的含量测定方法。方法:采用高效液相色谱(HPLC)法对药材中槲皮素的含量进行测定,色谱柱为ODS-C18柱,以乙腈-1%乙酸溶剂系统为流动相,进行梯度洗脱,检测波长为365 nm。结果:槲皮素在进样量0.125~1.25 μg范围内线性关系良好(R2=0.9996),测得槲皮素含量为0.981~1.237 mg/g。结论:所建立的方法操作简单,可控性好,可用于狗蚁草药材的质量控制。
【关键词】 狗蚁草;槲皮素;HPLC
【中图分类号】R284.1 【文献标志码】 A【文章编号】1007-8517(2023)17-0045-03
DOI:10.3969/j.issn.1007-8517.2023.17.zgmzmjyyzz202317011
Determination of Quercetin in a Zhuang Medicine: Alysicarpus Vagnalis
LING Qinghui1 CHEN Lu2*
1.Department of Pharmacology, Maternal and child health hospital of Guangxi Zhuang autonomous region, Nanning 530003, China; 2.Guangxi Zhuang Autonomous Regional Botanical Garden of Medicinal Plants, Nanning 530023, China
Abstract:Objective To establish a new method for determination of quercetin in Alysicarpus vagnalis (Linn. ) DC. Methods HPLC methods were used to the determination, the separation was performed on a ODS-C18 column with acetonitrile-1% glacial acetic acid as the mobile phase to gradient elute which was monitored at 365 nm. Results The linear ranges of quercetin was 0.125-1.25 μg(R2=0.9996) and the content of quercetin in A.vagnalis was determined as 0.981-1.237 mg/g. Conclusion The method for determination of quercetin with simple manipulate and good controllability that can use to control the quality of A.vagnalis.
Key words:Alysicarpus vagnalis (Linn.) DC; Quercetin; HPLC
狗蟻草为豆科链荚豆属植物链荚豆Alysicarpus vagnalis (Linn.) DC的干燥根、叶及全草,性平、味甘、苦,具有活血通络、驳骨消肿等功效,民间常用于治疗慢性肝炎、跌打损伤等疾病[1-3]。文献研究[4-5]发现,目前国内外仅有2篇文献对狗蚁草中的化学成分(水杨酸、胡萝卜苷、β-谷甾醇)进行含量测定。研究[6]表明槲皮素能够调控PI3K/AKT/NF- B信号通路,改善非酒精性脂肪性肝炎大鼠的肝脏炎症症状,对慢性肝炎具有治疗作用,该作用与狗蚁草药材主治慢性肝炎相一致。槲皮素的抗炎作用是其最核心最显著的药理作用之一[7]。本文以槲皮素为指标性成分,探索其含量测定方法,为进一步完善狗蚁草药材质量标准提供参考依据。
1 仪器与材料
1.1 仪器 高效液相色谱仪(美国Agilent公司);JN-52000DTS型超声波清洗仪(宁波江南仪器厂);FA2204B型电子天平(上海精密仪器仪表有限公司)。
1.2 材料 甲醇、乙腈、冰醋酸均为色谱纯,水为重蒸水(实验室自制),其他试剂均为分析纯。槲皮素对照品(批号:100081-201408,中国食品药品检定研究院);狗蚁草3批样品采自广西南宁市郊,经广西药用植物园蓝鸣生教授鉴定为豆科植物狗蚁草Alysicarpus vagnalis (Linn. ) DC。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取槲皮素对照品适量,置于10 mL容量瓶中,加适量甲醇,超声溶解,再加甲醇定容至刻度,摇匀,用微孔滤膜(0.45 μm)过滤,制成每1 mL含槲皮素1.25 g的对照品溶液(1.25 g/mL)。
2.1.2 供试品溶液 取狗蚁草根粗粉约10 g,精密称定,加10倍量70%乙醇回流提取2次,每次1 h,合并提取液,减压回收乙醇至无醇味,残渣用适量甲醇溶解,转移至25 mL容量瓶中,用甲醇定容至刻度,摇匀,用微孔滤膜(0.45 μm)过滤,即得供试品溶液。
2.2 含量测定
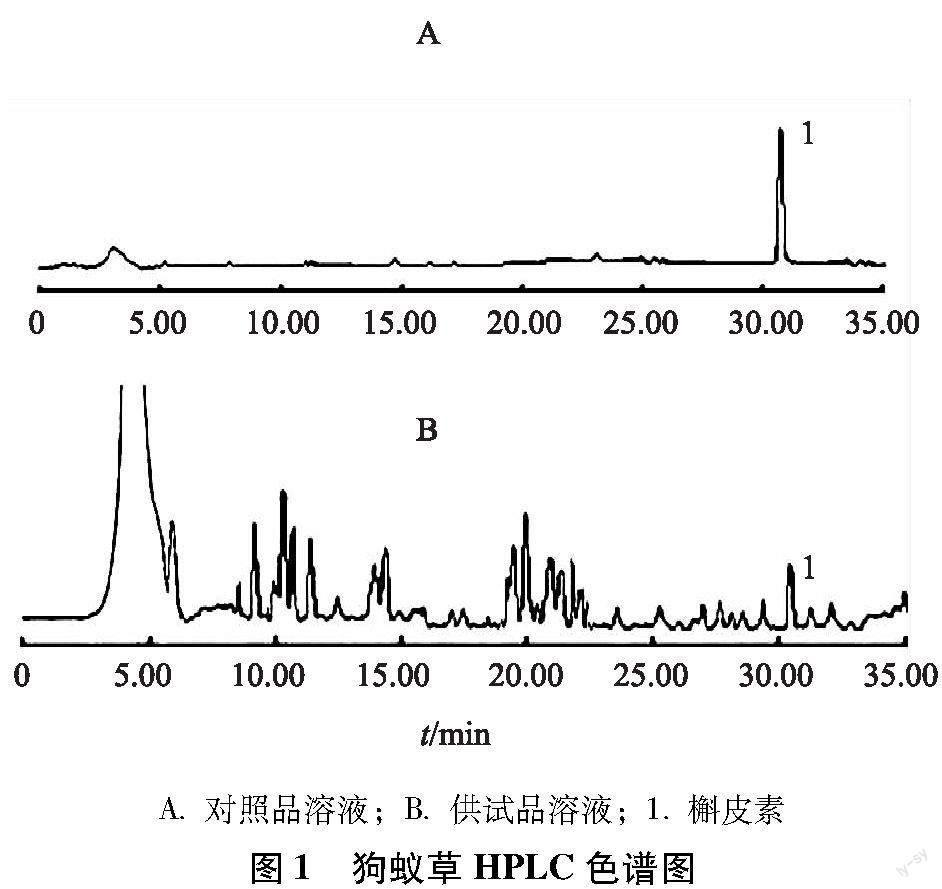
2.2.1 色谱条件 色谱柱:Prevail ODS-C18 (5 μm, 250 mm×4.6 mm);流动相:乙腈(A)-1%乙酸(B);梯度洗脱:0~15 min,5%A;15~20 min,15%A;20~30 min,25%A;30~40 min,65%A;检测波长:365 nm;流速:1.0 mL/min;柱温:30 ℃。在此条件下,分别精密吸取对照品溶液、供试品溶液各10 μL,注入高效液相色谱仪进行测定。色谱图如图1所示。
2.2.2 线性关系考察 依次精密吸取“2.1.1”项下对照品溶液0.1 mL、0.2 mL、0.4 mL、0.8 mL、1.0 mL,置10 mL容量瓶中,用甲醇定容至刻度,摇匀,用微孔滤膜(0.45 μm)过滤。分别吸取上述对照品溶液10 μL,按照“2.2.1”项下色谱条件进行测定,记录峰面积,以峰面积为纵坐标(Y),进样量为横坐标(X)制作标准曲线,得回归方程:Y=364866X+109.58(R2=0.9996),如图2所示,表明进样量在0.125~1.25 μg范围内线性关系良好。
2.2.3 精密度试验 精密吸取“2.1.1”项下的对照品溶液10 μL,按“2.2.1”项下色谱条件连续进样6次,测定峰面积。结果槲皮素峰面积的RSD值为1.72%(n=6),表明仪器精密度良好。
2.2.4 穩定性试验 取“2.1.2”项下的供试品溶液,分别于0、2 h、4 h、8 h、16 h、24 h按“2.2.1”项下色谱条件进样,记录峰面积。结果槲皮素峰面积的RSD值为0.94%(n=6),表明供试品溶液在24 h内稳定性良好。
2.2.5 重复性试验 取同一批南宁产狗蚁草药材6份,按照“2.1.2”项下的方法制备供试品溶液,按“2.2.1”项下色谱条件测定槲皮素含量。结果槲皮素含量的RSD值为1.12%(n=6),表明重复性良好。
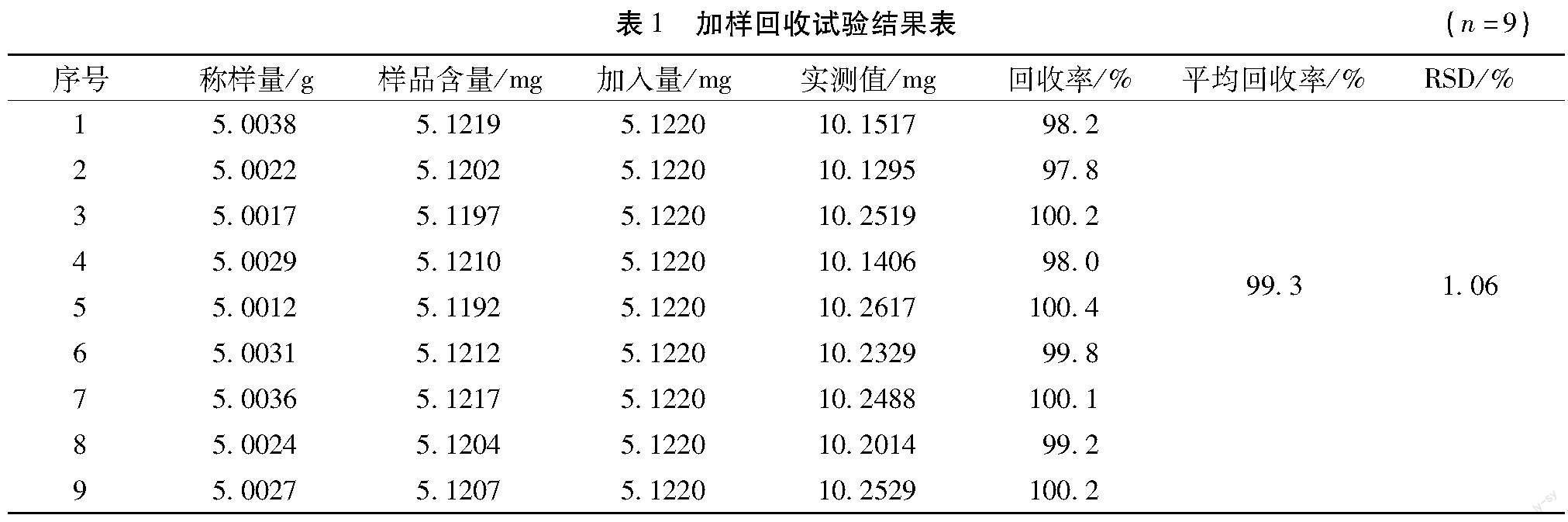
2.2.6 加样回收试验 取已知槲皮素含量(1.0236 mg/g)的同一批南宁产狗蚁草药材干品9份,每份约5 g,精密称定,分别按100%的水平加入槲皮素对照品,按照“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进行测定槲皮素的含量,计算回收率。回收率(%)=[实测值(mg)-样品含量(mg)]/对照品加入量(mg)×100%。结果平均回收率为99.3%,RSD值为1.06%(n=9),表明回收率良好。详见表1。
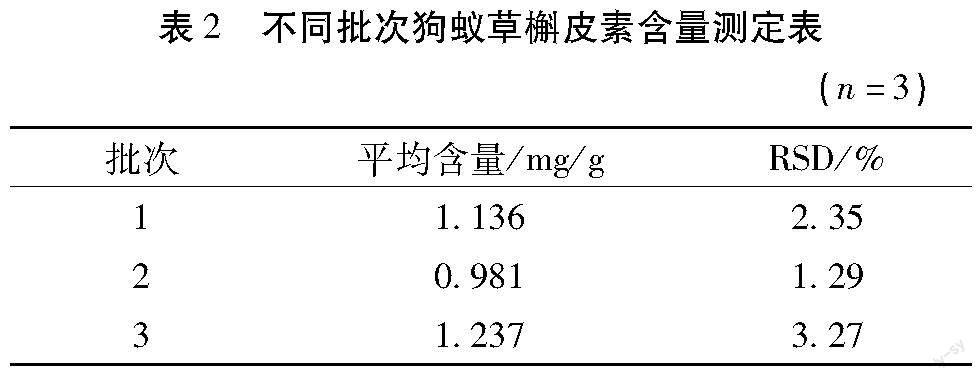
2.2.7 样品测定 取3批狗蚁草药材,每批3份。每份取约10 g,粉碎成粗粉(过40目筛),按照“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件分别进样,测定峰面积,计算样品中槲皮素的含量。结果见表2。
3 讨论
3.1 含量测定指标成分的选择 根据中药及其制剂分析中含量测定指标成分的选择原则,含量测定指标成分应确保药材及其制剂的有效性、安全性和专属性,研究首选有效成分作为含量测定指标成分[8]。以本研究[6]为例,槲皮素具有抗炎活性,是狗蚁草药材发挥治疗作用的有效成分,同时也是该药材主治功能的重要体现,故选择槲皮素作为含量测定指标成分。
3.2 流动相的选择 在参考文献[9-11]的基础上,对比分析了①甲苯-乙酸乙酯-甲酸(10∶[KG-*3/5]8∶[KG-*3/5]1)、②乙腈-0.4%磷酸溶液(30∶[KG-*3/5]70)、③甲醇-0.4%磷酸溶液(47∶[KG-*3/5]53)3种溶剂系统,最终确定乙腈-1%乙酸为流动相,进行梯度洗脱,槲皮素的分离度大于1.5,色谱图峰形较理想。
狗蚁草是广西壮族民间常用草药,其乙醇提取物具有抗肿瘤、抑菌、抗氧化等多种药理活性,具有较好的开发应用前景[12-14]。目前,狗蚁草化学成分研究较为欠缺,分离鉴定的化合物不足20个,且药理作用研究对象均为提取物,具体是何种成分在起作用尚未明确,还有待进一步研究。
参考文献
[1]谢宗万. 全国中草药汇编(下册)[M].北京:人民卫生出版社,1996: 766.
[2]国家中医药管理局《中华本草》编委会. 中华本草(第11卷) [M]. 上海: 上海科学技出版社,1999: 326.
[3]江苏省植物研究所,中国医学科学院药物研究所.新华本草纲要[M].上海:上海科学技术出版社,1988-1991: 423.
[4]刘洪蛟, 雷鸣, 胡艳丽, 等. HPLC 法测定链荚豆根中水杨酸的含量[J]. 沈阳药科大学学报, 2013, 30(5): 356-358.
[5]李慧宁, 刘洪蛟, 付小帅, 等. HPLC-ELSD 同时测定链荚豆中胡萝卜苷和β-谷甾醇含量[J]. 中国实验方剂学杂志, 2013, 19(1): 119-121.
[6]杨颖, 王芸芸, 蒋琦辰. 槲皮素药理作用的研究进展[J]. 特种经济动植物, 2020, 23(5): 24-28.
[7]DAVID A V A, ARULMOLI R, PARASURAMAN S. Overviews ofbiological importance of quercetin: A bioactive flavonoid[J]. Pharmacognosy reviews, 2016, 10(20): 84-89.
[8]胡娟, 吴志生, 黄美霞, 等. 中药复方制剂质量控制中含量测定指标的选择思路[J]. 福建中医学院学报, 2008, 18(3): 71-72.
[9]朱琳, 傅兴圣. HPLC法测定女萎药材中槲皮素的含量[J]. 海峡药学, 2018, 30(5): 63-65.
[10]吕彩莲. HPLC法测定蒙药材黄花铁线莲中槲皮素含量[J]. 海峡药学, 2020, 32(1): 85-87.
[11]蒋向辉, 杨永平, 谭荣. 高效液相色谱法灵香草中槲皮素含量[J]. 凯里学院学报, 2020, 38(3): 37-40.
[12]TAPADIYA G, KALE M A, SABOO S. Phytochemical characterization, anti-cancer and antimicrobialactivity of isolated fractions of Alysicarpus vaginalis[J]. Bangladesh J Pharmacol, 2017, 12(1): 77-83.
[13]ARYA P, MEHTA J P, KUMAR S. Evaluation of antibacterial and phytochemical analysis of root extracts of Alysicarpus vaginalis DC. Against Respiratory Tract Pathogens[J]. Environment Conservation Journal, 2016, 17(3): 145-151.
[14]ARYA P, MEHTA J P. Antioxidant Potential of Himalayan Medicinal Plants Angelica glauca, Alysicarpus vaginalis and Peristrophe bicalyculata[J]. Int.J.Curr.Microbiol. App.Sci , 2017, 6(7): 1892-1901.
