胃肠道间质瘤组织病理特征下沉默信息调节因子1的表达及其对预后的影响
2023-09-28吴慰霖郑晓梅周明先
吴慰霖, 郑晓梅, 周明先
(1黄山首康医院病理科, 安徽 黄山 245000; 2池州市人民医院病理科, 安徽 池州 247000)
沉默信息调节因子1(Silent information regulators-1,SIRT1)隶属于Sirtuins蛋白家族,具有去乙酰化酶活性,可参与基因调控、细胞凋亡、肿瘤发生过程[1]。SIRT1 在多种肠道疾病的发生、发展及转归中扮演着重要角色,如脓毒症肠损伤、肠缺血再灌注损伤、放射性肠损伤、肠道炎症性疾病等[2]。研究证实,在肿瘤中SIRT1的表达失调在肿瘤发生、发展中起到关键作用[3]。SIRT1 通过参与DNA损伤或氧化应激反应,调节癌细胞的增殖与凋亡生理过程,氧化应激条件下,SIRT1可以使细胞避免受到氧化应激依赖DNA诱导的病理损伤[4]。已有研究认为,SIRT1在胃癌组织及细胞中均呈现高表达,与胃癌患者年龄、肿瘤浸润深度、淋巴结转移等有关,在胃癌中可充当癌基因角色[5]。SIRT1在结直肠癌中阳性表达较高,与肿瘤直径有关[6]。胃肠道间质瘤(Gastrointestinal stromal tumors,GIST)是一种软组织肉瘤,好发于全消化道,临床表现为出血、疼痛或肠梗阻[7]。胃与小肠是好发最多的部位,也可发生于胃肠道以外、网膜或肠系膜[8]。经过治疗后GIST一般预后较好,但有高危因素者仍会复发[9]。 本研究探讨胃肠道间质瘤(Gastrointestinal stromal tumors,GIST)病理特征下沉默信息调节因子1(silent information regulator 1,SIRT1)的表达及其对预后的影响,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2016年1月-2017年12月黄山首康医院就诊并治疗的GIST患者资料,根据纳入标准与排除标准共筛选52例患者入组。纳入标准:在黄山首康医院院进行手术治疗或术后病理诊断为GIST;术前未接受其他手段治疗;临床资料及病理资料完整;无其他恶性肿瘤、内分泌系统等疾病。排除标准:发生在食管、腹腔等少见部位的间质瘤;不能配合研究及随访;患有精神及认知障碍性疾病;接受过化疗、放疗等其他全身性辅助治疗。所有患者根据2008年改良的美国国立卫生研究所(National institutes of health,NIH)共识标准[10]对GIST危险程度进行分级。极低危险性:肿瘤大小≤2 cm,核分裂象计数≤5个/50 HPF;低度危险性:肿瘤大小>2 cm且≤5 cm,核分裂象计数≤5个/50 HPF;中度危险性:肿瘤大小>5 cm且≤10 cm,核分裂象计数≤5个/50HPF;高度危险性:肿瘤大小>10 cm,核分裂象计数≥5个/50HPF。
1.2 方法
1.2.1 免疫组织化学染色 将手术中获得的肿瘤组织及肿瘤旁组织(距离原发灶>3 mm)制作成石蜡切片,常规脱蜡,将切片放在盒中,倒入3%过氧化氢,浸满切片,保持室温静置10 min,以灭活内源性酶。倒出过氧化氢,盒中倒入0.01M枸橼酸盐缓冲液,高压3 min,冷却20 min,以修复抗原。滴加5%BSA封闭液,室温下孵育10 min。滴加一抗SIRT1在4℃下过夜孵育,PBS洗涤2 min。滴加山羊抗兔IgG,保持37℃孵育30 min,PBS洗涤2 min。添加辣根过氧化物酶偶联的链霉卵白素,PBS洗涤5 min。添加DAB染色液,并使用苏木素进行复染。脱水、透明、封片,在显微镜下进行观察。
1.2.2 免疫组织化学染色结果判定 在肿瘤细胞核内出现棕黄色颗粒状染色为SIRT1染色阳性。细胞染色强度计分:无色,计0分;浅黄色,计1分;棕黄色,计2分;棕褐色,计3分。阳性细胞比例计分:无阳性细胞,计0分;阳性细胞<25%,计1分;阳性细胞25%~50%,计2分;阳性细胞50%~75%,计3分;阳性细胞>75%,计4分。染色强度计分与阳性细胞数比例计分相乘:阴性=0分,弱阳性=1~3分,中阳性=4~8分,强阳性=9~12分[11]。0分被认定为阴性,1分及以上被认定为阳性。
1.2.3 随访方式与时间 根据患者来院复诊情况进行随访,或电话随访询问患者情况,随访5年,至2022年12月结束记录患者生存状况与生存时间。

2 结果
2.1 GIST组织中SIRT1的表达免疫组化染色显示,SIRT1主要在细胞核中表达,癌旁组织中SIRT1蛋白阳性表达率为15.38%(8/52),癌组织中SIRT1蛋白阳性表达率为73.08%(38/52)。卡方检验分析显示癌组织与癌旁组织中SIRT1蛋白表达差异有统计学意义(χ2=35.08,P<0.001)。癌组织中阴性、弱阳性、中阳性和强阳性的例图见图1。

阳性
2.2 GIST患者不同临床病理特征下SIRT1的表达与SIRT1阴性组肿瘤直径比较,阳性组更大。SIRT1阳性组中核分裂象<5个/50HPF、Ki-67增殖指数<5%、极低危险性/低度危险性的患者占比显著少于阴性组,而≥5个/50HPF、Ki-67增殖指数≥5%、中度危险性/高度危险性患者占比显著多于阴性组(P均<0.05)。SIRT1与患者性别、年龄、BMI、吸烟史、饮酒史、肿瘤部位差异无统计学意义(P均>0.05)。见表1。

表1 GIST患者不同临床病理特征下SIRT1的表达/例(%)
2.3 生存分析5年随访结束时,共死亡15例,存活37例。SIRT1阴性表达患者存活14例,死亡1例,SIRT1阴性表达患者存活23例,死亡14例,SIRT1阴性表达患者存活率显著高于阳性表达患者(93.33% vs 62.12%)差异有统计学意义(P<0.05)。见图2。
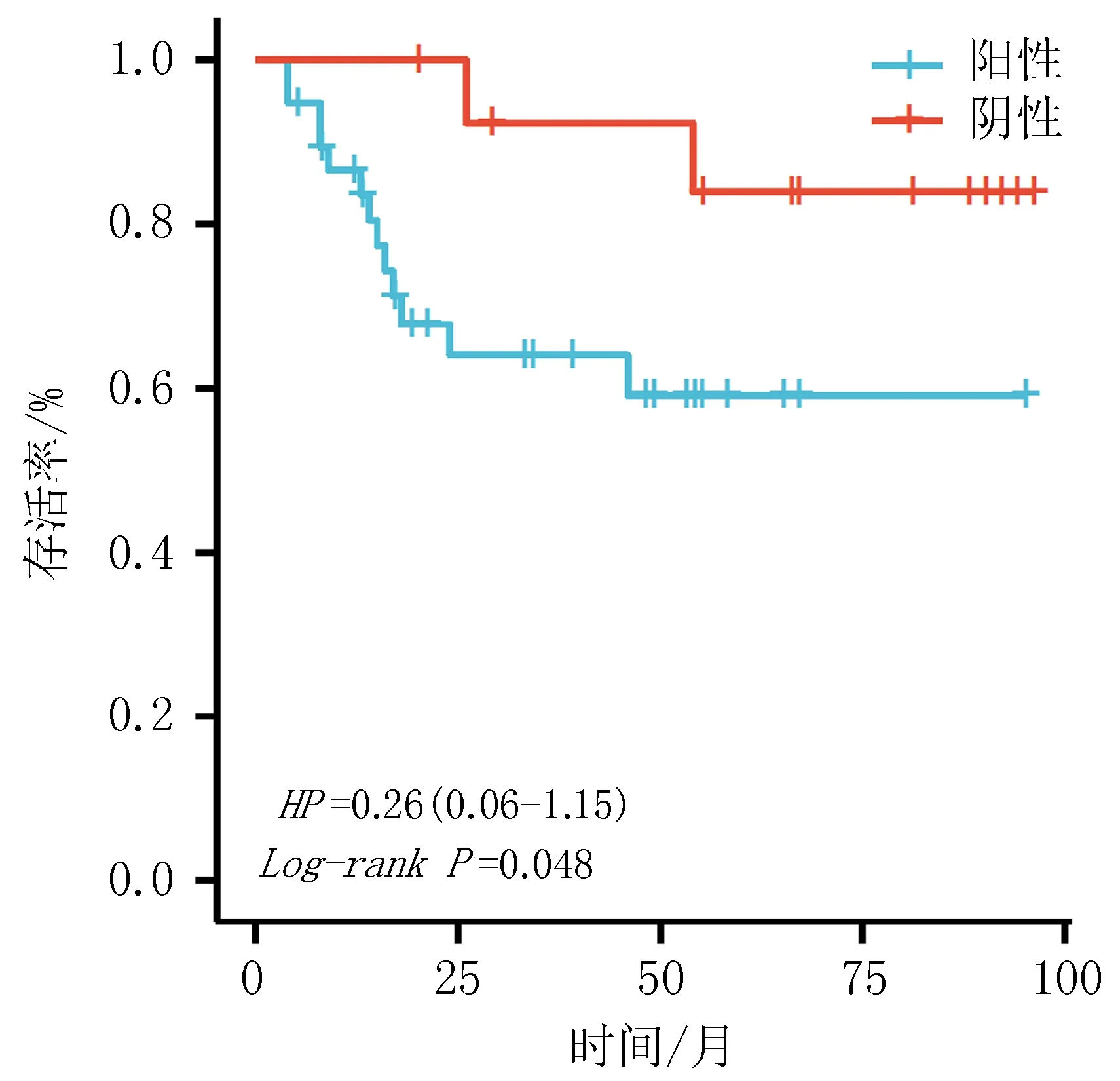
图2 SIRT1阴性表达组与阳性表达组患者的生存曲线分析
2.4 GIST患者预后的多因素分析将与SIRT1有关的临床病理特征(患者肿瘤直径、核分裂象、Ki-67增殖指数、危险程度)纳入Cox回归模型中进行多因素分析,模型分析结果显示SIRT1阳性表达、Ki-67增值指数≥5%、中/高危险程度是GIST患者预后不良的影响因素(P均<0.05),见表2。

表2 GIST患者预后的影响因素
3 讨论
SIRT1属于与沉默信息调节器2同源的亲属家族的沉默信息调节器2(SIR2)基因的同源物,在哺乳动物中,已经确定了7个sirtuins(SIRT1-7),Sirtuis可以在亚细胞区间穿梭,其中SIRT1是研究最多的sirtuin[12-13]。本研究显示SIRT1在GIST组织中的阳性表达率显著高于肿瘤旁组织,SIRT1阳性组肿瘤直径显著大于阴性组,且SIRT1与患者核分裂象、Ki-67增殖指数、危险程度均有关,说明在GIST中SIRT1可能作为促进因子发挥作用。SIRT1作为肿瘤抑制因子和肿瘤促进因子的意义尚不明确,该矛盾的形成主要因为细胞类型与SIRT1定位不同。一方面,SIRT1在各种肿瘤中表达水平升高,其控制细胞衰老和衰老的功能与肿瘤的发展有关,SIRT1可以激活癌基因,创造有利于肿瘤生存和进展的微环境。另一方面,越来越多的证据表明SIRT1的突变对肿瘤的发生具有一定的积极作用,包括基因组稳定性、炎症和肿瘤细胞凋亡[14-15]。SIRT1可能抑制癌症形成或促进癌症进展,这取决于细胞环境[13]。研究证实SIRT1在一些癌细胞中上调,如原发性结肠癌、前列腺癌、黑色素瘤和非黑色素瘤皮肤癌,肝细胞癌、乳腺癌中则发现其表达下调[16]。已有研究证明抑制SIRT1在癌细胞中的表达能降低食管癌细胞侵袭与增殖[17]。
本研究显示,SIRT1阳性表达患者存活率显著低于阴性表达患者,提示,SIRT1阳性表达可导致GIST患者预后不良。有研究证实,SIRT1在胃癌组织中的阳性率高于正常胃组织,SIRT1阳性的患者2年生存率较低,其是预后较差的独立危险因素[18];SIRT1与胃癌患者肿瘤复发转移也密切相关[19];SIRT1可能通过沉默抑癌基因促进贲门癌的形成[20]。
综上所述, GIST患者临床病理特征影响SIRT1的表达,且SIRT1阳性表达可导致GIST 患者预后不良。但是本研究还存在以下局限性和不足之处:首先,研究样本数量较小,需要进一步扩大样本量;其次,本研究是单中心研究,为了确保研究结果的可靠性,需要多中心进行复制验证;最后,本研究只侧重研究了SIRT1对GIST的影响,未对其他因素如GIST的特征和分子标志物进行研究,还有待进一步深入探究。
