肾上腺腺瘤与小直径肾上腺嗜铬细胞瘤鉴别诊断的临床-影像组学列线图模型的构建
2023-09-27朱嘉伟孙晓磊陈仁富
陈 锐,李 节,朱嘉伟,徐 鑫,孙晓磊,陈仁富
(1.徐州医科大学附属医院泌尿外科,江苏徐州 221002;2.徐州医科大学研究生院,江苏徐州 221002)
随着精准医疗在常规体检中的普及,如薄层计算机断层扫描(computer tomography,CT)、超声成像等检查,越来越多的肾上腺病例被发现[1]。肾上腺良性肿瘤的患者中,肾上腺腺瘤(adrenal adenoma,AA)的比例最高,其次是嗜铬细胞瘤(pheochromocytoma,PCC)[2],而腺瘤则多为皮质腺瘤或无功能腺瘤[3]。然而,良性肿瘤患者的临床症状大多是非特异性的,如何精准的鉴别诊断是一项重要的挑战。
CT扫描是诊断肾上腺肿物最常用的检查之一[3]。目前,腺瘤和PCC的鉴别常采用Hu的非增强衰减值。≤10 Hu的非增强衰减是腺瘤与非腺瘤的一个区分点[4]。然而,肾上腺良性肿瘤之间的鉴别诊断仍不理想,有研究发现约30%腺瘤的非增强衰减>10 Hu[5],增加了单纯依靠CT检查进行肿瘤性质诊断的错误率。此外,亚临床型PCC和乏脂腺瘤之间的影像特征和非特异性临床症状有一定的相似性,两者经常误诊[1]。如何提高肾上腺肿瘤的鉴别诊断率是近年来的研究热点。
影像组学可挖掘高维影像学特征,通过提供反映纹理、强度、异质性和形态学信息等丰富特征,对肿瘤表型进行分析[6],也可以反映肿瘤在细胞水平上的异质性。考虑到较大体积的PCC的影像学特征已明显区别于常规腺瘤,多数可通过视觉评估加以鉴别,因此,我们的研究重点是对较小直径的PCC和腺瘤加以鉴别,从CT图像中提取特征数据,并结合临床指标,开发和验证一种更可靠的列线图模型,以提高鉴别的准确性。
1 材料与方法
1.1 一般资料本研究回顾性分析140例2015年12月—2019年9月于徐州医科大学附属医院泌尿外科接受肾上腺肿瘤手术治疗的患者资料。根据术后病理报告将患者分为两组:嗜铬细胞瘤组(PCC组,50例)和肾上腺腺瘤组(AA组,90例)。所有患者行腹腔镜下肾上腺切除术(laparoscopic adrenalectomy,LA)。从病历系统中调取患者的基线资料包括:年龄、性别、身体质量指数(body mass index,BMI)、术前是否合并高血压[定义为收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg为高血压]以及相关实验室检查结果。从影像科调取患者CT影像信息。本研究经徐州医科大学附属医院伦理委员会批准,由于研究的回顾性质,伦理委员会放弃了知情同意的要求。
术前实验室值(静脉血样本)包括:①红细胞(red blood cell,RBC)、血清钾(K+)和血清钠(Na+)水平;②肌酐(creatinine,Cr)水平;③晨8时皮质醇(cortisol,Cor);④晨8时促肾上腺皮质激素(adreno-cortico-tropic-hormone,ACTH);⑤晨起静态条件下的醛固酮(aldosterone,ALD);⑥晨起静态状态下血浆肾素活性(plasma renin activity,PRA);⑦晨起静态条件下的血管紧张素Ⅰ (angiotension-Ⅰ,AⅠ);⑧晨起静态条件下的血管紧张素Ⅱ(angiotension-Ⅱ,AⅡ);⑨24 h尿香草扁桃酸(vanillylmandelic acid,VMA)。
CT图像的入选标准:①术前CT扫描包括强化期;②LA术后无明显并发症;③AA或PCC为最终病理结果。排除标准:①病灶平均无增强衰减≤10 Hu,且CT增强图像较少或没有增强;②最佳图像质量;③术前相关血液指标缺乏;④其他组织学类型;⑤肾上腺肿瘤伴出血。纳入研究的患者在CT检查前均未接受过任何治疗。
1.2 CT成像采集对检索的CT图像进行分析。增强CT是一个常规序列,每个患者的成像参数都包含这个序列。肾上腺肿块在增强图像上有高信号强度,可以更准确地识别肿块的形状并描绘肿瘤边缘。然后对目标病灶感兴趣的体积进行分割。使用公开的3D Slicer软件(4.10.2版本)进行图像分割和特征提取(图1)。提取的放射组学特征值以从0到1的线性方式归一化。整个肿瘤的提取由2位泌尿外科医师 (具有5年泌尿科放射学临床经验)手工分割。2位医师在处理影像数据前对所有患者的临床数据和组织病理学信息没有具体知晓。

图1 肾上腺肿瘤特征提取
1.3 影像学特征选择与特征分析影像学特征丰富多样,包含一阶直方图特征、二阶纹理特征、多尺度纹理特征、形状特征和深度特征。但并不是所有影像特征都是研究结果所需要,为了避免特征过拟合和加大错误的发生概率。我们使用了方差分析和最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)逻辑回归算法筛除与研究结果无关的影像特征,从而选取最有用的预测特征。利用所选特征构建影像组学特征,以影像组学特征评分的形式呈现。此外,对所有患者的不同组进行分层分析。
1.4 临床-影像组学列线图的建立放射组学特征评分和其他临床预测因子均使用单因素及多因素logistic回归算法进行测试,选取构建预测模型的显著预测因子。用所获得的独立预测因子来建立临床-放射学列线图模型。
1.5 列线图模型的应用与验证受试者工作特征(receiver operating characteristic,ROC) 曲线和曲线下面积(area under the curve,AUC)用于评价模型的诊断效能。模型间诊断效能评价采用Delong检验。决策分析曲线(decision curve analysis,DCA)用于评估预测模型的临床实用性。采用拔靴法(Bootstrap)在建模组中进行重复抽样(设定boot=1 000)从而实现内部验证,并绘制校准曲线。
2 结 果
2.1 患者的基线资料患者的基本特征详见表1。依据纳入及排除标准,在140例术后病理证实为肾上腺肿瘤的患者中,最终得到符合标准的AA患者(87例,排除3例),PCC患者(45例,排除5例)。所有患者中,除24 h尿VMA、AⅠ、PRA、ACTH (8 am)外,其余临床资料两组间无显著性差异。

表1 患者的临床资料 [M(P25,P75)]
2.2 影像组学特征构建与性能评估从每个患者的增强CT图像中共提取到108个放射组学特征,包含15个形状特征,18个一阶直方图特征,75个二阶纹理特征。首先应用方差分析,选择P<0.05的特征共36个,然后使用LASSO回归进行筛选,根据最佳λ值,最终筛选出一个潜在的预测因子,即为原始一阶中位数(ORIGINAL_FIRSTORDER_MEDIAN)。结果表明,提取的放射组学特征具有较好的重现性。PCC患者影像组学特征评分为82.0 (63.0,101.0),高于一般腺瘤患者51.0 (31.5,62.0),两者差异具有统计学意义(P<0.001)。
2.3 临床-放射学列线图的建立对相关临床因素以及潜在的影像组学预测因子进行logistic回归分析。结果显示,血清K+、AⅠ、PRA、24 h尿VMA、原始一阶中位数影像组学特征评分(ORIGINAL_FIRSTORDER_MEDIAN)是鉴别肾上腺PCC与腺瘤的潜在预测因子(P<0.05);而多因素logistic回归分析结果表明,AⅠ、PRA、24 h尿VMA、ORIGINAL_FIRSTORDER_MEDIAN为鉴别二者的独立预测因素(P<0.05,表2)。然后,联合AⅠ、PRA、24 h尿VMA、ORIGINAL_FIRSTORDER_MEDIAN,构建临床-影像组学列线图模型(图2)。

表2 132例肾上腺肿瘤患者单因素和多因素二分类logistic回归分析结果
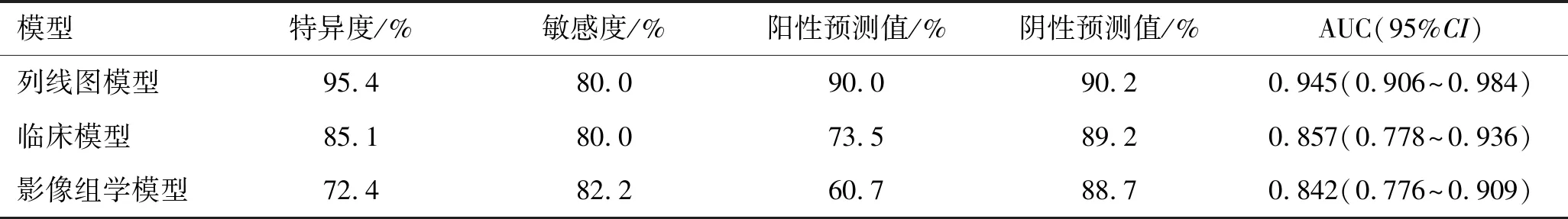
表3 三种模型诊断效能比较
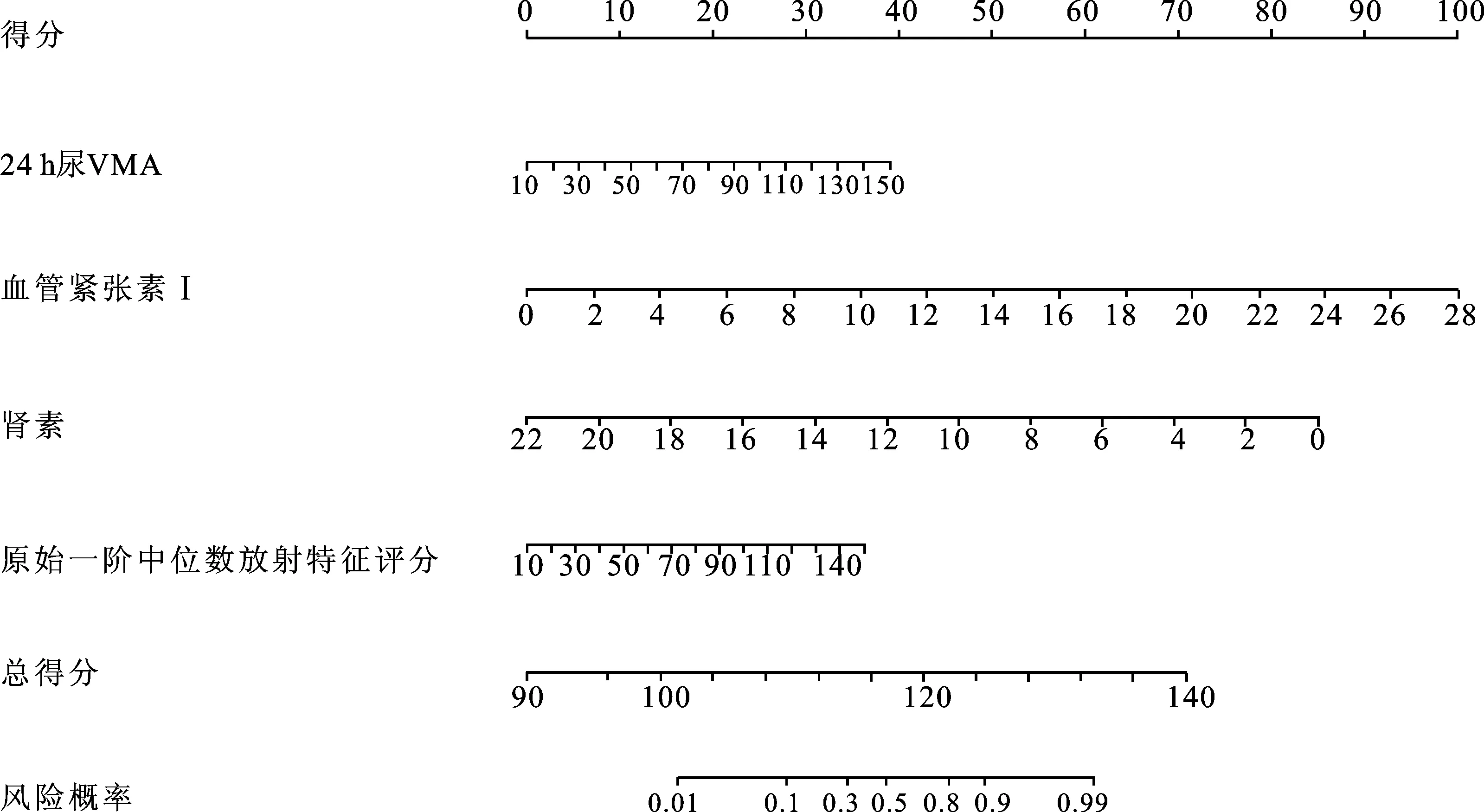
图2 放射学-临床列线图
列线图评分计算公式如下:列线图评分=79.644 3+0.278 9×24 h尿VMA+3.571 4×AⅠ-3.864 6×PRA+0.258 8×ORIGINAL_FIRSTORDER_MEDIAN。
2.4 三种模型的鉴别效能将独立临床预测因子(AI、PRA、24 h尿VMA)建立独立临床因素模型,独立影像组学特征评分建立独立影像组学模型,与临床-影像组学列线图模型进行比较。结果显示临床-影像组学列线图AUC为0.945(95%CI:0.906~0.984),均优于独立临床因素模型(AUC为0.857,95%CI:0.778~0.936)和独立影像组学模型(AUC为0.842,95%CI:0.776~0.909)(图3)。Delong检验显示,临床-影像组学列线图模型与独立临床模型(P=0.005)和独立影像组学模型(P=0.001)相比,差异均有统计学意义。而独立临床模型和独立影像组学模型间差异无统计学意义(P=0.798)。
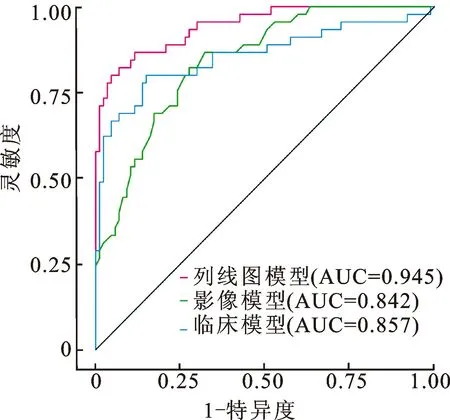
图3 三种模型ROC曲线比较
2.5 列线图模型的内部验证及临床应用采用拔靴法(Bootstrap)在建模组中进行重复抽样(设定boot=1 000)从而实现内部验证,并绘制校准曲线,结果显示模型的预测概率与实际概率具有良好的符合度(图4)。DCA曲线显示临床-影像组学列线图总体效益更高,优于独立影像组学特征模型和独立临床因素模型的诊断价值,可用于指导临床决策(图5)。

图4 列线图模型校准曲线

图5 三种模型临床决策曲线比较
3 讨 论
医学影像组学从医学图像中提取的高通量定量图像特征可为疾病的发现、诊断和预后评估提供准确可靠的工具。医学影像组学在改善临床决策方面的潜力是巨大的。传统的肿瘤医学图像评价很大程度上依赖有限的主观特征。观察到的指标包括肿瘤的大小、动脉或静脉增强期的表现、肿瘤边缘的侵犯程度、肿瘤中心的密度等,这些特征缺乏统一的标准。近年来,影像组学领域的研究越来越多,它不仅能区分肿瘤的性质[7],还能预测肿瘤分类[8]、肿瘤进展[9]、肿瘤转移及肿瘤相关基因突变[10]。
针对日益增多的肾上腺肿瘤患者,根据泌尿外科临床指南的建议可以为绝大多数患者建立合理有效的临床决策[11]。术前准确鉴别肾上腺肿瘤的性质不仅是决定手术治疗的必要因素,也是保证围手术期安全的重要环节。不同类型的肾上腺肿瘤需要不同的术前准备,特别是PCC[12],因其释放过量的儿茶酚胺,既可能在术前引起严重心肌病、高血压危象甚至心源性休克,也可在术中造成血流动力学不稳,威胁生命安全,或在术后出现严重并发症[13],影响患者预后。因此肾上腺PCC的围手术期处理尤为重要。近年来,术前α-阻断剂的应用,如非选择性α-阻断剂酚苄明和选择性α-阻断剂多沙唑嗪[13],PCC患者术后的死亡率明显下降[14-15]。
相关研究表明,从整体肾上腺肿瘤中提取的影像学特征可用于鉴别AA或PCC。YI等[16]研究了79例肾上腺乏脂腺瘤和29例亚临床型PCC患者的CT平扫图像,对提取的30个纹理特征进行多元logistic回归分析,最确定了4个纹理特征,使用每个纹理特征的回归系数来创建一个方程,并建立相关影像组学预测模型。其预测模型对鉴别诊断的准确率为94.4%(102/108),AUC(95%CI)为0.952(0.897~1.000),得出基于机器学习的CT平扫定量纹理分析可作为鉴别肾上腺肿瘤的可靠方法。我们的研究中结合增强CT的影像组学特征和潜在临床风险因素,开发并验证了临床-影像组学列线图模型,其AUC(95%CI)为0.945(0.906~0.984),优于单一影像模型和临床模型,为术前评估肾上腺肿瘤的性质提供了一种更准确和无创的工具。
本研究证明了基于机器学习的临床-影像组学列线图模型在术前鉴别诊断AA和小直径PCC中的准确性。该方法有助于泌尿外科临床医生提高对肿瘤性质的初步预测,以作出更好的临床治疗决策并提高围手术期的安全性。然而,本研究仍存在一定的局限性:①本研究为单中心回顾性研究,样本量相对较少,存在一定的选择偏倚,未选择独立的外部验证组;②手动勾画肿瘤区域,可能存在一定的误差;③临床风险因素中的24 h尿VMA、PRA、AⅠ可能会受到其他疾病的影响,存在一定的误差,进而影响研究结果;④本研究提取的放射学特征较少,无法从多个放射学特征中构建放射组学总评分,以进一步提高诊断的准确性,未来的研究中,我们将提取更多的放射学特征,更好的运用于临床决策。
综上所述,本研究通过提取AA和小直径PCC病灶的增强CT影像组学特征,结合临床风险因素构建预测模型,证实其对鉴别AA和小直径PCC有较高的诊断效能,具有较高的临床应用价值。
