苍耳子散治疗季节性变应性鼻炎的药理实验与作用机制研究变应性鼻炎
2023-09-25王宇婷李金飞徐文龙刘荟菁王嘉玺
王宇婷 李金飞 徐文龙 刘荟菁 王嘉玺
(1 北京中医药大学东方医院,北京,100078; 2 北京中医药大学东直门医院通州院区,北京,101100; 3 大兴区妇幼保健院,北京,102600)
季节性变应性鼻炎(Seasonal Allergic Rhinitis,SAR)是IgE介导的Ⅰ型变态反应,表现为季节性反复发作的鼻塞、喷嚏、流清涕等症状,为临床常见病。SAR发病率与空气中PM 2.5浓度正相关[1]。治疗方面,中医药在延缓发作频率和减少发作症状上有独特的优势[2]。
苍耳子散作为中医治疗SAR的传统经典名方,其作用机制值得深入挖掘与研究。中药复方的作用机制具有多靶点、多层次、范围广的优势。网络药理学是基于多学科理论基础,除医学、生物学外,包括计算机科学、生物信息学等,并整合多种研究手段而形成的研究方法[3]。应用网络药理学对中药复方作用机制进行研究,有助于揭示中药复方科学内涵、发现作用靶点、为实验验证中药复方治疗的靶点提供方向。
1 资料与方法
1.1 苍耳子散相关靶点基因筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)中,设置口服生物利用度(Oral Bioavailability,OB)≥30%、类药性(Drug Likeness,DL)≥0.18,对化合物在动物体内的毒药物动力学特征——吸收、分布、代谢和排泄(Absorption,Distribution,Metabolism and Excretion,ADME)进行初筛,查找4味中药活性成分[4]。为标准化蛋白质靶点信息,统一在UniProt数据库(https://www.uniprot.org)对化合物作用的蛋白质靶点进行规范。同时根据已发表的文献报告补充未预测到的活性化合物的已知靶点。
1.2 苍耳子散药物活性成分与靶点网络构建 应用Cytoscape 3.7.2图像化软件对生物活性成分及作用靶点进行相关网络构建,其中用“节点(Node)”表示苍耳子散药物组成、活性成分、作用靶点,用“边(Edge)”表示节点之间的关系[5]。同时应用相关插件进行网络特征分析,以明确苍耳子散中关键活性成分和作用靶点,最终目的为结合文献分析其中的相互作用。
1.3 SAR相关靶基因筛选 以“seasonal allergic rhinitis”“SAR”为关键词在人类基因信息数据库(GeneCards,http://www,genecards.org)中筛选SAR相关作用靶点。并根据经验设定Score大于中位数的目标靶点为SAR的潜在靶点。
1.4 苍耳子散活性成分-SAR靶点蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络构建 通过PPI数据的构建与挖掘,建立靶点的直接、间接调控作用关系网络,从而更清晰地呈现药物活性成分与靶点间的结合形式及重要节点的挖掘。
为探究苍耳子散组方相关靶点与SAR靶点间的相互作用,首先应用CytoScape 3.7.2中Bisogenet插件分别对2组靶点进行PPI网络构建,将生物种类设定为“Homo sapiens”,身份识别导出类型设定为“gene identifiers only”,其余设置均为默认设置,得到PPI网络之后应用merge工具对2组PPI进行融合构建PPI网络。通过网络拓扑分析插件CytoNCA并结合相关文献,连接度中心性(Degree Centrality,DC)、介度中心性(Betweenness Centrality,BC)、紧密中心性(Closeness Centrality,CC)、网络中心性(Network Centrality,NC)和局部边连通性(Localaverage Connectivity,LAC)等指标进行筛选,其中DC值大于所有节点DC值中位数2倍的节点为网络中的重要节点(Hubnodes)。再筛选其他几个指标中大于中位数的节点,即关键靶点。将关键靶点提交至STRING 11.0数据库(https://string-db.org)构建PPI网络模型,分析其参与的生物过程,并对其功能进行描述[6]。
1.5 相关靶点生物学功能与信号通路的富集分析 将苍耳子散活性成分靶点与SAR靶点取交集,并通过R语言绘制韦恩图,得到共同靶点19个。应用可视化和富集分子功能(Database for Annotation,Visualization and Integrated Discovery,DAVID)数据库(https://david.ncifcrf.gov)进行基因本体(Gene Ontology,GO)富集分析,功能注释聚类以及BioCarta和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路映射[7]。将19个靶基因输入列表,标识选择“official-Gene-symbol”进行分析,得到数据结果并进行可视化处理。
1.6 苍耳子散活性成分-SAR靶点-信号通路网络图构建 运用CytoScape 3.7.2构建苍耳子散活性成分-SAR靶点-信号通路网络图,利用CytoNCA分析活性成分及靶点的网络拓扑参数,包括DC、CC、NC等进一步分析得到核心靶点及主要活性成分。
1.7 动物实验验证
1.7.1 动物 无特定病原体(Specific Pathogen Free,SPF)级SD大鼠60只,雄性,12周龄,体质量200~220 g,购自北京维通利华实验动物科技有限公司,许可证号:SCXK(京)2016-0006,饲养于北京中医药大学东方医院实验动物中心屏障动物饲养室。饲养环境:大鼠按照组别分笼饲养,房间内每隔12 h进行明暗交替,室内温度保持在18~22 ℃,相对湿度40%~60%,自由饮水和进食。适应性饲养7 d。本研究通过伦理委员会审批(伦理审批号:JDF-IRB-2021031302)。
1.7.2 药物 苍耳子散颗粒剂组成:苍耳子9 g、辛夷9 g、白芷15 g、薄荷3 g。购自北京康仁堂药业有限公司并提供质量控制检测,使用前采用沸水溶开至浓度1 g/mL,以便后续灌胃使用。
1.7.3 试剂与仪器 IgE酶联免疫吸附试验(Enzyme Linked Immunosorbent Assay,ELISA)试剂盒(上海抚生实业有限公司,货号:A098542);白细胞介素-4(Interleukin-4,IL-4)ELISA试剂盒(武汉菲恩生物科技有限公司,货号:RF2481);γ干扰素(Interferon-Gamma,IFN-γ)ELISA试剂盒(上海联祖生物科技有限公司,货号:LZ-E030771);前列腺素内过氧化物合酶(Prostaglandin-endoperoxide Synthase,PTGS)2 ELISA试剂盒(上海沪震生物科技有限公司,货号:HZ-1014);PTGS1 ELISA试剂盒(上海优科唯生物科技有限公司,货号:YKW-11129);蛋白激酶B(Protein Kinase B,AKT)1 ELISA试剂盒(博尔森科技有限公司,货号:YKW-11129);氢氧化铝(上海麦克林生化科技有限公司,货号:C10115726)。低温离心机(安徽科大中佳,型号:LC-4016);酶标仪(赛默飞世尔科技公司,型号:Thermo Scientific);恒温水浴锅(常州朗越仪器制造有限公司,型号:SYG-6);电子天平(常州奥豪斯仪器有限公司,型号:AX324ZH)。
1.7.4 方法
1.7.4.1 分组与模型制备 分组:正常对照组、模型对照组及苍耳子散组,每组20只。模型制备:按文献[8]造模方法制备变应性鼻炎AR大鼠模型,共40只。基础致敏阶段:以150 mg卵清蛋白(Ovalbumin,OVA)作为抗原,15 g氢氧化铝粉末作为佐剂,混悬于50 mL 0.9%氯化钠溶液中,作为致敏剂。采用腹腔注射法,每只大鼠1 mL,隔日1次,共进行7次基础致敏,用时14 d。正常对照组大鼠腹腔注射等容积的生理盐水。局部刺激阶段:第15~21天,采用滴鼻法,以2% OVA生理盐水溶液滴入大鼠两侧鼻孔,每侧50 μL,1次/d,正常对照组大鼠以等容积的生理盐水进行滴鼻。大鼠鼻部行为学症状总评分大于5分为变应性鼻炎模型制备成功。
1.7.4.2 给药方法 苍耳子散组给予苍耳子散颗粒3 mg/kg灌胃,模型对照组和正常对照组大鼠灌胃给予等容积的生理盐水。2次/d,共灌胃14 d。
1.7.4.3 检测指标与方法 末次给药1 h后,用10%水合氯醛麻醉,腹主动脉取血5~10 mL,在离心管中静置2 h后,于3 000 r/min离心机中离心10 min,离心半径为10.06 cm,收集血清,于-20 ℃冰箱中储存备用。检测前取出,室温环境下放置1 h后按照ELISA试剂盒说明书要求进行处理,检测大鼠血清中IgE、IL-4、IFN-γ、PTGS2、PTGS1、AKT1 mRNA含量。

2 结果
2.1 苍耳子散组方活性成分初步筛选 共提取苍耳子化学成分111个、辛夷化学成分184个、白芷化学成分223个、薄荷化学成分164个,对ADME特征筛选后共获得苍耳子活性成分11个、辛夷活性成分19个、白芷活性成分22个、薄荷活性成分10个。见表1。苍耳子作用靶点42个、辛夷作用靶点31个、白芷作用靶点40个、薄荷作用靶点68个,合并后删除重复值共得到靶点108个。
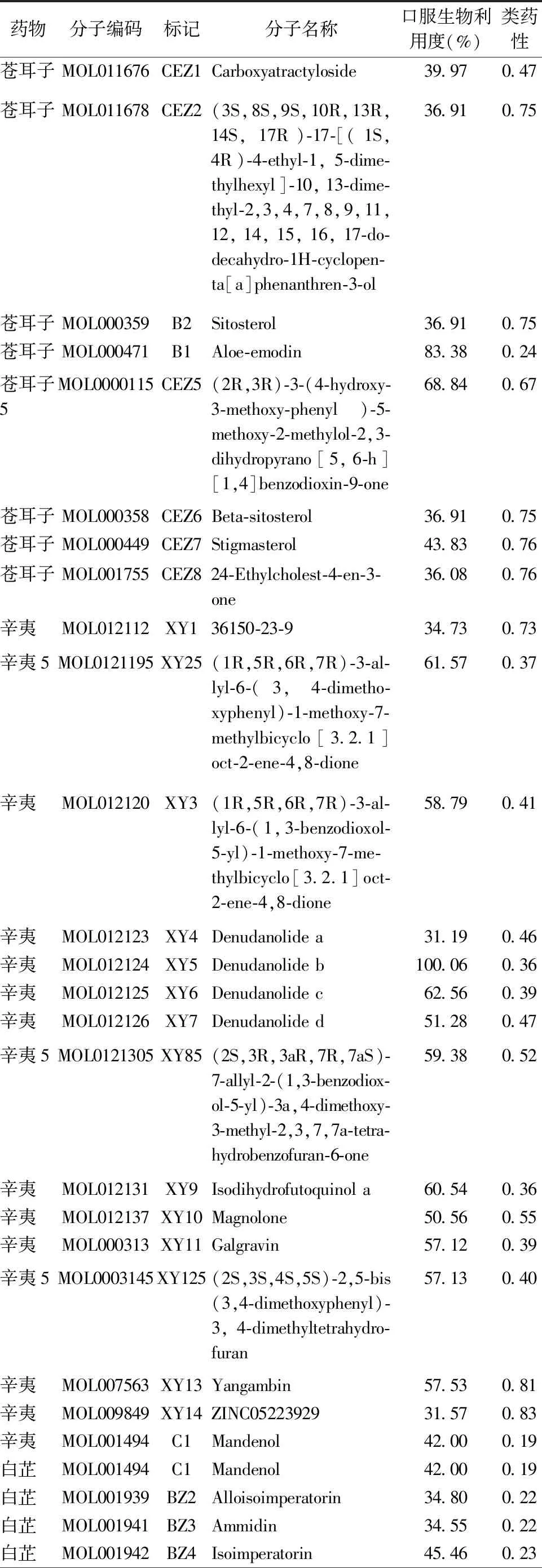
表1 苍耳子散活性成分
2.2 苍耳子散治疗相关靶点预测与活性成分-靶点网络构建 利用网络图形化工具Cytoscape 3.7.2对上述生物活性成分及预测的作用靶点进行关系网络绘制和分析,得出节点共159个,边共473条。通过网络拓扑分析确定苍耳子散发挥作用的生物活性成分主要为尼迪林(Cnidilin)、异二氢呋喃醌a(Isodihydrofutoquinol a)、加尔格雷芬(Galgravin)、木犀草素(luteolin)、腺苷醇c(Denudanolide c)、谷甾醇(Sitosterol)等,主要作用靶点为PTGS2、HSP90AB1、NCOA2、PTGS1、SCN5A、PIK3CG、DPP4、RXRA、CHRM1、AR、KCNH2、ESR1、GABRA1、β2-肾上腺素受体(Beta2-adrenergic Receptor,ADRB2)、PGR等。见图1。
2.3 SAR相关靶点筛选 从GeneCards数据库获得SAR靶点628个。根据经验设定Relevance大于中位数3.73的目标靶点为SAR的潜在靶点,最终得到320个SAR相关关键基因。
2.4 构建苍耳子散治疗SAR的PPI网络及获取核心靶点 对药物靶点进行PPI网络构建得到5 055个节点,126 097条边,对疾病靶点进行PPI网络构建得到6 183个节点,142 213条边。将结果应用merge工具进行融合构建PPI网络,得到3 536个节点、97 200条边的融合网络(Merge Network)。通过网络拓扑分析插件CytoNCA分析得到结果,设定Degree值>2倍中位数,筛选得到核心网络。通过设定网络中DC、BC、CC、LAC及NC>中位数的节点得到核心作用靶点。见图2。核心靶点输入STRING 11.0数据库中再进行PPI网络构建,分析其参与的生物过程并进行基因本体(Gene Ontology,GO)功能描述。见表2。

表2 苍耳子散-SAR靶点PPI网络功能描述
2.5 相关靶点生物学功能与信号通路的富集分析 首先将苍耳子散活性成分靶点与SAR靶点取交集,得到共同靶点19个。见图3。应用DAVID数据库进行基因注释富集分析,功能注释聚类以及BioCarta&KEGG通路映射。结果可见多个靶点的功能与炎症介质及氧化应激有关。其中苍耳子散治疗SAR主要参与的生物过程包括基因表达的负调控(Negative Regulation of Gene Expression)、对缺氧的反应(Response to Hypoxia)、内皮细胞增殖的正调控(Positive Regulation of Endothelial Cell Proliferation)、
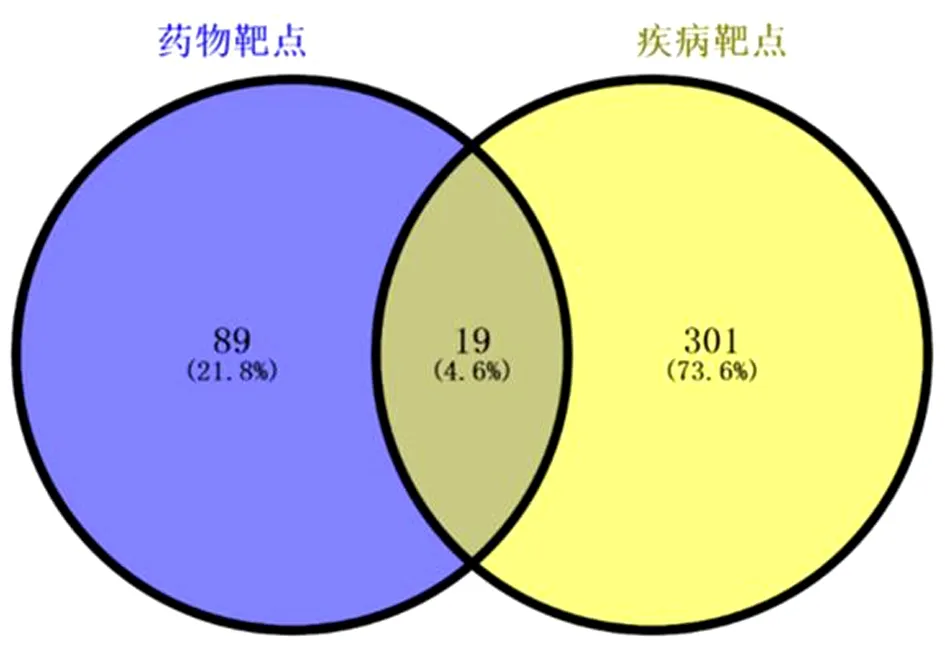
图3 苍耳子散成分-SAR靶点韦恩图
胞外信号调节激酶(Extracellular Signal-Regulated Kinase,Erk)1和Erk2级联的负调控(Negative Regulation of Erk1 and Erk2 Cascade)、肿瘤坏死因子产生的负调控(Negative Regulation of Tumor Necrosis Factor Production)、前列腺素的生物合成过程(Prosta-glandin Biosynthetic Process)、炎症反应(Inflammatory Response)等。相关靶点调节Sar的功能主要富集于血红素结合(Heme Binding)、前列腺素-内过氧化物合酶活性(Ptgs Activity)、双加氧酶活性(Dioxygenase Activity)、一氧化氮合酶调节剂的活性(Nitric-oxide Synthase Regulator Activity)、过氧化物酶活性(Peroxidase Activity)等。
参与的信号通路包括钙信号通路、缺氧诱导因子-1(Hypoxia-inducible Factor-1,HIF-1)信号通路、Toll样受体信号通路、AMP活化蛋白激酶(AMP-activated Protein Kinase,AMPK)信号通路、肿瘤坏死因子(Tumor Necrosis Factor,TNF)信号通路、血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)信号通路、叉头盒O(Forkhead Box O,FoxO)信号通路等。见表3,图4~5。
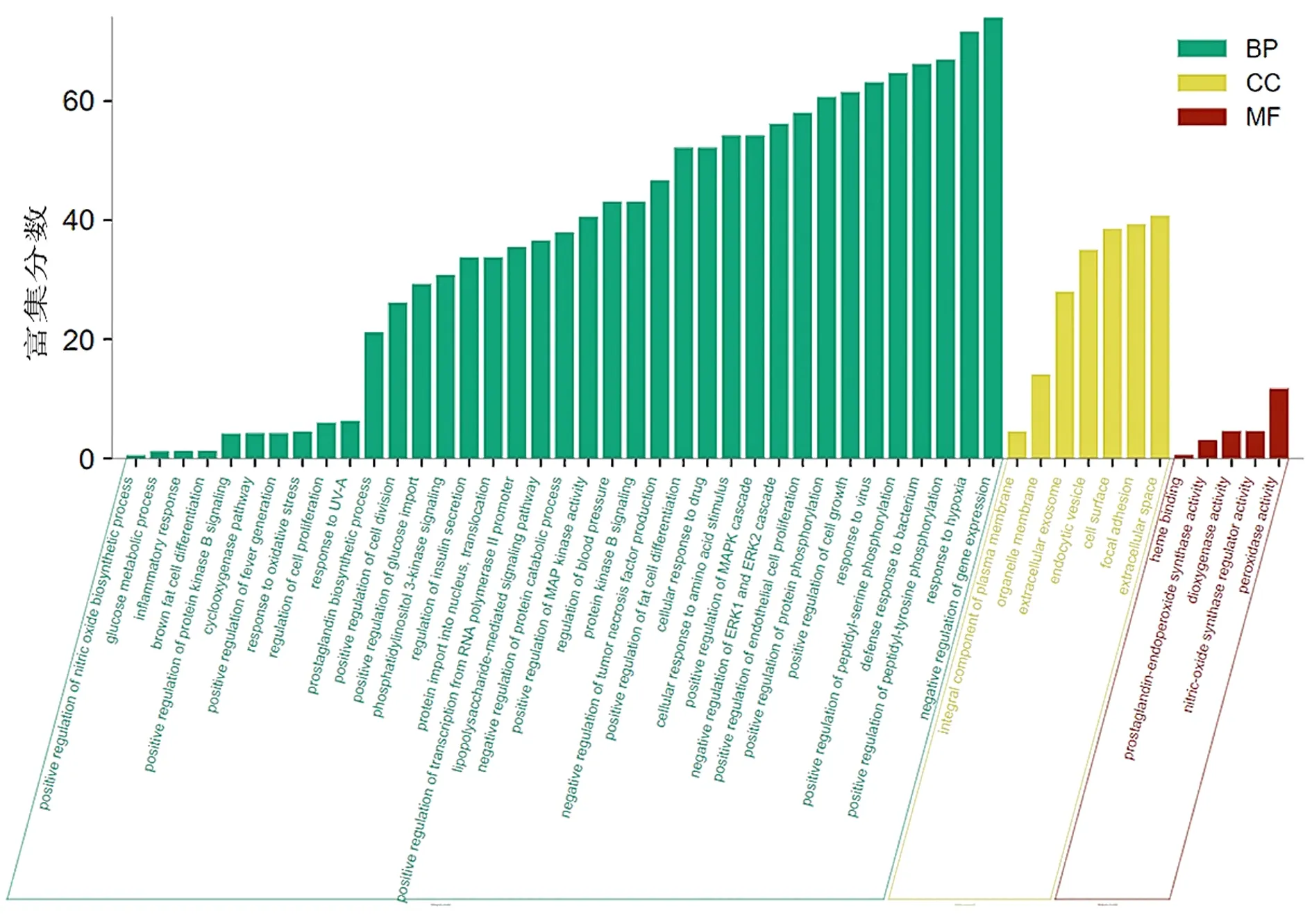
图4 苍耳子散治疗SAR靶点的GO分析
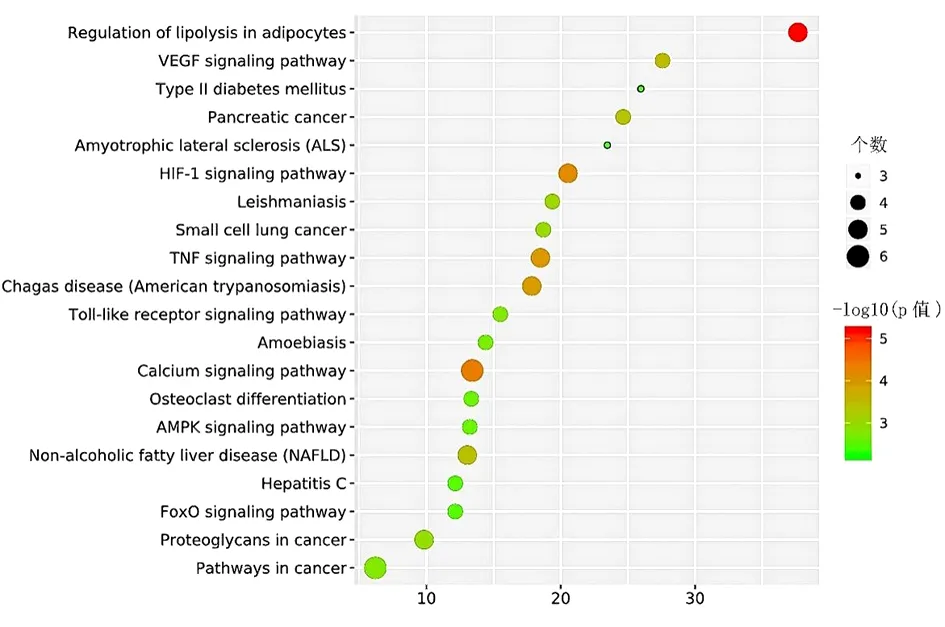
图5 苍耳子散治疗SAR靶点的KEEG分析

表3 苍耳子散治疗SAR靶点通路富集结果
2.6 苍耳子散活性成分-SAR靶点-信号通路网络图构建 运用CytoScape 3.7.2构建苍耳子散活性成分-SAR靶点-关键信号通路网络图。见图6。应用CytoScape 3.7.2内置的Network Analyzer插件分析网络拓扑学参数,得到核心的活性成分及核心作用靶点。结果提示前5位活性成分如下:柚皮苷、谷甾醇、木犀草素、阿沙西汀及芦荟大黄素,活性成分相关的DC、BC及CC。见表4。
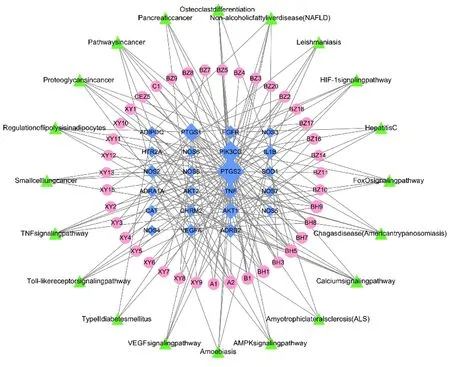
图6 苍耳子散成分-靶点-通路网络
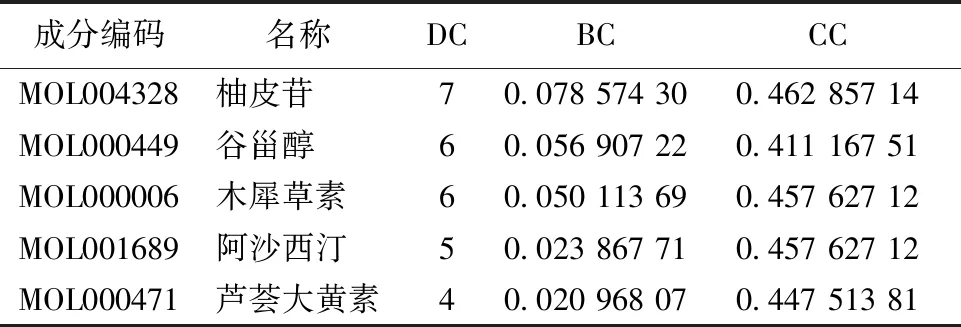
表4 苍耳子散主要活性成分网络节点特征参数
PTGS2在网络中的DC为44,BC为0.615 271 67,CC为0.609 022 56,预测PTGS2为苍耳子散治疗变应性鼻炎SAR最主要靶点。PIK3CG、PTGS1、AKT1、TNF、ADRB2、表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)、IL1β亦为相对重要的靶点。见表5。
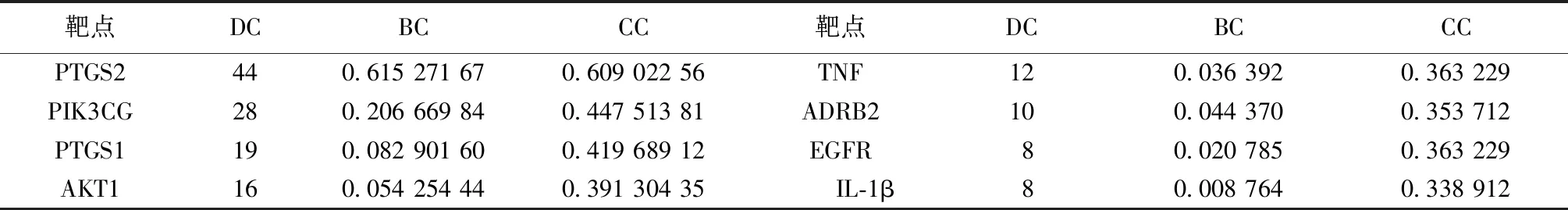
表5 苍耳子主要活性成分靶点网络节点特征参数
2.7 苍耳子散对大鼠血清中IgE、IL-4、IFN-γ、PTGS2、PTGS1、AKT1 mRNA表达量的影响 模型对照组大鼠血清中IL-4、IgE、PTGS2、PTGS1、AKT1的含量明显高于正常对照组,差异有统计学意义(P<0.01),苍耳子散组大鼠血清中IL-4、IgE、PTGS2、PTGS1、AKT1水平均明显低于模型对照组,差异有统计学意义(P<0.01);与正常对照组比较,模型对照组大鼠血清中IFN-γ含量明显降低,差异有统计学意义(P<0.01),苍耳子散组大鼠血清中IFN-γ较模型对照组升高,差异有统计学意义(P<0.05)。见表6。
表6 各组大鼠血清中IgE、IL-4、IFN-γ、PTGS2、PTGS1、AKT1 mRNA的表达比较
3 讨论
SAR属于中医学“鼻鼽”范畴,是临床常见病,如治疗不及时可出现鼻息肉及哮喘等疾病。中药复方在预防及治疗季节性发作方面有独特优势,尤其在改善鼻塞、流涕等症状方面拥有极大潜力。孙珊等[9]通过干祖望脱敏汤合苍耳子散治疗AR临床观察中发现纯中医组、纯西医组、中西医结合组均为治疗AR有效方法,中西医结合组远期疗效更优,证属风邪所致者均可本方加减治疗。牛银花和侯红枝[10]通过玉屏风合苍耳子散治疗持续性肺气虚型AR发现,玉屏风和苍耳子散能够调节患者体内Th1/Th2细胞因子失衡状态,缓解患者鼻黏膜炎症反应,从而改善患者症状表现。王龙妹等[11]发现,苍耳子水煎液对细胞免疫作用明显。另外,在AR豚鼠模型研究中发现,苍耳子水提取物可以改善AR豚鼠的过敏性症状,同时减轻AR豚鼠鼻黏膜的病理改变,降低血清中IL-4水平,升高IFN-γ的水平,从而调节Th1/Th2细胞因子平衡,降低血清IgE水平,发挥疗效[12]。
在临床研究中发现肺气失宣为鼻鼽主要病机,《诸病源候论·鼻病诸侯》载:“肺气通于鼻,其脏有冷,冷随气入乘于鼻,故使津涕不能自收。”故中医认为鼻鼽多因体虚卫表不固,风寒乘虚而入,上犯鼻窍,肺气失宣,津液内停,鼻窍壅塞,遂致鼻塞、喷嚏、流清涕[13]。另有研究认为本病多分为以下4个证型:肺气虚寒,卫表不固;脾气虚弱,清阳不升;肾阳不足,温煦失职;肺经伏热,上犯鼻窍[14]。其中以肺气虚寒为常见证型,治疗原则以温肺散寒、疏风通窍为主。苍耳子散出自《严氏济生方》,为治疗鼻科疾病的经典方剂,文中所述:“辛夷仁半两,苍耳子两钱半,香白芷一两,薄荷叶半钱,上晒干,为细末,每服两钱,食后用葱、茶清调下。”现代则多以汤剂葱茶调服。方中苍耳子、辛夷发散风寒,通鼻窍,苍耳子兼祛风湿;白芷祛风、燥湿、消肿、止痛。薄荷性味辛凉,疏散风热,清利头目,防止辛温药助阳太过。组方主治肺气虚寒证的鼻鼽患者,亦可配伍健脾益肾,或清热凉血药治疗其他证型的患者,发挥其疏风通窍的功效。
本研究应用网络药理学的方法对苍耳子散治疗SAR的关键活性成分进行分析,提示主要活性成分为柚皮苷、谷甾醇、木犀草素等。AR相关实验基础研究表明,柚皮苷腹腔注射能显著抑制OVA致敏模型小鼠的气道高反应性和气道重塑,抑制支气管肺泡灌洗液(Bronchoalveolar Lavage Fluid,BALF)中IL-4、IL-13水平升高及核因子κB(Nuclear Factor-κB,NF-κB)的活化[15]。谷甾醇是一种天然植物,具有抗炎活性,能够显著抑制TNF-α、IL-6、IL-1β、诱导型一氧化氮合酶(Inducible Nitric Oxide Synthase,iNOS)和环氧合酶-2(Cyclooxygenase-2,COX-2)等炎症介质的表达,并下调抗炎细胞因子(IL-10)的表达。同时抑制p-IκB-α激活和p38促分裂原活化的蛋白激酶(Mitogenactivated Protein Kinase,MAPK)的表达[16]。在细胞实验研究中发现木犀草素通过MAPK和NF-κB信号通路抑制IL-33刺激的肥大细胞中IL-31的产生,抑制炎症反应相关通路MAPK和NF-κB的活化[17]。
本研究结果表明,苍耳子散治疗SAR的靶点主要集中在PTGS2,而PIK3CG、PTGS1、AKT1、TNF、ADRB2、EGFR、IL1β亦为重要的调节靶点。PTGS是生物活性脂类调节物包括前列腺素、血栓烷和前列环素等各家族的前体。PTGS1和PTGS2都是膜整合蛋白。人PTGS2基因则被定位于1q25.2~25.3,约为8.3 kb大小,包含10个外显子和9个内含子,且外显子10显著大于外显子1~9,包含410 bp编码区和全长为2 550 bp的3′非翻译区。前列腺素E2(Prostaglandin E2,PGE2)的形成高度依赖于这些细胞中PTGS2的表达。TNF-α通过TNF通路能够诱导PTGS2的产生,其作用机制为TNF-α增加了PTGS2基因的转录。另一方面,IL-4抑制PTGS2 mRNA和蛋白质的表达,以及类前列腺素的产生[18]。通过对药物和疾病融合后的关键网络进行GO功能富集分析显示,苍耳子散能够通过调控mRNA代谢过程、调控基因表达、核酸代谢过程、含核碱基的化合物代谢过程对SAR发挥作用。在对相关通路富集分析研究中发现苍耳子散调治SAR中,重要的通路包括钙信号通、HIF-1信号通路、Toll样受体信号通路、AMPK信号通路、TNF信号通路、VEGF信号通路、FoxO信号通路等。HIF-1α直接介导iNOS和VEGF的转录,从而诱导血管通透性和炎症反应,抑制HIF-1α改善了气道中的过敏表型[19-20]。此外,HIF-1α抑制后,气道高反应性显著降低[21]。Toll样受体信号通路与AR的研究亦发现,引起AR的Toll样受体TLR(Toll-like Receptor,TLR)主要为TLR2、TLR4及TLR9,NF-κB是TLRs下游信号转导通路,NF-κB以p50和p65组成的二聚体形式发挥作用,激活核内相关转录过程,使炎症反应细胞因子表达增多,促进大量炎症反应,同时诱导Th2表达细胞因子,导致Th1及Th2细胞因子失衡发生AR。另外,我们通过VOA大鼠AR模型进行靶点验证,研究发现苍耳子散可调节AR相关介质IgE、IL-4、IFN-γ的表达,且苍耳子散治疗后PTGS2、PTGS1、AKT1药物靶点的mRNA表达较模型对照组均有显著差异。
研究结果表明苍耳子散中各活性成分可对不同靶点进行调控,而各个关键靶点又可介导不同的生物过程与信号通路,其与中医药治疗疾病多靶点、多途径的作用特点不谋而合。在应用网络药理学分析中,我们初步探究了苍耳子散治疗SAR的调节网络,为临床运用提供了一定依据。本研究的不足之处在于应通过实验进一步验证相关指标和靶点,为疗效评价提供指标,尽早服务于临床。
利益冲突声明:无。
