清肠温中方对溃疡性结肠炎小鼠NLRP6/IL-18/MUC2轴及肠道黏液屏障的影响
2023-09-25张阳李军祥胡俊聪张黎明王佳丽韩啸姜慧章晓思王木源石磊
张阳 ,李军祥 ,胡俊聪 ,张黎明 ,王佳丽 ,韩啸 ,姜慧 ,章晓思 ,王木源 ,石磊
1.北京中医药大学,北京 100029; 2.北京中医药大学东方医院,北京 100078
溃疡性结肠炎(ulcerative colitis,UC)是发生在结直肠的原因不明的非特异性炎症性疾病[1]。UC多发于中青年,腹泻、黏液脓血便及腹痛等症状严重影响患者生活质量。UC难治愈、易复发,缓解症状和减少复发是目前治疗关键[2]。
UC发病机制尚未完全阐明,目前主要认为是在遗传、环境或肠道微生物等因素作用下,肠屏障遭到破坏,从而发生过激的免疫炎症反应[3],肠屏障损伤是此过程的关键环节[4]。黏液屏障结构性减弱是UC发病的更早期事件,修复黏液屏障可能是治疗UC的新方向[5]。结肠组织杯状细胞分泌的黏蛋白2(MUC2)是黏液屏障的功能基础[6],白细胞介素(IL)-18高表达会加剧黏液屏障损伤[7],表达于肠上皮的核苷酸结合寡聚化结构域样受体蛋白(NLRP)6能够通过调节IL-18产生维持肠道内环境稳态[8-9]。因此,NLRP6/IL-18/MUC2轴可能是影响UC肠道黏液屏障的关键。
中医药在缓解UC症状、促进黏膜愈合等方面具有较明显的优势[10]。课题组李军祥教授总结多年临床经验创立清肠温中方。前期临床研究发现,该方能有效改善UC患者症状,降低改良梅奥(Mayo)评分[11],还能增加UC患者结肠杯状细胞数量及MUC2表达,修复肠屏障损伤[12]。本研究观察清肠温中方对UC小鼠NLRP6/IL-18/MUC2轴及肠道黏液屏障的影响,深入探索其治疗UC的作用机制。
1 材料与方法
1.1 动物
SPF级雄性C57BL/6小鼠24只,体质量(20±2)g,斯贝福(北京)生物技术有限公司提供,动物生产许可证号SCXK(京)2019-0010。饲养于北京中医药大学实验动物房,温度23~27 ℃,湿度40%~60%,12 h/12 h光暗循环,自由摄食饮水。本实验经北京中医药大学动物实验伦理委员会审批(BUCM-2021-01124)。
1.2 药物及制备
清肠温中方由黄连6 g、炮姜10 g、青黛3 g、苦参9 g、三七6 g、木香6 g、地榆炭15 g、炙甘草6 g组成,饮片颗粒购于北京康仁堂药业有限公司,由北京中医药大学东方医院配方颗粒药房制成配方颗粒,2袋配方颗粒相当于1剂原方。美沙拉嗪片,德国福克制药有限公司,0.5 g/片,批号17K09615L。将2袋配方颗粒溶于66 mL去离子水,0.5 g美沙拉嗪溶于13 mL去离子水,超声震荡1 h,过滤,取上清液,即得相应灌胃溶液,置于4 ℃冰箱保存。
1.3 试剂与仪器
葡聚糖硫酸钠(DSS),美国MP Biomedical,货号0216011080;便潜血试纸,珠海贝索生物有限公司,货号v277201;HE染液,北京高嘉生物技术有限公司,货号RY0456;AB-PAS染色试剂盒,武汉塞维尔,货号G1049;NLRP6抗体,美国Affinity Biosciences公司,货号DF15449;IL-18抗体,美国Affinity Biosciences公司,货号DF6252;MUC2抗体,英国Abcam,货号ab272692。LS-100病理石蜡包埋机(沈阳龙首电子仪器有限公司),Finesse 325石蜡切片机(北京弘泰嘉业科技发展有限公司),BX60显微镜(奥林巴斯株式会社),Power Pac Basic型垂直电泳仪、Trans-blot Turbo型转膜仪、Chemi Doc MP型凝胶成像系统(美国Bio-Rad公司)。
1.4 分组、造模及给药
小鼠适应性饲养7 d后,采用随机数字表法分为空白组、模型组、清肠温中方组和美沙拉嗪组,每组6只。空白组饮用去离子水,其他组饮用3%DSS溶液制备UC模型,连续7 d。第8日开始,美沙拉嗪组和清肠温中方组分别予相应药物灌胃,给药剂量按人与小鼠体表面积换算,清肠温中方组为原药材9.25 g/kg[13-14],美沙拉嗪组为0.38 g/kg,空白组和模型组灌胃去离子水,体积0.1 mL/10 g,连续7 d。
1.5 取材
给药结束后1%戊巴比妥钠腹腔注射麻醉小鼠,剖腹,剪取结肠,PBS清洗,测量结肠长度。取肛门端结肠组织1 cm,放入4%多聚甲醛固定。剩余结肠组织置于冻存管,液氮速冻后转移至-80 ℃冰箱保存。
1.6 疾病活动指数评分
实验期间每日称量小鼠体质量,观察大便性状,检测便潜血,计算疾病活动指数(DAI)评分(见表1)。DAI评分=(体质量下降评分+大便性状评分+便潜血评分)÷3。
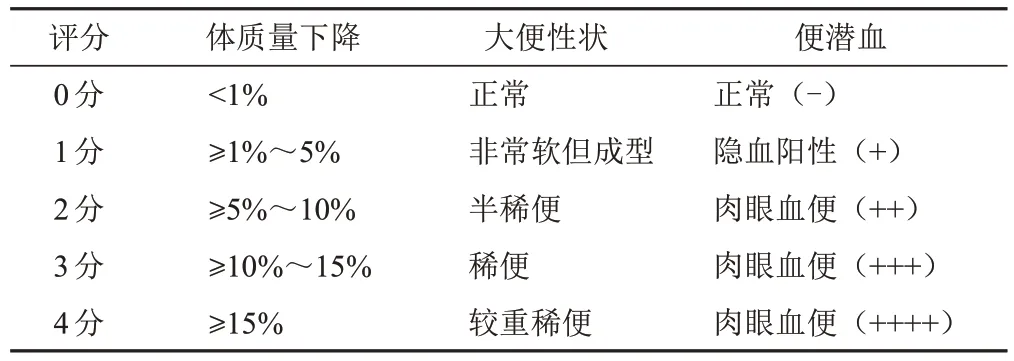
表1 DAI评分标准
1.7 HE染色
将多聚甲醛固定的结肠组织取出,常规石蜡包埋,切片(厚度5 μm),切片脱蜡后,苏木素染液染色3~5 min,水洗,分化液分化,水洗,返蓝液返蓝,流水冲洗。切片依次入85%、95%乙醇脱水5 min,伊红染液染色5 min,脱水封片。显微镜下观察结肠组织病理形态。
1.8 AB-PAS染色
石蜡切片脱蜡至水,入AB-PAS染液C中染色15 min,自来水洗至无色,入AB-PAS染液B中酸化15 min,自来水洗后,蒸馏水复洗2遍,入AB-PAS染液A(恢复室温)避光染色30 min,流水冲洗5 min,脱水封片。显微镜下观察结肠黏膜杯状细胞数量和形态。
1.9 Western blot检测
取结肠组织30 mg,加入RIPA裂解液300 μL,充分匀浆,冰上裂解30 min,4 ℃、12000 r/min离心20 min,取上清液,BCA法检测蛋白浓度。调整蛋白浓度后,上样,凝胶电泳分离,转膜,脱脂牛奶封闭,分别加入NLRP6、IL-18一抗(1∶1000),4 ℃孵育过夜,加二抗室温孵育1 h,ELC发光液显影,凝胶成像系统扫描,以β-actin为内参,采用Image J软件计算蛋白相对表达量。
1.10 免疫荧光染色
石蜡切片脱蜡至水,微波炉抗原修复,3%BSA封闭30 min,滴加MUC2一抗(1∶500),4 ℃孵育过夜。加二抗,室温避光孵育50 min。加DAPI染液,室温避光染色10 min,加自发荧光淬灭剂B液孵育5 min,流水冲洗10 min,抗荧光淬灭封片剂封片。显微镜下观察,计算阳性表达的荧光强度。
1.11 统计学方法
采用SPSS26.0统计软件进行分析。计量资料以±s表示,符合正态分布且方差齐组间比较采用方差分析,不符合正态分布或方差不齐用非参数检验。P<0.05表示差异有统计学意义。
2 结果
2.1 清肠温中方对模型小鼠一般状况和疾病活动指数评分的影响
空白组小鼠体质量平稳增长,模型组、清肠温中方组和美沙拉嗪组小鼠造模第3日开始体质量有所下降;第8日停用DSS并予相应药物干预后,各组小鼠体质量逐渐增加,其中清肠温中方组和美沙拉嗪组体质量增加较模型组更多。见图1。造模开始后,空白组小鼠大便正常,其余各组小鼠大便性状改变、便隐血或肉眼血便等情况逐渐加重。造模第7日开始,与空白组比较,模型组DAI评分显著升高(P<0.01);经药物干预后,与模型组比较,清肠温中方组和美沙拉嗪组DAI评分显著下降(P<0.01)。见图2。
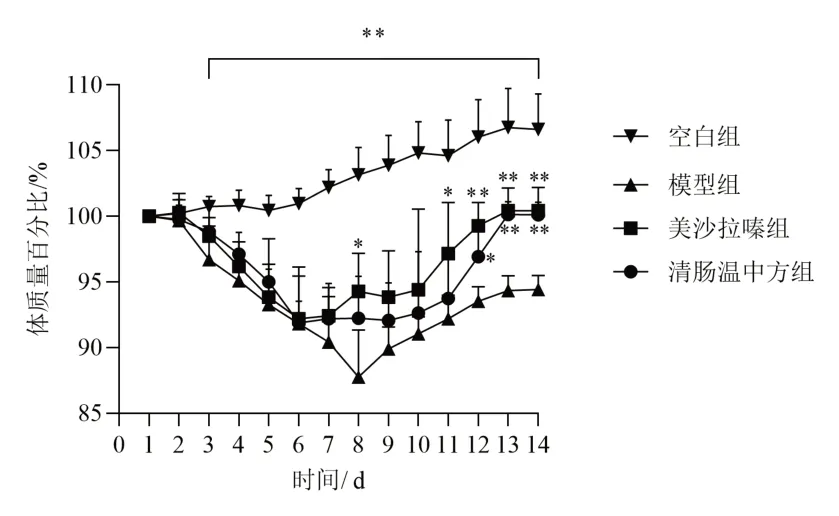
图1 各组小鼠体质量变化(±s,每组6只)
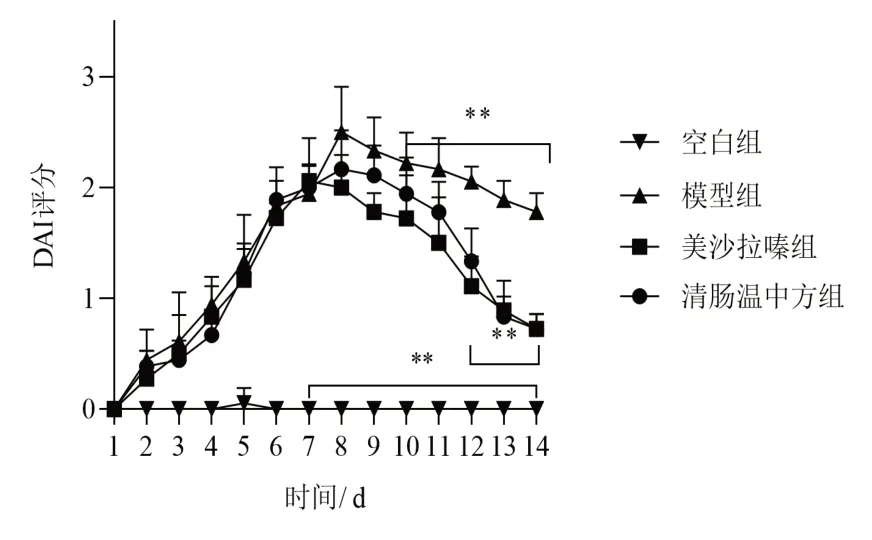
图2 各组小鼠DAI评分变化(±s,每组6只)
2.2 清肠温中方对模型小鼠结肠长度的影响
与空白组比较,模型组小鼠结肠长度显著缩短(P<0.01);与模型组比较,清肠温中方组和美沙拉嗪组小鼠结肠长度显著增加(P<0.05,P<0.01)。清肠温中方组和美沙拉嗪组结肠长度比较差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠结肠长度比较(±s,cm)
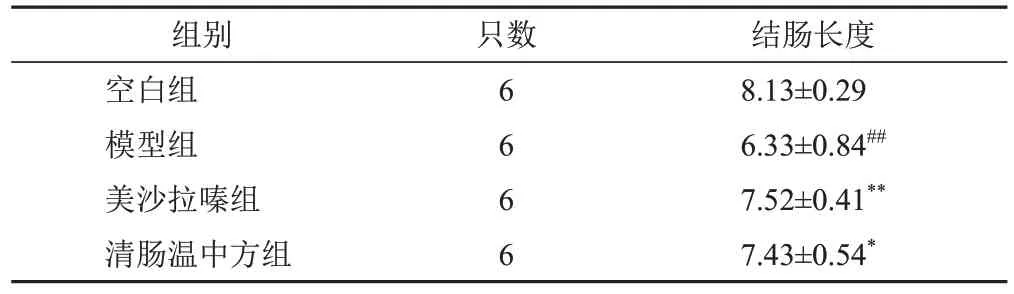
表2 各组小鼠结肠长度比较(±s,cm)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
结肠长度8.13±0.296.33±0.84##7.52±0.41**7.43±0.54*组别空白组模型组美沙拉嗪组清肠温中方组只数6666
2.3 清肠温中方对模型小鼠结肠组织病理形态的影响
空白组小鼠结肠组织结构正常,纹理整齐,结肠黏膜未见病变;模型组小鼠结肠组织可见黏膜下隐窝结构改变和炎性细胞浸润;与模型组比较,清肠温中方组和美沙拉嗪组小鼠结肠组织隐窝结构恢复,炎性细胞浸润减少。见图3。
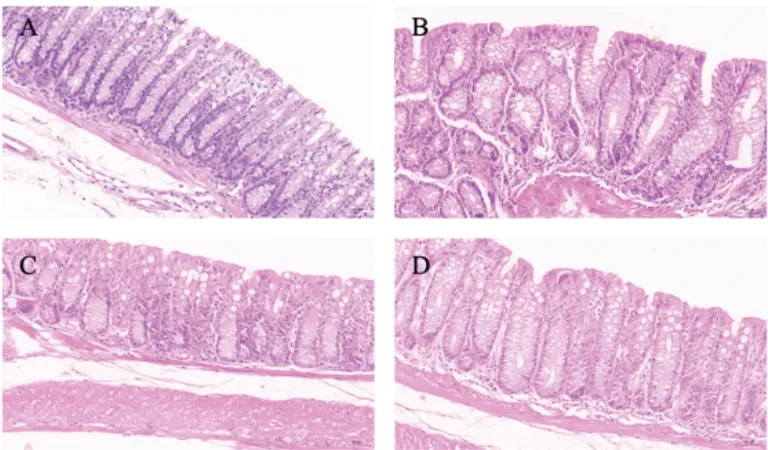
图3 各组小鼠结肠组织形态(HE染色,×1200)
2.4 清肠温中方对模型小鼠结肠组织杯状细胞的影响
空白组小鼠结肠组织杯状细胞规则分布于隐窝两侧,形态饱满;与空白组比较,模型组小鼠结肠组织隐窝结构改变,杯状细胞数量减少、大小不均、黏液减少;清肠温中方组和美沙拉嗪组小鼠结肠组织杯状细胞沿腺体分布、排列较密集、数量增多。见图4。
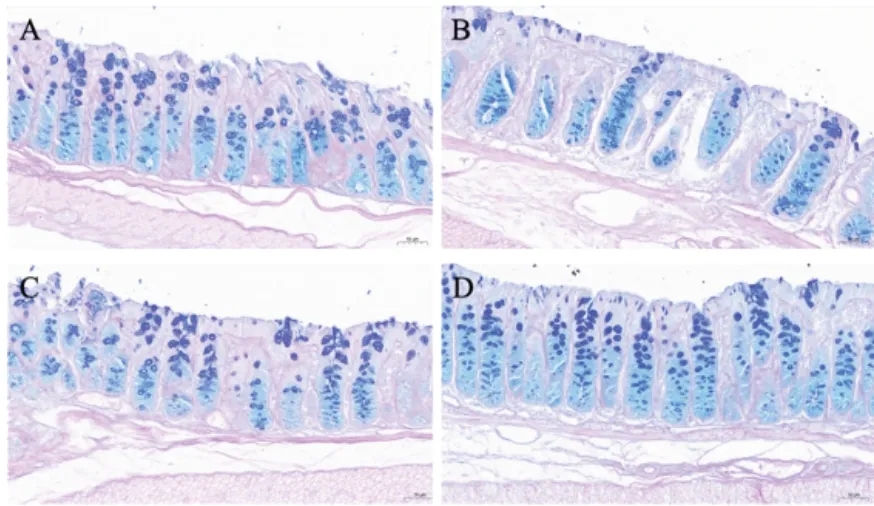
图4 各组小鼠结肠组织形态(AB-PAS染色,×1200)
2.5 清肠温中方对模型小鼠结肠组织核苷酸结合寡聚化结构域样受体蛋白6、白细胞介素-18蛋白表达的影响
与空白组比较,模型组小鼠结肠组织NLRP6蛋白表达显著降低,IL-18蛋白表达显著升高,差异有统计学意义(P<0.01);与模型组比较,清肠温中方组和美沙拉嗪组小鼠结肠组织NLRP6蛋白表达显著升高,IL-18蛋白表达显著降低,差异有统计学意义(P<0.05,P<0.01)。见图5、图6。
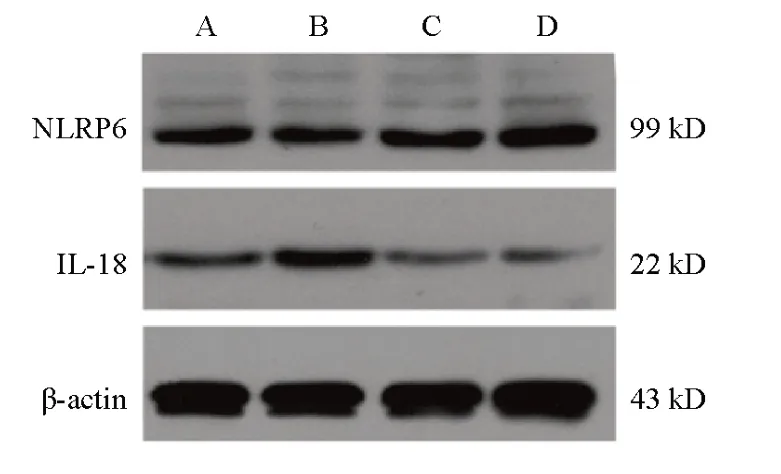
图5 各组小鼠结肠组织NLRP6、IL-18蛋白免疫印迹
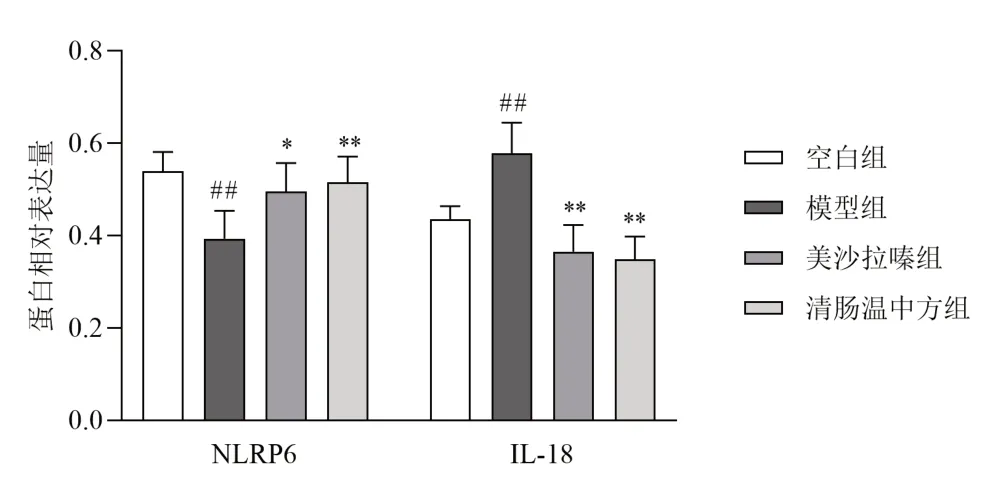
图6 各组小鼠结肠组织NLRP6、IL-18蛋白表达比较(±s,每组6只)
2.6 清肠温中方对模型小鼠结肠组织黏蛋白2表达的影响
与空白组比较,模型组小鼠结肠组织MUC2蛋白表达显著降低,差异有统计学意义(P<0.01);与模型组比较,清肠温中方组MUC2蛋白表达显著升高,差异有统计学意义(P<0.01)。见图7、图8。
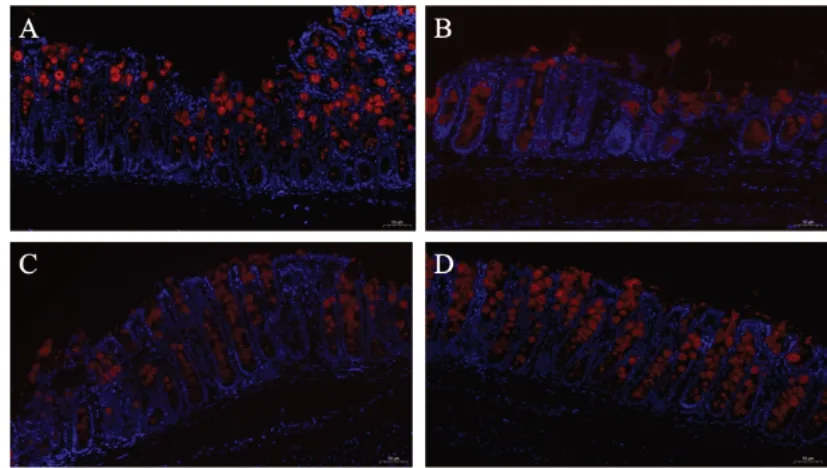
图7 各组小鼠结肠组织MUC2蛋白表达(免疫荧光染色,×1200)
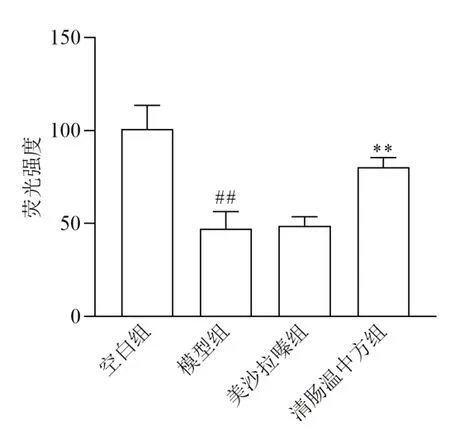
图8 各组小鼠结肠组织MUC2蛋白表达比较(±s,每组6只)
3 讨论
目前临床治疗UC以5-氨基水杨酸制剂、糖皮质激素、免疫抑制剂为主,虽然在改善临床症状方面具有一定疗效,但在促进肠黏膜愈合及维持长期疗效方面仍不尽如意。中医药具有多成分、多靶点的特点,在UC治疗方面有独特优势,能有效改善患者临床症状,并促进肠黏膜愈合[15]。
UC发病机制复杂,肠屏障损伤是肠黏膜溃疡形成和炎症发生的关键环节。正常肠黏膜屏障是由机械屏障、黏液屏障、免疫屏障和生物屏障组成的复杂系统,具有促进营养吸收和防止病原体入侵作用[16]。肠黏膜屏障完整性在维持机体健康方面至关重要。研究认为,易感人群受环境、微生物和遗传因素等相互作用,导致免疫系统诱发异常炎症反应,是炎症性肠病的主要环节[17]。黏液屏障是肠屏障中直接与肠腔内容物接触的部分,在维持肠道稳态方面扮演重要角色。黏液屏障作为机械屏障的“前哨”,能在肠黏膜抵御外源细菌和肠道固有微生物侵袭时发挥作用,尤其是将肠上皮与肠道菌群隔离,避免过度免疫反应的发生[18]。黏液、免疫球蛋白、抗菌肽等物质是黏液屏障的主要组成成分。黏液屏障分内外2层:内层由复层黏液组成,附着在肠上皮细胞表面,阻止肠道菌群入侵;外层可为共生菌新陈代谢提供能量,是细菌定植的部位[19]。黏液作为黏液屏障的主要物质基础,由肠道杯状细胞分泌产生。杯状细胞不仅分泌MUC2、MUC3、MUC12和MUC17等黏蛋白,还分泌多种典型的黏液成分,如CLCA1、FCGBP、AGR2、ZG16和TFF3等,杯状细胞与其分泌的黏液成分组成肠道第一道免疫防线[20]。MUC2在UC进展中的作用尤为突出。研究发现,MUC2蛋白缺乏更易发生结肠炎症;此外,MUC2还能维持肠道微生物群,促进肠道稳态[21]。研究表明,MUC2分泌可能受NLRP6对杯状细胞功能调节的影响[22],提示NLRP6与黏液屏障关系密切。NLRP6是NOD样受体家族成员,作为细胞膜先天免疫传感器识别微生物相关分子模式。NLRP6激活后招募凋亡相关斑点样蛋白和炎症性Caspase-1或Caspase-11,形成炎症体,介导促炎因子IL-18、IL-1β的成熟和分泌[23]。NLRP6在肠上皮细胞高表达,主要功能是识别不同病原体,通过Toll样受体抑制NF-κB和MAPK信号通路,从而抑制炎症,调节IL-18产生;通过影响自噬体形成调节肠道黏液分泌,发挥维持肠上皮完整性、保护肠道黏液屏障、促进肠黏膜伤口愈合的作用[24]。研究发现,在DSS诱导的肠道损伤中,NLRP6表达上调降低了肠道对结肠炎的易感性[8],而缺乏NLRP6小鼠在DSS诱导下表现出更严重的病情,这可能与NLRP6调控隐窝中细菌生长,从而影响IL-18分泌有关[25]。
李军祥教授认为,UC活动期至缓解期存在动态病机演变规律,即由脾气虚逐渐发展为脾阳虚,终致脾肾阳虚,由湿邪偏盛,渐至热邪偏盛,热毒炽盛,瘀血内阻[26-27]。清肠温中方由黄连、炮姜、青黛、苦参、三七、木香、地榆炭、炙甘草组成,具有清热燥湿、凉血化瘀、温中健脾功效。前期研究显示,清肠温中方能调节UC肠道菌群、促进肠上皮细胞增殖[28],有效促进患者肠道黏膜愈合[12]。
本研究中,模型组小鼠DAI评分升高,结肠黏膜杯状细胞数量较空白组减少,黏液分泌减少,结肠组织NLRP6和MUC2表达降低,IL-18表达升高,表明NLRP6/IL-18/MUC2轴对UC肠道黏液屏障功能具有一定影响。清肠温中方能够改善DSS诱导的UC小鼠疾病程度,降低DAI评分,促进结肠组织损伤修复。进一步研究发现,清肠温中方干预后,模型小鼠结肠组织杯状细胞数量增加,NLRP6和MUC2表达升高,IL-18表达降低,提示清肠温中方可能通过激活NLRP6调节IL-18产生,进而影响杯状细胞分泌MUC2,减轻结肠黏膜病理损伤,促进肠道黏液屏障修复。本研究基于NLRP6/IL-18/MUC2轴探讨清肠温中方治疗UC肠屏障损伤的作用机制,可为其临床应用提供实验依据。
