基于唾液酸化相关长链非编码RNA构建卵巢癌预后模型的研究
2023-09-25胡超扬曹晓华刘格良齐荣暄
胡超扬, 曹晓华, 刘格良, 2, 李 渊, 2, 齐荣暄, 2,张 豪, 于 琦, 2, 孙 焱
(1. 山西医科大学管理学院, 山西 太原, 030600;2. 山西省临床决策研究大数据重点实验室, 山西 太原, 030600)
卵巢癌(OC)是女性生殖系统常见的恶性肿瘤之一[1], 病死率居女性生殖系统恶性肿瘤之首[2], 严重威胁女性的生命健康[3]。近年来,随着转录组和计算机技术的发展,长链非编码RNA(lncRNA)作为癌基因或肿瘤抑制因子在癌症发生及发展中的作用被逐步揭示[4]。有学者[5-7]从铜死亡相关lncRNA、缺氧相关lncRNA、甲基化与免疫相关lncRNA等角度构建了OC预后模型。研究[8]表明,唾液酸化相关lncRNA与许多癌症病理情况相关,例如ST8 α-N-乙酰神经酰胺α-2, 8-酰基转移酶6反义1(ST8SIA6-AS1)过表达时, OC患者的总体生存率(OS)显著下降,加速乳腺癌、肺癌、胰腺癌等细胞周期进程,促进增殖并抑制化疗诱导的细胞凋亡; lncRNA母系表达基因3(MEG3)高表达时,肾癌细胞的增殖、迁移和侵袭能力显著增强[9]。
一直以来,以铂类药物为基础的治疗方式在OC中表现出原发性耐药,其化疗反应率仅为11%~56%, 患者5年生存率约为60%[10], 需要在新型抗癌药物方面取得突破。近年来,免疫疗法以其高效性、持久性、个体化、毒副作用小等优势,在恶性肿瘤治疗中显现出良好效果[11]。本研究基于唾液酸化相关lncRNA构建OC预后模型,分析OC患者预后的免疫反应和抗癌药物敏感性,现将结果报告如下。
1 材料与方法
1.1 数据获取
从MSigDB数据库(http://www.gsea-msigdb.org)获取19个唾液酸化基因集数据,见表1。从癌症基因图谱(TCGA)数据库(https://portal.gdc.cancer.gov)获取420个OC样本的基因表达数据(其中已包含研究所需的唾液酸化基因表达数据与lncRNA表达数据)及临床数据。

表1 唾液酸化基因列表
1.2 筛选OC唾液酸化相关lncRNA
采用R包"stat(4.2.1)"对lncRNA和唾液酸化基因进行Pearson相关性分析,以r>0.4且P<0.001为筛选阈值。采用R包"ggalluvial(0.12.3)"与"ggplot2(3.4.0)"对获得的唾液酸化基因与lncRNA的共表达数据进行可视化展示。
1.3 筛选OC生存相关唾液酸化lncRNA
将OC唾液酸化相关的lncRNA表达数据与OC生存数据进行合并,以1∶1的比例随机分为训练组(n=210)和验证组(n=210),采用卡方检验评价训练组与验证组临床特征的差异,以P>0.05为筛选阈值。训练组采用单因素Cox回归与Lasso回归的10倍交叉验证明确预后显著的唾液酸化lncRNA, 以P<0.05为筛选阈值。对获取的预后唾液酸化lncRNA进行偏似然比算法与向前逐步回归的多因素Cox分析(以进入P=0.05、除去P=0.10为阈值),筛选卵巢癌生存相关的唾液酸化lncRNA(OCSS lncRNA)。验证组则验证OCSS lncRNA的准确性。
1.4 OC预后模型构建与验证
基于OCSS lncRNA构建预后模型,计算每例OC患者的风险评分。风险评分=Coef(i)×Expr(i), 公式中的Coef(i)代表回归系数, Expr(i)代表lncRNA的表达水平。将训练组风险评分中位数作为分界点,把涵盖OC的样本分为高、低风险组,并绘制风险评分图、患者生存状态散点图与基因表达热图。采用R包"survival(3.4.0)"分析总数据集、训练组和验证组OC患者高、低风险OS的差异,以及总数据集高、低风险组无进展生存期OS的差异。采用R包"timeROC(0.4)"绘制受试者工作特征(ROC)曲线,用于验证模型效能。
1.5 OC预后模型临床价值分析
采用单因素和多因素Cox回归分析筛选OC的独立预后因素。基于风险评分与临床特征数据,采用R包"rms(6.3.0)" "nomogramEx(1.0)" "regplot(1.1)"绘制预测OC患者OS的列线图,并构建校正曲线验证列线图准确性。
1.6 免疫细胞浸润与免疫治疗分析
采用"CIBERSORT"算法分析不同风险人群22种免疫细胞含量的差异,在肿瘤免疫功能障碍和排斥(TIDE)网站检索OC的TIDE数据(http://tide.dfci.harvard.edu), 分析不同风险人群对免疫治疗敏感性的差异,以P<0.05为筛选阈值。
1.7 药物敏感性分析
从癌症药物敏感性基因组学(CDSG)数据库(https://www.cancerrxgene.org)获取治疗OC的潜在药物数据,计算药物的半数有效抑制浓度(IC50),并分析不同风险人群的药物敏感性差异,以P<0.01为筛选阈值。本研究采用的R软件版本是4.2.1。
2 结 果
2.1 OC唾液酸化相关lncRNA
通过Pearson相关性分析获得了1 568个OC唾液酸化相关lncRNA, 见图1。

图1 卵巢癌唾液酸化相关lncRNA
2.2 OC预后模型构建
分组临床统计结果显示,总数据集、训练组和验证组的OC患者在年龄、肿瘤分级和肿瘤分期方面比较,差异无统计学意义(P>0.05), 见表2。基于训练组的单因素Cox与Lasso回归的10倍交叉验证分析筛选出21个预后显著的OC唾液酸化lncRNA,见图2。通过偏似然比算法与向前逐步回归的多因素Cox分析最终确定7个OCSS lncRNA纳入预后模型,见表3。风险评分=(-0.437×AC015 802.4)+(0.070×AC008 982.2)+(0.063×AC125 807.2)+(-0.704×AC002 306.1)+(0.236×PTPRD-AS1)+(0.111×AC010 834.3)+(-0.293×AL590 133.1)。

表2 训练组与验证组临床资料比较[n(%)]

表3 多因素Cox回归纳入模型的OCSS lncRNA
2.3 OC预后模型效能检验
总数据集、训练组与验证组的风险评分图与患者生存状态散点图显示,高风险组的风险值较高,并且随着风险值的升高,患者的生存时间缩短,死亡例数增加; 总数据集、训练组与验证组的基因表达热图显示, 7个OCSS lncRNA在高、低风险组中的表达情况一致。见图3。Kaplan-Meier(K-M)生存曲线显示,高风险较低风险患者的OS下降,差异有统计学意义(P<0.05或P<0.01), 见图4。此外,预后模型1、3、5年的ROC曲线与不同临床特征比较的ROC曲线显示,模型预测患者OS具有较高的准确性,见图5。

A: 单因素COX筛选的预后显著的唾液酸化lncRNA, 图中绿色表示保护因素,红色表示危险因素; B: Lasso回归中的Coef系数剖面图; C: Lasso回归中调整参数进行10倍交叉验证(2条虚线之间的区域表示合理值)。图2 卵巢癌预后显著的唾液酸化lncRNA
2.4 OC预后模型的临床价值
本研究纳入年龄、肿瘤分级、肿瘤分期、风险评分为协变量,构建Cox比例风险模型,评估上述临床特征预测预后的潜力。单因素Cox回归分析显示,年龄的大小、肿瘤分期的早晚和风险评分的高低是影响OC患者OS的危险因素(P<0.05); 多因素Cox回归分析显示,年龄的大小和风险评分的高低是影响OC患者OS的危险因素(P<0.05)。见图6。因此,年龄和风险评分是影响OC患者OS的独立预后因素。列线图可以对OC患者1、3、5年的OS进行预测,校正曲线显示预测结果与患者实际结果的重合度较好,见图7。
2.5 免疫细胞浸润与免疫治疗分析
考虑到免疫浸润在免疫治疗中的作用,本研究比较了高、低风险组中的免疫细胞浸润差异,结果显示,高风险组的γδT细胞和M1巨噬细胞含量高于低风险组(P<0.05或P<0.01); 免疫治疗敏感性分析结果显示,高风险组的TIDE评分总体高于低风险组(P<0.05)。见图8。
2.6 药物敏感性分析
为探寻治疗OC的潜在药物,本研究比较了高、低风险组的药物敏感性差异,共获得药物9种(ERK_2440、ERK_6604、GSK269962A、PD0325901、SCH772984、VX-11e、Selumetinib、Staurosporine、Ulixertinib), 且高风险组的IC50值均低于低风险组,差异有统计学意义(P<0.05),说明上述药物可能对高风险OC患者具有较高的治疗价值。见图9。
3 讨 论
唾液酸化是一种翻译后修饰,由唾液酸转移酶、转运蛋白和神经氨酸酶家族控制的生物学过程[12]。这一过程与许多病理情况有关,例如癌症、胚胎致死和免疫系统异常[13]。研究[14]表明,唾液酸化相关lncRNA不但可以调节癌细胞的增殖、分化,还可调节癌细胞的代谢重编程,在癌细胞的侵袭和转移中有至关重要的作用。有学者[15]从唾液酸化相关lncRNA角度构建了结直肠癌预后模型。由于化疗药物的耐药性,探索新型免疫治疗方式与开发新型抗癌药物一直是研究者关注的焦点。本研究基于唾液酸化相关lncRNA构建OC预后模型,并进一步分析患者预后免疫反应与药物敏感性,以期为OC患者的精准医疗以及免疫与药物治疗提供依据。

A~C: 总数据集、训练组与验证组的风险评分图; D~F: 总数据集、训练组与验证组的患者生存状态散点图; G~I: 7个OCSS lncRNA在总数据集、训练组与验证组中的基因表达情况。图3 总数据集、训练组与验证组的风险评分图、患者生存状态散点图及基因表达热图

A: 总数据集的K-M生存曲线; B: 训练组的K-M生存曲线; C: 验证组的K-M生存曲线; D: 总数据集无进展生存期的K-M生存曲线。图4 总数据集、训练组、验证组的K-M生存曲线
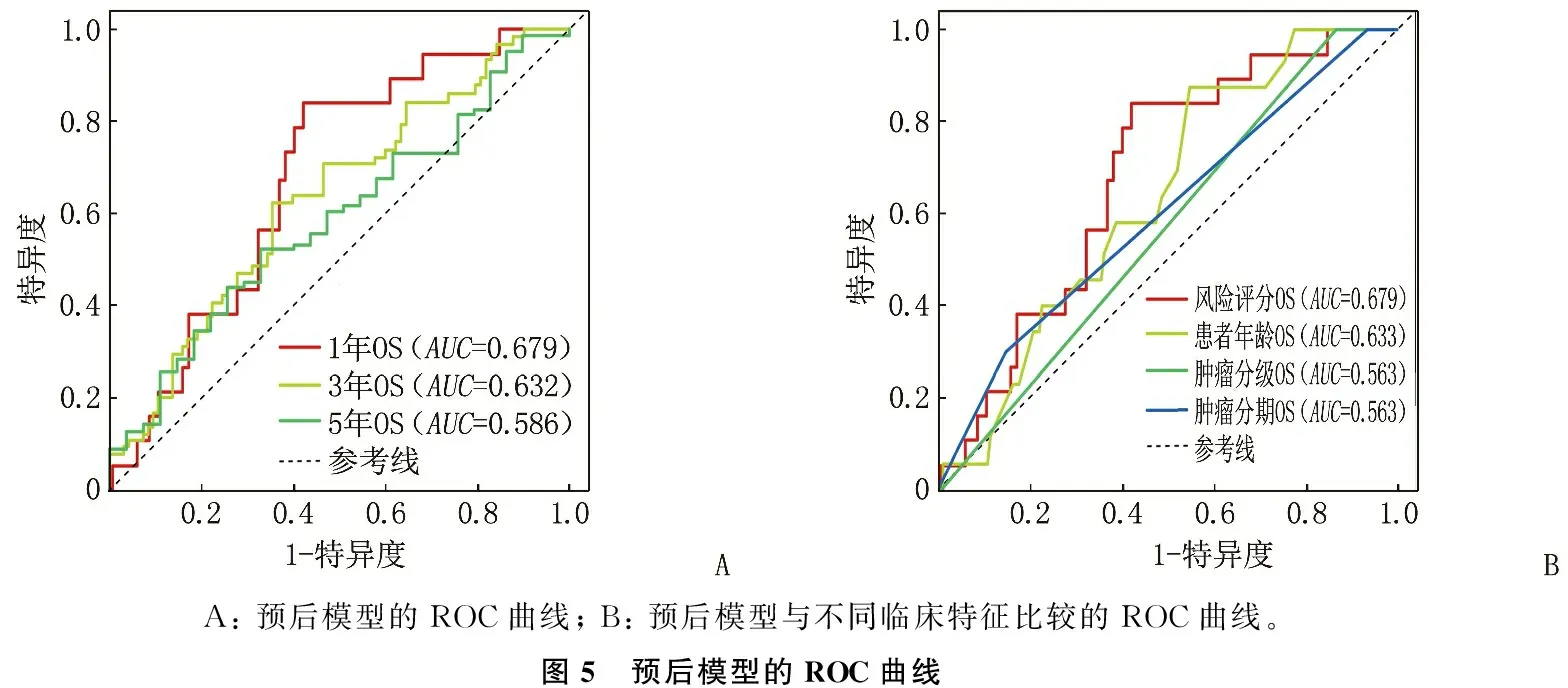
A: 预后模型的ROC曲线; B: 预后模型与不同临床特征比较的ROC曲线。图5 预后模型的ROC曲线
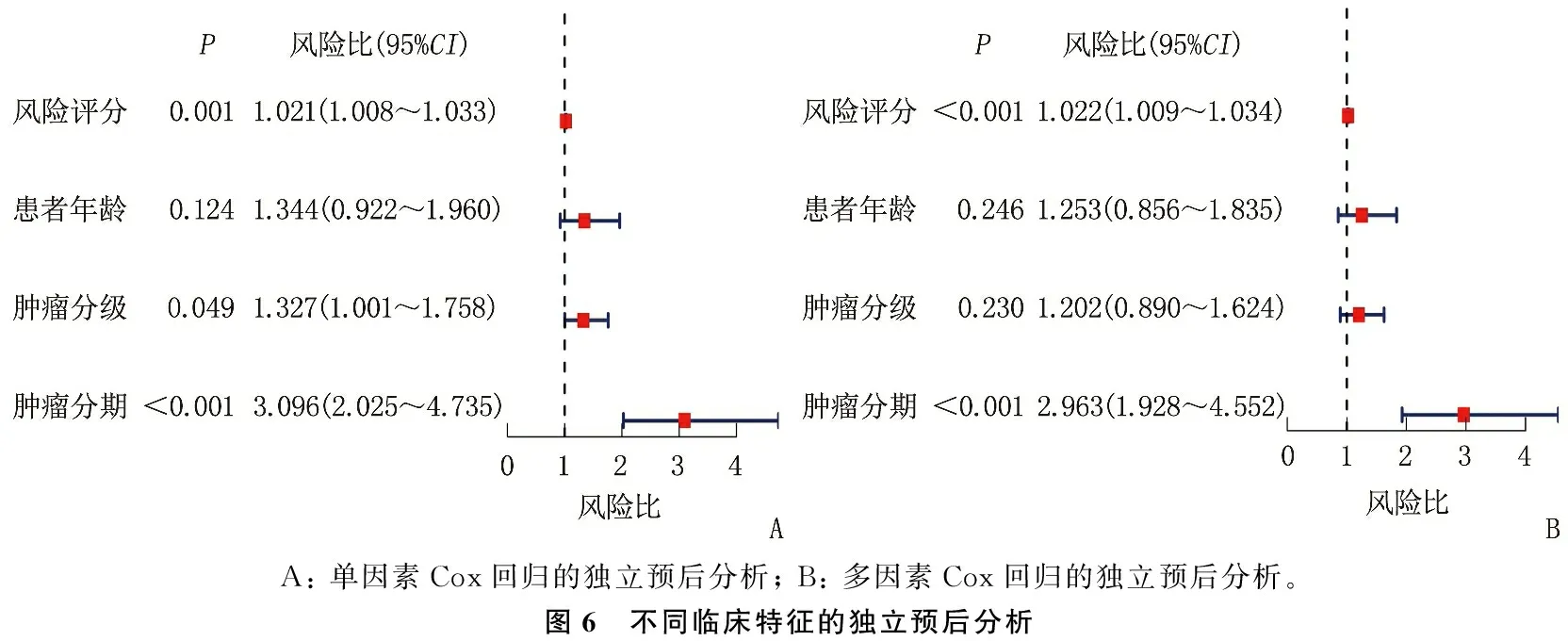
A: 单因素Cox回归的独立预后分析; B: 多因素Cox回归的独立预后分析。图6 不同临床特征的独立预后分析

A: 列线图; B: 列线图的校正曲线。图7 预后模型的列线图与校正曲线

A: 高、低风险组的免疫细胞浸润分析结果; B: 高、低风险组的免疫治疗敏感性分析结果。图8 高、低风险组的免疫细胞浸润与免疫治疗敏感性
本研究通过分析获取了1 568个与OC唾液酸化相关的lncRNA, 再通过单因素Cox、Lasso和多因素Cox回归分析最终确定了7个OCSS lncRNA, 并基于此构建了OC预后模型(AC015802.4、AC008982.2、AC125807.2、AC002306.1、PTPRD-AS1、AC010834.3与AL590133.1)。单因素和多因素Cox回归分析显示,年龄和风险评分是OC患者高危的独立预后因素。列线图可以较为准确地预测OC患者各阶段的OS。
7个OCSS lncRNA中,已有2个被报道与OC密切相关。AC008982.2被认为是一种新型致癌基因,可以促进OC细胞增殖、迁移,与OC患者OS密切相关,并可能作为OC的新型治疗靶点[16]。以PTPRD-AS1构建的预后模型不仅可以预测OC患者预后,还与多囊卵巢综合征显著相关[17]。剩余的5个OCSS lncRNA未见与OC相关的报道。然而,研究[18]发现AC002306.1的低表达与前列腺癌患者的预后恶化显著相关, AC015802.4是预测膀胱癌患者OS的关键lncRNA。此外, AC125807.2被证实是肺腺癌预后模型的重要成员[19],其在肺腺癌细胞中呈高表达,这种高表达与肺腺癌的不良预后密切相关,当下调AC125807.2表达时,肺腺癌的进展被抑制[20]。因此,进一步研究上述lncRNA在OC中的作用,可以作为对OC认识的一个新维度,可能有助于预测OC患者的预后。
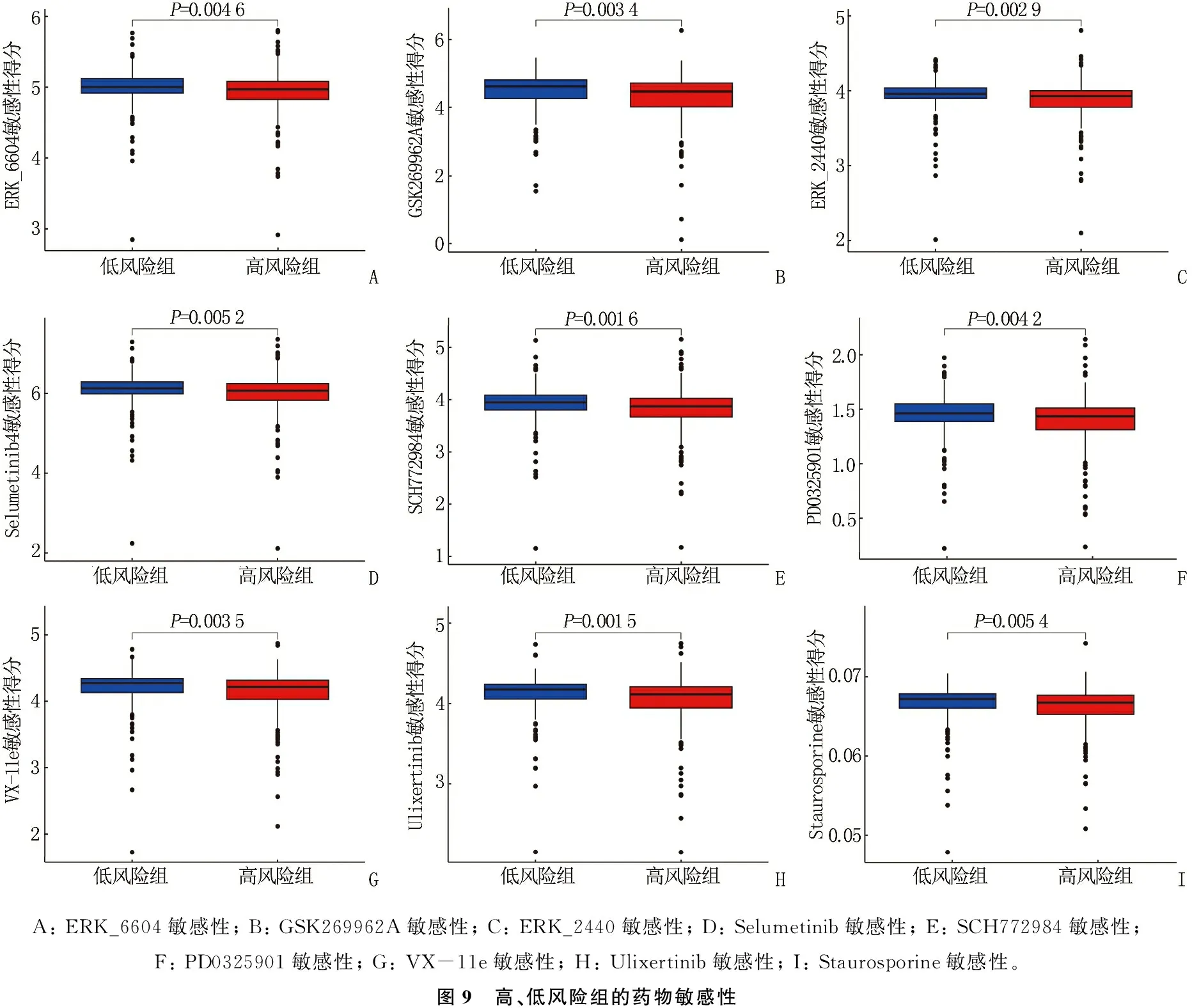
A: ERK_6604敏感性; B: GSK269962A敏感性; C: ERK_2440敏感性; D: Selumetinib敏感性; E: SCH772984敏感性; F: PD0325901敏感性; G: VX-11e敏感性; H: Ulixertinib敏感性; I: Staurosporine敏感性。图9 高、低风险组的药物敏感性
本研究对OC低风险和高风险人群的免疫细胞浸润进行分析,结果显示γδT细胞和M1巨噬细胞的含量在低风险组较高。γδT细胞具有识别热休克蛋白和超级抗原的重要功能,是人体抵御病原体的首道防线[21]。研究[22]证实, γδT细胞浸润到肿瘤中与OC患者OS增加有关,促进γδT细胞反应可能是OC的治疗选择。巨噬细胞的主要免疫系统功能依赖于其吞噬功能,即在感染环境中吞噬各种细胞底物的过程[23]。M1巨噬细胞表现为促炎、抗感染状态,是一种激活的抗肿瘤状态[24]。研究[25]表明, M1巨噬细胞通过诱导型一氧化氮合酶优先产生一氧化氮,一氧化氮是一种自由基气体,对癌细胞和各种病原体都有直接的细胞毒性。结合本研究结果,抑制γδT细胞和M1巨噬细胞反应可能是引起OC进展的因素之一。本研究使用TIDE评分分析患者的免疫治疗敏感性,高风险组TIDE评分显著高于低风险组,提示存在高免疫逃逸倾向,表明高风险组患者不太可能从免疫治疗中获益。
本研究通过比较高、低风险组的药物敏感性差异,获得了9种对高风险OC患者具有较高治疗价值的药物(ERK_2440、ERK_6604、GSK269962A、PD0325901、SCH772984、VX-11e、Selumetinib、Staurosporine、Ulixertinib), 上述药物大多具有抑制细胞外信号调节激酶1/2(ERK1/2)活性或阻断ERK1/2信号转导通路的作用[26-29]。ERK1/2是一种参与ERK信号转导级联的丝氨酸/苏氨酸激酶,其活化后进入OC细胞核作用于各种转录因子,调节相关基因的转录,进而影响OC细胞的生长发育及增殖分化[30]。研究[31]表明,高表达的唾液酸化基因ST6Gal1可通过ERK1/2信号转导通路,增强OC细胞凋亡抗性,促进OC细胞在富含肿瘤坏死因子的肿瘤微环境中存活。因此,将上述药物应用于治疗高风险OC患者可能具有广阔的前景。作为前瞻性研究,本研究依然存在一定的局限性,所用数据均来源于在线数据库,仍需进一步结合大量临床标本及实验数据来验证其临床应用价值。
综上所述, 7个OCSS lncRNA构建的OC预后模型有助于预测OC患者预后,而基于模型结果的免疫分析表明,抑制γδT细胞和M1巨噬细胞生长可能是引起OC进展的因素之一。药物敏感性分析获取了9种可能对高风险患者具有治疗价值的抗癌药物。
