调整FUT8表达对食管鳞癌细胞放射敏感性的影响
2023-09-23刘永宇夏敏唐园慧汪诗琪骆志国
刘永宇 ,夏敏,唐园慧,汪诗琪,骆志国
(1.锦州医科大学十堰市太和医院研究生培养基地,湖北 十堰 442000;2.湖北医药学院附属医院十堰市太和医院 肿瘤防治中心,湖北 十堰 442000;3.武汉市人民医院 肿瘤科,湖北 武汉 430000;4.湖北医药学院研究生院,湖北 十堰 442000;5.湖北医药学院附属医院十堰市太和医院 肾内科,湖北 十堰 442000 )
食管癌作为较常见的消化道肿瘤之一,其死亡率在所有肿瘤中排在第6 位,约90%病理类型为鳞状细胞癌[1],多数病人通过检查发现病变往往已处于晚期阶段,失去手术机会,远期预后较差。放射治疗在食管癌的综合治疗中扮演着重要的角色,能够显著减轻患者痛苦,提高生活质量[2]。尽管目前放疗发展迅速,但放射抵抗往往使放疗的效果不尽人意,容易导致局部肿瘤复发和治疗失败[3]。因此,迫切需要找寻食管癌放射抵抗的生物学标志物及提高放射敏感性的靶点。
糖基化是普遍的翻译后修饰并深刻影响蛋白质的功能,参与体内的许多生物学过程[4]。已有研究认为异常糖基化既与肿瘤发生发展相关,又能促进癌细胞放射抵抗,例如:小细胞肺癌[5]、前列腺癌[6]和神经胶质瘤[7]等。α-1,6 岩藻糖基转移酶(FUT8)可通过形成α-1,6 糖苷键将GDP岩藻糖转移至N-糖链核心结构,组成核心岩藻糖[8],有研究发现FUT8 参与调控多种肿瘤细胞功能[9],但其对食管鳞状细胞癌(ESCC)细胞的放射抵抗的影响尚不清楚。本研究通过生物信息学手段和细胞学实验探讨FUT8 与食管癌放疗敏感性的关系,针对提高食管癌临床放射治疗效果提供新的靶点。
1 材料与方法
1.1 实验材料
胎牛血清、1640 培养基,美国Gibco 公司;GADPH 抗体、FUT8 抗体、HRP-标记Ⅱ;美国Abcam 公司,FUT8 过表达及敲低序列,中国上海吉玛公司;蛋白裂解液、蛋白提取试剂盒、BCA蛋白定量试剂盒、细胞周期试剂盒、细胞凋亡试剂盒均,中国碧云天生物技术研究所;流式细胞仪,美国BD 公司;凝胶成像系统;美国Bio-Rad公司;人ESCC 细胞株KYSE,中国科学院上海细胞库。
1.2 实验方法
1.2.1 数据库分析 Oncomine 数据库(http://www.oncomine.org/)设置的数据提取条件为:①“肿瘤类型:Esophagus Cancer”;②“基因:FUT8”;③“数据类型:mRNA”;④“分析类型:Cancervs.Normal Analysis”;⑤临界值设定条件(P-value<0.05,fold change>1.5,gene rank=top10%),选择柱状图为展示结果。GEPIA 数据库(http://gepia.cancer-pku.cn/detail.php)在“表达”菜单中输入“FUT8”,选择“食管癌”进行数据分析。Strin 数据库(www.string.or)设定的筛选条件如下:①“Protein Name:FUT8”;②“Organism:Homo sapiens”。
1.2.2 细胞培养 人ESCC 细胞株KYSE 购于中国科学院上海细胞库,利用含10%胎牛血清的1640培养基进行培养,培养箱设置温度37℃,CO2浓度5%,湿度95%,2~3 d 更换一次培养液,电子显微镜下观察细胞贴壁生长至80%时,进行胰酶消化传代。
1.2.3 稳定转染细胞系的构建 采集生长状态较好的KYSE 细胞,胰酶消化制备细胞悬液,接种在6 孔板上,细胞密度调整为2×105个/mL,根据Lipofectamine 3000 的操作指令,分别对表达组KYSE FUT8 及KYSE NC,敲低组KYSE shFUT8 及KYSE shNC 进行转染,分别在转染48 h、72 h 后用荧光显微镜观察细胞发光情况,以便对生长和转染效果进行评价,后在嘌呤霉素中继续筛选1周,为开展后续试验提供稳定转染细胞株。
1.2.4 蛋白提取及Western blot 检测 采集转染后生长状况良好KYSE 细胞,用磷酸缓冲盐溶液(PBS)摇晃洗涤两次,添加裂解缓冲液,置于冰上裂解30 min,离心机设置4℃、12 000 r/min、离心10 min 取上清液,用BCA 法测定每个样品的蛋白含量。每种蛋白取50 μg 样品,行10%SDSPAGE 电泳,仪器设置80 V 恒压30 min,120 V 恒压50 min,使蛋白转移至PVDF 膜上,用脱脂奶粉配比封闭液,常温条件下封闭2 h,按比例配一抗(FUT8 1∶1 500、GADPH 1∶1 000),加入一抗后在4℃的冰箱中冷藏1 晚,次日用TBST 缓冲液洗涤3 遍,每遍5 min,配比二抗羊抗兔IgGHRP(1∶1 000)、羊抗鼠IgG-HRP(1∶1 000),加入二抗后置于摇床,室温孵育2 h,TBST 缓冲液洗涤3 遍,每遍5 min,ECL 上机曝光显影。采用ImagePro Plus 6.0 图像分析软件得出灰度值,通过将内参蛋白与目的蛋白两者灰度值相比得出目的蛋白的表达量,绘制柱状图。
1.2.5 克隆形成实验 将生长状态良好的KYSE细胞进行分组,以过表达的KYSE FUT8 细胞为实验组,以NC 为阴性对照组;以敲低表达的KYSE shFUT8 细胞为实验组,以shNC 为阴性对照组,各组细胞制备细胞悬液后,在电子显微镜下计数,每孔取适当数量在6 孔板中均匀接种,每组重复3个复孔,给予6 Gy 剂量的X 线对接种后的6 孔板进行照射,继续培养两周,细胞培养期间,需常观察,培养完成后,取出各组6 孔板,弃去原培养基,PBS 摇晃洗涤2 次,自然晾干,4%多聚甲醇固定时间为15 min,弃去固定液,将0.1%结晶紫加入6 孔板,20 min 后回收结晶紫染料,洗净自然晾干,对各孔存活细胞的数量进行镜下统计并拍照记录,将细胞存活数作为纵坐标,以照射剂量为横坐标,绘制画柱状图。
1.2.6 细胞凋亡实验 将生长状态良好的KYSE细胞进行分组,以过表达的KYSE FUT8 细胞为实验组,以NC 为阴性对照组;以敲低的KYSE shFUT8 细胞为实验组,以shNC 为阴性对照组,在显微镜下观察,待细胞贴壁生长至80%,给予6 Gy 剂量的X 线照射,培养箱继续培养48 h 后,取出培养瓶收集细胞,制备细胞悬液,依据细胞凋亡检测试剂盒操作说明,依次采用Annexin V/PI双染,流式细胞仪上机检测细胞凋亡,得出各组细胞凋亡率,绘制柱状图。
1.2.7 细胞周期实验 将生长状态良好的KYSE细胞进行分组,以过表达的KYSE FUT8 细胞为实验组,以NC 为阴性对照组;以敲低的KYSE shFUT8 细胞为实验组,以shNC 为阴性对照组,在显微镜下观察,待细胞贴壁生长至80%,给予6 Gy 剂量的X 线照射,培养箱继续培养48 h 后,取出培养瓶收集细胞,制备细胞悬液,70%的冷乙醇固定,置于4℃冰箱过夜,次日弃去固定液,PBS 摇晃洗涤3 遍,依据细胞周期检测试剂盒操作说明,加入配置好的工作液,采用流式细胞仪上机检测细胞周期,Modfit4.1 得出各组G2/M 期细胞阻滞情况,绘制柱状图。
1.3 统计学方法
采用SPSS 22.0 软件包进行数据分析。计量资料以均数±标准差()表示,采用配对样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 FUT8 在临床常见肿瘤中的表达
在Oncomine 数据库,共收集到356 篇不同种类的研究成果。有52 项研究发现FUT8 表达差异有统计学意义,12 项研究表明FUT8 表达下降,表达增高有40 例(图1A)。2005 年后,5 篇研究主要关注ESCC 及正常食管组织FUT8 的表达情况,共382 个样本,文章分别发表于BMC Genomics,PLoS One,Cancer Res,Clin Cancer Res,Oncogene 等杂志。在上述5 项研究结果的中,FUT8 在ESCC 组织中较正常食管组织显著高表达,中位数值排名为298.0,P=6.19e-4,表明其表达升高,并且差异有统计学意义(图1B)。对其中Hu Esophagus 和Su Esophagus 的研究数据分析显示:与正常组织相比,FUT8 在ESCC 组织中的表达明显增高(P<0.05,图1C)。GEPIA 数据库分析发现:FUT8 在食管癌中显著高表达(P<0.05,图1D)。
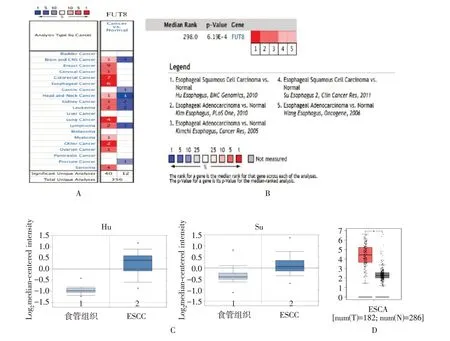
图1 生物信息学分析FUT8 在ESCC 组织中的表达
2.2 预测FUT8 基因在ESCC 中的变化及调控网络
利用String 数据库,以FUT8 为核心分析FUT8互作蛋白网络(PPI),P<1.94e-11,节点数为10个,在PPI 网络中与FUT8 相互作用(P均<0.05)的有 FUT6、MGAT2、MGAT4A、MGAT4B、MGAT4D、MGAT5、B4GALT1、B4GALT2、B4GALT3,涉及的主要生物学过程包括糖蛋白生物合成、蛋白折叠、免疫抵抗等,见图2。
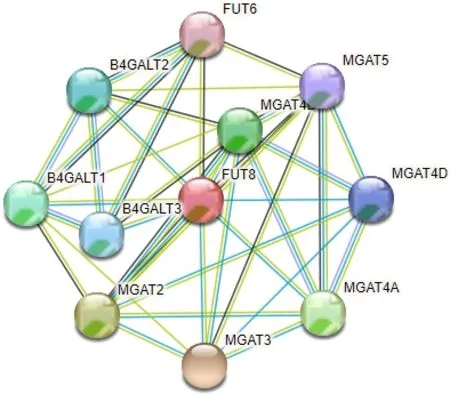
图2 基于String 数据库构建FUT8 相关蛋白网络
2.3 FUT8 过表达及敲低细胞模型的构建
为了探索FUT8 对ESCC 细胞放射敏感性的调控作用,采用慢病毒感染技术将带有荧光蛋白的FUT8 过表达质粒和配对的阴性对照组质粒转染至ESCC 细胞KYSE 中,也将带有荧光蛋白的敲低FUT8 表达的质粒及配对阴性对照组质粒转染至ESCC 细胞KYSE 中,通过观察镜下荧光蛋白的表现,判断转染效果(图3)。经嘌呤霉素筛选得到FUT8 稳定过表达及敲低的ESCC 细胞株。Western blot 验证转染后各组细胞FUT8 的表达差异。结果表明:在转染了FUT8 过表达质粒的细胞株中,FUT8 的表达量显著增高,差异有统计学意义(P<0.05),在转染了敲低FUT8 表达的质粒后,FUT8 的表达量显著降低,差异有统计学意义(P<0.05)(图4)。
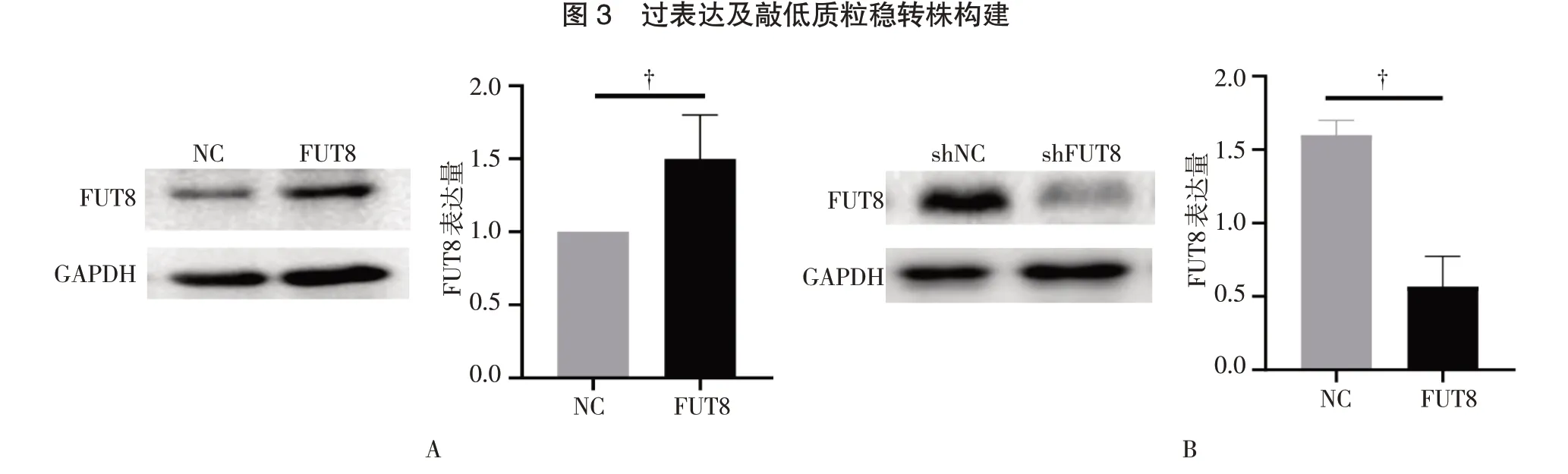
图4 稳定细胞系FUT8 过表达及敲低水平蛋白印迹检测
2.4 调节FUT8 对ESCC 细胞放射抵抗的影响
为了探索ESCC 细胞中FUT8 表达量与放射抗拒之间的关系,首先将FUT8 过表达及阴性对照组、敲低及阴性对照组KYSE 细胞依次给予0 Gy、6 Gy 剂量X 线照射,继续培养48 h 后,通过流式细胞术和克隆形成试验检测FUT8 表达量的变化对细胞凋亡、细胞周期和克隆形成能力造成的影响。
给予6 Gy 剂量X 线照射后,KYSE NC 组、KYSE FUT8 组细胞调亡率分别为(3.12±1.32)%、(2.07±0.87)%,FUT8 过表达组ESCC 细胞的调亡率较阴性对照组显著下降,差异有统计学意义(P=0.0007,图 5A);KYSE shNC 组、KYSE shFUT8 组细胞凋亡率分别为(17.71±1.63)%、(23.86±2.52)%,FUT8 敲低组ESCC 细胞的调亡率较阴性对照组显著增高,差异有统计学意义(P=0.0054,图5B)。
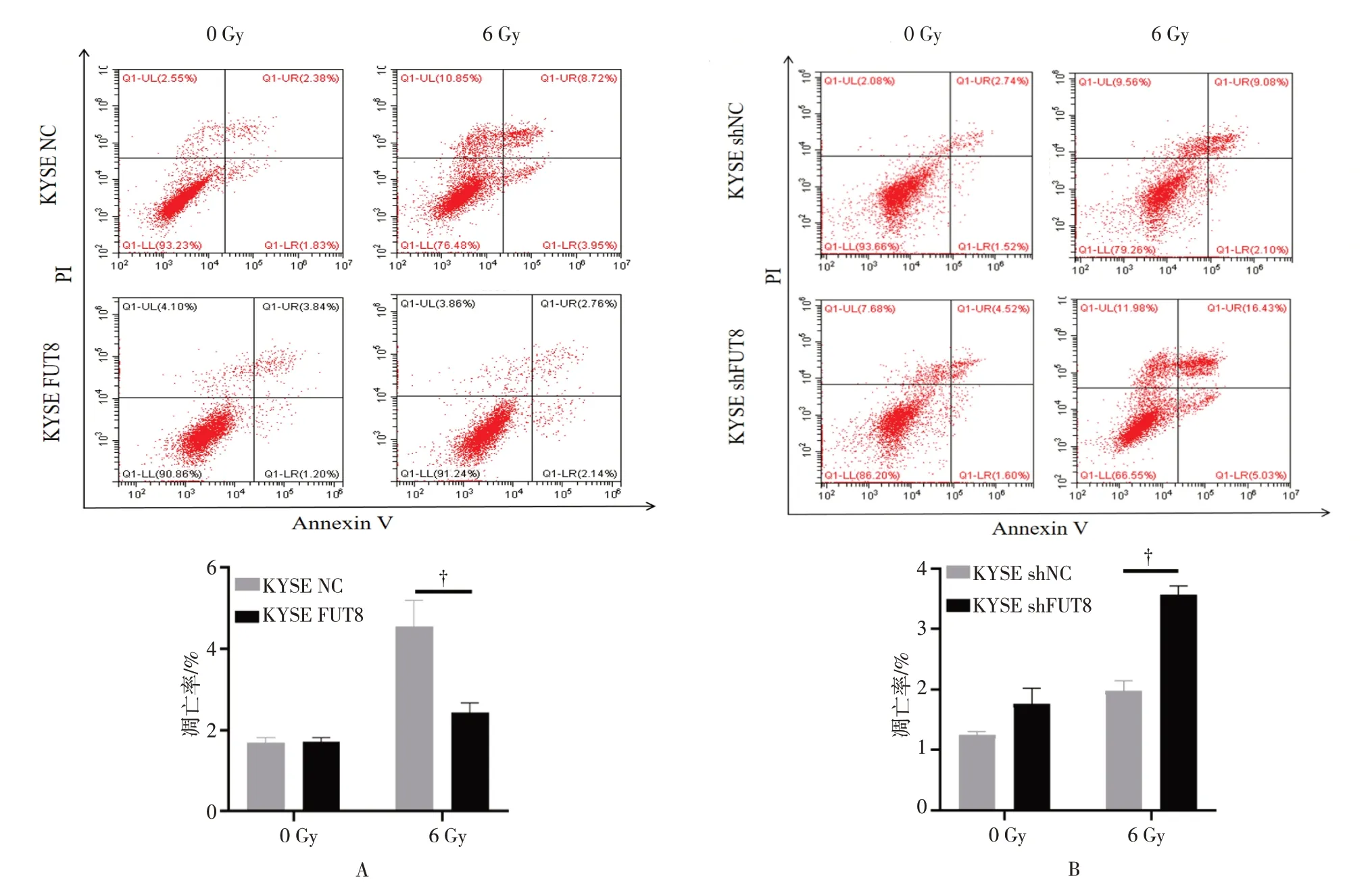
图5 细胞凋亡实验检测FUT8 表达量的变化对ESCC 细胞放射敏感性的影响
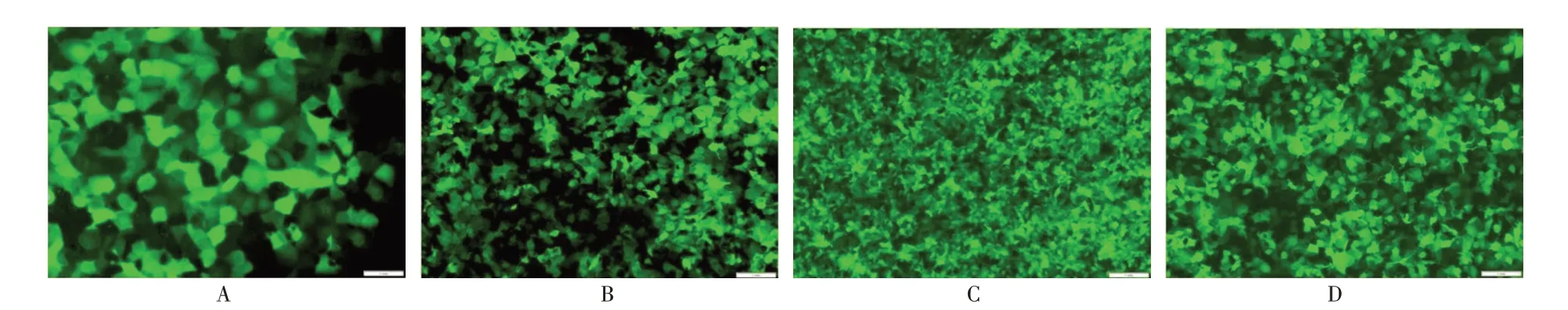
A:过表达FUT8 的阴性质粒转染至KYSE 细胞后镜下荧光成像(20×);B:过表达FUT8 的质粒转染至KYSE 细胞后镜下荧光成像(10×);C:敲低FUT8表达的阴性质粒转染至KYSE细胞后镜下荧光成像(4×);D:敲低FUT8表达的质粒转染至KYSE细胞后镜下荧光成像(10×)。
给予KYSE FUT8 组、KYSE NC 组细胞6 Gy剂量的X 线照射后,G2/M 期阻滞细胞占比情况分别是(34.29±0.47)%、(21.97±0.58)%,提示与对照组相比,FUT8 过表达组ESCC 细胞的G2/M期细胞比例显著降低,差异有统计学意义(P=0.0004,图6A);而在KYSE shNC 组、KYSEshFUT8 组细胞中,G2/M 期阻滞细胞占比情况分别是(32.56±0.27)%、(41.61±2.97)%,提示与对照组相比,FUT8 敲低组ESCC 细胞的G2/M 期细胞比例显著增加,差异有统计学意义(P=0.0004,图6B)。

图6 细胞周期实验检测FUT8 表达量的变化对ESCC 细胞放射敏感性的影响
KYSE FUT8 组、KYSE NC 组细胞经6 Gy 剂量的X 线照射后,继续培养2 周,电子显微镜下计数克隆形成细胞数目分别是(43.12±1.74)、(25.05±1.52),对比阴性对照组,FUT8 过表达组ESCC 细胞的克隆形成细胞数显著增高,差异有统计学意义(P=0.0005,图7A);KYSE shFUT8 组、KYSE shNC 组细胞中克隆形成细胞数目分别为(23.15±1.32)、(41.05±1.83),对比阴性对照组,FUT8 敲低组ESCC 细胞的克隆形成细胞数显著下降,差异有统计学意义(P=0.0005,图7B)。
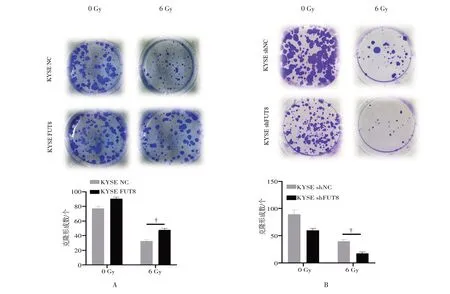
图7 克隆形成实验检测FUT8 表达量的变化对ESCC 细胞放射敏感性的影响
3 讨论
放射治疗作为食管癌综合治疗中的主要手段之一,治疗效果会因瘤体对辐射的敏感性下降而不尽人意[10]。国内外对食管癌放射抵抗机制做出了大量研究,例如有环氧化酶[11]、信号转录激活因子3[12]、X 线修复交叉互补基因[13]等,均为解决食管癌放疗相关临床问题提供了帮助。
糖基化是普遍的翻译后修饰的过程,且对蛋白质的功能有重要影响,研究表明,糖基化在肿瘤细胞的放射抵抗中能起到重要的调控作用,目前己被证实的分子有糖基转移酶C1GALT1[14]、AGL3[15]、GnT-Vl[16]等。糖基转移酶FUT8 可将GDP 岩藻糖转移至N-糖链核心结构,从而构成核心岩藻糖,对糖蛋白加工修饰,并调控其生物功能。有学者发现,在甲状腺乳头状癌中FUT8 的高表达与肿瘤的大小、转移、分化程度有着必然联系[17];在胰腺癌中FUT8 高表达的肿瘤细胞中发现大量的岩藻糖基化的触珠蛋白[18];在直结肠癌研究中,FUT8 介导的核心岩藻糖基化能够调节E-钙黏蛋白状态得到证实[19]。这些研究帮助笔者进一步了解了FUT8 在肿瘤细胞发展过程中的作用,但是对食管癌放射抵抗的影响尚不清楚。
为探索FUT8 对ESCC 细胞放射敏感性的影响。在本研究中,笔者通过体外实验采用慢病毒转染技术将ESCC 细胞KYSE 分别进行FUT8 的过表达和敲低,经X 射线处理后进行流式细胞术和克隆形成实验。结果发现:FUT8 过表达组的ESCC 细胞凋亡率呈下降趋势,阻滞在G2/M 期的细胞比例下降,克隆形成能力增强。而FUT8 敲低组的ESCC 细胞凋亡率呈上升趋势,阻滞在G2/M期的细胞比例增高,克隆形成能力减弱。因此,笔者得出结论:FUT8 过表达可以降低ESCC 细胞放射敏感性,敲低FUT8 表达可以增强ESCC 细胞放射敏感性。
综上所述,糖基转移酶FUT8 参与调控ESCC细胞放射的产生过程,可能成为解决食管癌放射抗拒问题的潜在靶点。然而在本研究中仅在一种食管癌细胞系中得到验证,下一步研究仍需在更多的细胞系中验证并探究具体通路分子机制。
