囊泡相关膜蛋白8的研究进展
2023-09-23张鑫侯雪阳综述张瑞唐景峰审校
张鑫,侯雪阳 综述,张瑞,唐景峰 审校
1.湖北工业大学生物工程与食品学院,湖北武汉430068;2.湖北工业大学科技部/教育部细胞调控与分子药物学科创新“111”引智基地,湖北武汉430068
膜融合是细胞中普遍存在的生命活动[1],如自噬、亚细胞区室化、细胞生长、激素分泌和神经传递等基本生物过程均需要快速、特异性和受调控的膜融合[2-4]。尽管细胞中存在多种膜融合类型,但融合反应具有共同特征,主要包括膜聚集、脂质双分子层直接接触、外部脂质重排导致茎的形成、茎扩张产生半融合隔膜及融合孔形成和孔扩张等步骤,最终完全融合[5]。研究发现,细胞中的膜融合过程必须有N-乙基马来酰亚胺敏感因子附着蛋白受体(soluble N-ethylmaleimide-sensitive factor attachment protein receptor,SNARE)复合物的参与,根据分布位置不同,SNARE 可分为供体膜受体蛋白(v-SNARE)和靶膜受体蛋白(t-SNARE)[6],v-SNARE 需与特定的t-SNARE 配对,形成“SNARE 复合物”来驱动细胞中不同的膜融合。SNARE 蛋白家族已有38 个成员被表征,其中囊泡相关膜蛋白8(vesicle associated membrane protein 8,VAMP8)是最重要的v-SNARE之一[7]。为更深入了解VAMP8 在膜融合中的作用及其与肿瘤发生发展的相关性,本文就VAMP8 的分子结构、转录调控和翻译后修饰、生物功能及其与人类疾病相关性的研究进展作一综述,以期为治疗相关疾病和开发有效的VAMP8靶点药物提供新思路。
1 VAMP8的生物学概述
1.1VAMP8 的分子结构VAMP8基因位于人类二号染色体的2p11.2区,包含3个外显子,跨越4 496 bp的基因组DNA。VAMP8基因的cDNA全长为679 bp,包括61 bp 的5'非翻译区(untranslated region,UTR)、315 bp 的3'UTR 和300 bp 的编码100 个氨基酸残基的多肽序列及1个终止密码子。预测VAMP8相对分子质量约为11 000,实际检测约为15 000。VAMP8包含2 个结构域,1 个是含有SNARE 基序的功能结构域,可结合其他特定的SNARE蛋白;另1个是跨膜结构域,可确保其锚定在某些生物膜上以发挥特定功能[8]。
1.2VAMP8 的表达分布 VAMP8 主要定位于内体、囊泡、溶酶体膜等各种生物膜上,是促进和辅助细胞中膜融合的关键蛋白[9]。VAMP8蛋白具有高度保守性,其在哺乳动物、两栖动物、鸟类、鱼类等物种中均有表达[10]。VAMP8蛋白在人类的结肠、胎盘、肾脏、肺及各种外分泌组织中广泛存在,并具有相应的生理功能[11-12]。
2 VAMP8的转录调控与翻译后修饰
2.1VAMP8的转录调控 转录调控是通过改变基因的转录效率以协调基因表达水平和表达时间的重要方式。目前,关于VAMP8基因转录调控机制研究的报道较少,其中一项研究表明,鼠源VAMP8基因可受CCAAT增强子结合蛋白β(CCAAT enhancer binding protein beta,CEBPB)的调控,转录因子CEBPB 是通过结合小鼠VAMP8基因的-198~-1 bp区域的DNA序列来促进其转录[13]。
2.2VAMP8的翻译后修饰
翻译后修饰是指蛋白质在生物合成后进行的化学修饰,该修饰会影响蛋白质的性质和功能,包括结构变化、定位改变、激酶活性及相互作用等。甲基化、泛素化、乙酰化、糖基化、磷酸化等翻译后修饰是细胞中最常见的修饰类型,不同种类的修饰及不同位点的同种修饰均会导致蛋白质具有不同的功能。
2.2.1VAMP8 的磷酸化 VAMP8 对囊泡与质膜的融合至关重要,但关于VAMP8 的翻译后修饰对膜融合的影响则少有研究。MALMERSJ 等[14]研究表明,VAMP8 的磷酸化对膜融合具有抑制作用,这可能是由于磷酸化导致产生空间位阻和增加磷酸基团的内部负电荷以减少SNARE 介导的融合。晶体结构显示,SNARE 复合物的可溶性部分由4 个α 螺旋(即SNARE 域)组成,VAMP8 的磷酸化位点位于这些螺旋的结合区域,为其通过磷酸化影响SNARE 介导的膜融合提供了可能[8,14]。与其相比,在突触囊泡融合中起关键作用的VAMP1、VAMP2 及VAMP3 的相应位点被突变为丙氨酸,导致其不能发生磷酸化[14]。通过对比发现,介导非突触膜融合的其他SNARE 蛋白在类似位置均存在丝氨酸和苏氨酸残基,表明非突触VAMP 具有进化上保守的内部磷酸化位点,允许通过蛋白激酶对囊泡与质膜的融合进行调控。HONG 等[15]的研究也证实,VAMP8第48 位点的苏氨酸磷酸化会抑制自噬体膜与溶酶体膜的融合。
2.2.2VAMP8 的泛素化 VAMP8 氨基酸序列存在7个赖氨酸,提示VAMP8可能具有泛素化修饰。VAMP8作为胞质分裂过程中囊泡融合所需的v-SNARE 蛋白,其可定位于对泛素化蛋白呈阳性的中央纺锤体区域,并能被信号转导接头分子的Src 同源3 结构域的相关分子(associated molecule with the SH3 domain of STAM,AMSH)和去泛素化酶8(deubiquitinating enzyme 8,USP8)进行泛素化和去泛素化调控[16]。虽然VAMP8 的功能受到胞质分裂过程中泛素化和去泛素化的调节,但VAMP8 泛素化在胞质分裂中的意义尚未明确,有待深入研究。另有研究表明,VAMP8的泛素化不会抑制其与t-SNARE蛋白的相互作用,但替换所有赖氨酸残基可能会导致VAMP8 的SNARE活性完全丧失;另外,VAMP8 可形成同型二聚体,提高泛素化VAMP8 通过非泛素化VAMP8 与t-SNARE蛋白间接相互作用的可能性[16]。
2.2.3VAMP8的其他翻译后修饰 除了磷酸化和泛素化以外,目前尚无关于VAMP8 其他翻译后修饰的报道。通过在线网站(https://services.healthtech.dtu.dk/service.php?NetNGlyc-1.0)预测发现,VAMP8 氨基酸序列存在N-X-S/T 基序,表明其可能具有N-糖基化修饰,VAMP8 主要定位在溶酶体上,但具体机制尚未明确。猜测可能是VAMP8 的糖基化修饰使其免受溶酶体蛋白酶的降解,进而长期锚定在溶酶体上,发挥其相应功能。
3 VAMP8与自噬的相关性
自噬是细胞维持稳态、降解废物和受损细胞器及进行某些正常生命活动不可缺少的重要生物过程[17-18]。VAMP8作为一种主要定位于溶酶体膜上的蛋白质参与自噬体与溶酶体融合的过程,即VAMP8能够与突触体相关蛋白29(synaptosomal associated protein 29,SNAP29)和自噬溶酶体相关基因突触融合蛋白17(SNARE protein syntaxin 17,STX17)形成SNARE 复合物,促进自噬体和溶酶体融合,进而促进自噬。
有文献报道,N-乙酰氨基葡萄糖转移酶(N-acetylglucosamine transferase,OGT)介导的SNAP29糖基化及CREB基因结合蛋白(CREB-binding protein,CRP)介导的STX17 乙酰化可影响二者与VAMP8 的结合,从而影响自噬性SNARE复合物的形成[19-20]。在营养比较丰富的条件下,哺乳动物雷帕霉素靶蛋白复合物1(mechanistic target of rapamycin complex 1,mTORC1)可与VAMP8 相互作用并将其磷酸化[15],与去磷酸化的VAMP8 比较,磷酸化的VAMP8 与SNARE 蛋白STX17 及SNAP29 的相互作用减少,最终导致自噬体和溶酶体融合受阻。通过对自噬SNARE 复合物晶体结构的解析发现,STX17的Q196、SNAP29的Q84/Q230 及VAMP8 的R37 组成了复合物中心的保守离子层,在分子层面明确阐述了自噬特异性膜融合的机制[21]。
VAMP8 作为参与自噬体与溶酶体融合的关键蛋白,与其他自噬相关蛋白存在调控和被调控的关系。VAMP8 在早期内体、细胞质膜、晚期内体、溶酶体膜上的分布处于动态平衡。研究表明,在饥饿诱导情况下,Ras 相关蛋白21(Ras-related protein 21,RAB21)和肌管蛋白相关蛋白13(myotubularin-related protein 13,MTMR13)的活性增强,促使二者与VAMP8 结合,并调节VAMP8 向溶酶体转运,进而增加VAMP8 在溶酶体的分布以促进自噬体与溶酶体的融合过程[22]。
人类自噬基因异位P 颗粒自噬蛋白5 同源基因(ectopic P-granules autophagy protein 5,EPG5)是Ras相关蛋白7(Ras-related protein 7,Rab7)效应器之一,能决定自噬体与溶酶体融合的特异性[23]。EPG5 可识别自噬体外膜上的微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)以介导自噬体的捕获和对接,并能稳定SNARE 复合物的组装,进而促进融合。VAMP8 可通过直接相互作用将EPG5 募集至溶酶体,且可能决定其在晚期内体/溶酶体微域上的空间和时间定位;而具有膜锚定基序缺失的VAMP8 突变体则会导致EPG5 定位错误,影响融合[24]。
Sec1结构域蛋白1(Sec1 family domain containing 1,SCFD1)被确定是SNARE 复合物形成和自噬体与溶酶体融合所必需的调控蛋白之一[15],是一种具有高度进化保守性的Sec1/Munc18(SM)样蛋白。SCFD1与VAMP8的相互作用导致其向自噬溶酶体募集,自噬的刺激促进了SCFD1与VAMP8之间的相互作用,从而促进了复合物的形成。在敲除SCFD1基因的细胞中,复合物的组装效率显著降低,融合过程也受阻[15]。见图1。
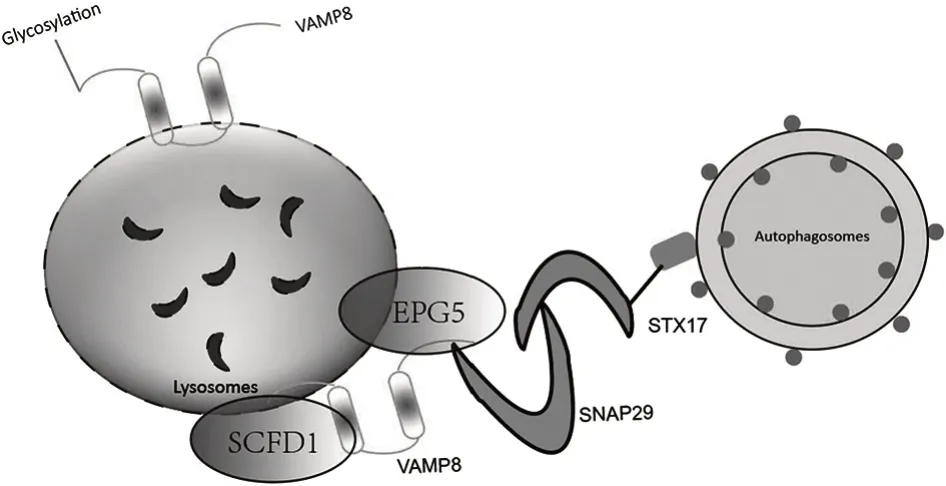
图1 VAMP8对自噬体与溶酶体融合的调控Fig.1 Regulation of autophagosome and lysosome fusion by VAMP8
4 VAMP8与胞吐作用的相关性
胞吐作用是通过分泌型囊泡与质膜的融合释放细胞内某些物质的过程,是全身细胞信号传导及物质运输的重要组成部分。VAMP8作为一种v-SNARE蛋白,在胞吐作用中发挥的功能与自噬类似,可与细胞质膜上的t-SNARE蛋白特异性结合,使囊泡膜与质膜融合,促进胞吐。参与胞吐作用膜融合过程的t-SNARE 蛋白有所不同,其中突触体相关蛋白25(synaptosomal associated protein 25,SNAP25)或SNAP23 与VAMP8、STX蛋白所形成的SNARE复合物可用于驱动调节性胞吐作用的膜融合[25]。SNAP25 一般在神经系统和神经内分泌细胞中执行上述功能,而SNAP23在其他类型的细胞中参与这一膜融合过程。
有研究证明,VAMP8 在胰腺和血小板的分泌调节中发挥重要作用[26-27]。另外,WANG 等[28]研究发现,除了在调节胰腺腺泡细胞的胞吐作用中发挥功能外,VAMP8 对唾液腺和泪腺的胞吐作用也较重要。免疫组化分析显示,VAMP8 在几乎所有的外分泌组织中广泛表达,推测VAMP8 可能是一种常见的、负责调节整个外分泌系统中胞吐作用的v-SNARE蛋白[29]。
黏蛋白对健康的影响及在疾病中的作用越来越受到重视,并被公认为是先天免疫的关键因素之一,其主要作用方式是由SNARE蛋白特异性介导的组成性胞吐。CORNICK 等[30]研究表明,VAMP8 介导的SNARE 胞吐作用是导致杯状细胞黏蛋白分泌的最终途径,在人杯状细胞系中沉默VAMP8,发现黏蛋白的组成性胞吐释放受到严重损害,而其他VAMP亚型的作用却较小。在肺上皮分泌细胞中,VAMP8的表达水平是VAMP 亚型中最高的,尽管VAMP2、VAMP3和VAMP7与分泌细胞的囊泡胞吐作用有关,但VAMP8 是参与气道杯状细胞黏蛋白颗粒胞吐作用的主要v-SNARE[30]。
VAMP8 对胞吐途径的调控可能具有选择性。在神经元细胞中,VAMP2 对突触小泡的快速释放至关重要,而VAMP8 不参与此过程[31]。通过对来自不同组织分泌细胞器的蛋白质组学分析表明,VAMP8存在于多种但不是所有的分泌囊泡中[32]。
5 VAMP8与疾病的相关性
5.1VAMP8与肿瘤发生的相关性 据报道,一些VAMP与肿瘤发生有关,如VAMP2可促进肝癌细胞凋亡并抑制增殖和侵袭;依赖于VAMP3 的膜型基质金属蛋白酶1(membrane-type matrix metalloproteinase-1,MT1-MMP)的分泌可增强细胞外基质的降解,增加细胞侵袭[33-34]。VAMP8 作为致癌基因能够加速细胞增殖,研究发现,VAMP8 参与了细胞质分裂的终末步骤,即细胞分裂过程中,2 个子细胞的中间体脱落,VAMP8 缺失会导致细胞的中间体脱落异常[35]。中间体脱落受阻会进一步导致细胞周期停滞和细胞生长减弱,这与CHEN 等[36]的研究一致,VAMP8 过表达在体外和体内均可促进细胞增殖,而敲低VAMP8可通过在G0/G1 期阻滞细胞周期来减弱肿瘤的生长。
VAMP8 具有肿瘤转移抑制功能,DIAZ-VERA等[37]研究证实,VAMP8通过促进RAB17介导的促侵袭物质neuopilin-2的胞饮,限制neuopilin-2向质膜的输送,从而抑制乳腺癌细胞的侵袭。YU 等[38]也发现,VAMP8 可通过调节RAB37 介导的抗转移物质,如基质金属蛋白酶抑制剂1(tissue inhibitor of metalloproteinase1,TIMP1)的胞吐作用在肺癌转移中发挥抑制作用,RAB37 和VAMP8 蛋白同时低表达的肺癌患者与进行性肿瘤分期有关,且预后较差。
VAMP8 在不同类型肿瘤细胞中的功能不同。VAMP8 既能作为促癌蛋白,也能作为肿瘤抑制因子发挥作用,这可能部分归因于其与不同类型肿瘤中不同结合蛋白协同作用的结果。VAMP8 的特定磷酸化修饰可调节其在不同细胞中的功能,如VAMP8的磷酸化可阻止囊泡与质膜的融合,在各种细胞中,蛋白激酶和磷酸酶的平衡可能会改变VAMP8 介导的囊泡融合,从而影响致癌进程。
5.2VAMP8 与其他疾病的相关性 VAMP8 在一些其他人类疾病中发挥作用。VAMP8 是一种新的三基序蛋白6(tripartite motif 6,TRIM6)依赖性因子,参与调节Ⅰ型干扰素的信号传导,如在西尼罗河病毒(West Nile virus,WNV)感染期间,有助于TRIM6 介导的Ⅰ型干扰素抗病毒反应[39]。在阿尔茨海默病的研究中发现,微管相关蛋白tan(microtubule associated protein tau,MAPT)会过度磷酸化,聚集并积聚在神经元的体细胞树突区室中,VAMP8 的过表达可以调控囊泡与质膜融合,进而促进晚期内体途径,显著增加了tau 蛋白的分泌,降低tau 蛋白在神经母细胞瘤细胞系中的胞内水平[40],表明VAMP8 可通过增加一些有害蛋白的分泌,防止与神经退行性疾病相关的蛋白质在细胞内积累。另外,急性胰腺炎是一种外分泌性胰腺炎疾病,被认为是由于蛋白水解酶原(最显著的是胰蛋白酶原)与酸化细胞室中的溶酶体水解酶[最显著的是组织蛋白酶B(cathepsin B,CatB)]异常混合而过早激活引起的[41]。有研究提出,VAMP8 介导的基底外侧胞吐作用是酒精相关性急性胰腺炎的潜在机制[42]。VAMP8 分泌途径的急性失调会触发细胞内胰蛋白酶积累和早期内体区室的丢失,最终导致急性腺泡性胰腺炎[26]。VAMP8 还可影响肠道的稳态,其缺乏会抑制黏蛋白2(mucin 2,MUC2)的胞吐分泌,进而改变肠道的黏液层,导致结肠杯状细胞与微生物直接接触,引起炎症反应[30]。
5.3VAMP8与耐药性的相关性 肿瘤细胞的耐药性与其自噬水平强弱显著相关[43]。有研究表明,通过上调不同肿瘤的自噬来增强对抗癌症疗法(包括放射疗法、化学疗法和靶向疗法等)的抵抗力[44-45]。VAMP8在肿瘤耐药中起重要作用,如VAMP8 通过提高自噬蛋白的表达水平和自噬体的数量来促进替莫唑胺(temozolomide,TMZ)抗性,通过干扰自噬相关基因5(autophagy-related gene 5,ATG5)或STX17进一步逆转了VAMP8 过表达细胞中的TMZ 抗性,而VAMP8 的沉默削弱了自噬通量并减轻了胶质瘤细胞中的TMZ抗性[36]。VAMP8 去磷酸化可能是肿瘤恶性的原因,而VAMP8 磷酸化在抑制癌细胞存活中起重要作用。CHEN 等[9]研究表明,VAMP8 磷酸化可能影响自噬体成熟,导致癌细胞的化疗耐药性,表明增强VAMP8磷酸化以阻止自噬体成熟可能是降低耐药性的一种有效策略。
6 小结与展望
VAMP8 的相关研究主要集中于各种生物膜的膜融合方面,其通过与靶膜表面的其他SNARE 蛋白相互作用参与各种细胞(包括白细胞和多种分泌细胞等)的内吞作用、囊泡-囊泡融合和胞吐作用等。VAMP8 的翻译后修饰及一些相互作用蛋白是调控这些膜融合过程的关键,其异常表达会导致多种疾病和肿瘤细胞的耐药性。因此,需要对VAMP8 在癌细胞中的机制展开更广泛、更深刻的研究,VAMP8有望成为一个通过调控膜融合过程来治疗相关肿瘤疾病的药物靶点。
近年,细胞外囊泡(extracellular vesicles,EVs),即微泡(microvesicles,MVs)和外泌体的相关研究受到关注,一些研究表明,v-SNARE 可能参与其中,如突触小泡蛋白同源物(synaptobrevin homolog)YKT6在外泌体分泌中发挥重要作用[46]。有研究提出,VAMP8可作为外泌体基底外侧释放的调节剂,但关于EV 释放的机制尚未明确[47],VAMP8 在外泌体中发挥的功能有待深入研究。
