分型鉴别HPIV1、HPIV2及HPIV3多重荧光定量RT-PCR方法的建立及验证
2023-09-23程子恩刘芷宁曹鹏程赵亚齐侯广争刘琪琦刘馨
程子恩,刘芷宁,曹鹏程,赵亚齐,侯广争,刘琪琦,刘馨,3
1.锦州医科大学附属第一医院,辽宁锦州121001;2.军事科学院军事医学研究院辐射医学研究所,北京100850;3.锦州医科大学葫芦岛市中心医院教学基地,辽宁锦州121001
20 世纪50 年代,Andrews 等将首次发现的与流感病毒、流行性腮腺炎病毒感染后症状相似,但与流感病毒抗原性不同,且具有独特的生物学特性的一种病毒命名为人副流感病毒(human parainfluenza virus,HPIV)。HPIV 是引起儿童、老年人、免疫抑制患者、基础营养状况差的人群呼吸道感染的重要病原体,可导致多种呼吸道疾病,包括感冒、哮吼、支气管炎、肺炎等[1-2]。在全球范围内,HPIV 是引起儿童呼吸道感染住院的第二大病原体,仅次于呼吸道合胞病毒,给各个国家带来了严重的疾病负担和公共卫生风险[3-5]。
根据HPIV的血清学及基因组特征,可分为HPIV1~4四种血清型。其中HPIV3是HPIV引起下呼吸道感染最常见的型别,然后依次为HPIV2、HPIV1和HPIV4[6-7]。HIPV4根据抗原性的不同又被分为4a和4b 2个血清亚型,引起的感染症状较轻微[8-9]。在5 岁以下儿童呼吸道感染病例中,至少有75% ~ 80%的儿童曾感染过HPIV[10]。成人12%呼吸道感染与HPIV有关[11]。虽然在结构上不同亚型HPIV 表现出高度的相似性,但各亚型病毒所致的临床特点和流行病学特征有显著差异[12]。人体感染HPIV 后不会产生完全的保护性免疫,终生均可能发生再感染,而目前尚无治疗和预防HPIV感染的特异性药物和疫苗[13-14]。
本研究选择HPIV1、HPIV2和HPIV3基因保守区域设计相应的引物及探针,以人核糖核酸酶P(RNase P)为内质控,建立同时检测HPIV1、HPIV2 和HPIV3的多重荧光定量RT-PCR 方法,并进行验证,以期在快速检测HPIV 感染的同时实现患者亚型的鉴别诊断,为临床HPIV 感染患者分型治疗提供诊断结果和理论依据。
1 材料与方法
1.1病毒、质粒及标准品 甲型流感病毒、乙型流感病毒、呼吸道合胞病毒灭活样本由军事医学研究院辐射医学研究所保存,新型冠状病毒灭活样本由该院微生物研究所提供;HPIV1、HPIV2、HPIV3 标准品购自广州邦德盛生物科技有限公司;pUC57 载体由北京博迈德基因技术有限公司提供。
1.2临床样本 192 份咽拭子样本由军事医学研究院辐射医学研究所保存并提供。本研究获得伦理委员会批准。
1.3主要试剂及仪器 5×Neoscript RT Premix Multi-UNG(Probe qRT-PCR)试剂盒购自珠海宝锐生物科技有限公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;QIAamp Viral RNA Mini Kit 购自德国QIAGEN 公司;7500 Real-Time PCR System 购自美国Applied Biosystems 公司;核酸/蛋白质荧光定量仪购自美国Unchained Labs 公司;新羿TD-1 微滴式数字PCR系统购自北京新羿生物科技有限公司。
1.4引物及探针设计 从国际公共数据库中下载HPIV1(MT232426.1)、HPIV2(LC486598.1)和HPIV3(MN145876.1)基因序列,利用DNAman 软件进行同源性分析,Primer express 3.0.1 软件进行引物及探针设计,Primer-BLAST 软件对设计的引物及探针进行特异性验证。RNase P引物及探针的设计参考美国疾病控制与预防中心引物及探针[15]。引物和探针序列见表1,由北京博迈德基因技术有限公司合成。

表1 引物及探针序列Tab.1 Primer and probe sequences
1.5重组质粒标准品的构建及核酸提取 将HPIV1、HPIV2、HPIV3 三种病毒和RNase P 的靶基因序列插入至pUC57 载体,构建重组质粒,测序后,鉴定正确的质粒分别命名为pUC57-HPIV1、pUC57-HPIV2、pUC57-HPIV3、pUC57-RNase P,该过程由北京博迈德基因技术有限公司完成。使用质粒提取试剂盒提取质粒,利用核酸/蛋白质荧光定量仪测定质粒浓度,按下式计算拷贝数。使用QIAamp Viral RNA Mini Kit提取病毒样本核酸并于-80 ℃保存。
1.6多重荧光定量RT-PCR体系的优化及标准曲线建立 多重荧光定量RT-PCR反应体系参照Neoscript RT Premix Multi-UNG(Probe qRT-PCR)试剂盒说明书配制,将HPIV1、HPIV2、HPIV3和RNase P的上下游引物及不同荧光标记的探针加入反应体系,以相同浓度重组质粒标准品为模板,采用方阵法优化引物、探针浓度。用优化好的引物及探针体系优化退火温度。将pUC57-HPIV1、pUC57-HPIV2、pUC57-HPIV3、pUC57-RNaseP重组质粒标准品原液均制备成4×108copies/mL,按1∶1∶1∶1 混匀后10 倍稀释,选取5 个浓度(103~107copies/mL)质粒标准品混合物为模板,按照优化好的反应体系和条件进行荧光PCR扩增,以浓度的对数为横坐标,Ct值为纵坐标绘制标准曲线。
1.7方法的验证
1.7.1灵敏度 用新羿TD-1微滴式数字PCR系统对HPIV1、HPIV2、HPIV3核酸进行定量后的浓度分别为1.78×105、1.11×106、2.70×105copies/mL,用ddH2O将其分别稀释至1 000、500、250 和100 copies/mL,利用建立的多重荧光RT-PCR方法进行扩增,每个浓度进行20 个重复,以95%检出率的最低浓度确定为最低检测限。
1.7.2特异性 用建立的多重荧光定量RT-PCR 方法对甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、新型冠状病毒、HPIV1、HPIV2、HPIV3 核酸进行扩增,设ddH2O为阴性对照。
1.7.3精密度 以104、105、106copies/mL 的pUC57-HPIV1、pUC57-HPIV2、pUC57-HPIV3、pUC57-RNase P重组质粒标准品混合物为模板,用建立的多重荧光定量RT-PCR方法进行扩增,每种浓度重复3次,进行组内精密度分析;选取3 个不同的时间,进行组间精密度分析;计算变异系数(CV)。
1.8方法的初步应用 使用QIAamp Viral RNA Mini Kit 试剂盒提取192 份临床样本核酸,应用建立的多重荧光定量RT-PCR方法进行检测,阳性临床样本送北京天一辉远生物科技有限公司测序,对测序结果进行比对分析。
1.9数据采集及分析 采用Graphpad Prism 8.0软件进行数据处理及绘图。
2 结果
2.1质粒标准品的构建及鉴定 重组质粒pUC57-HPIV1、pUC57-HPIV2、pUC57-HPIV3、pUC57-RNase P经核酸/蛋白质荧光定量仪检测后的浓度分别为80、79、154、42 ng/µL,换算成拷贝数分别为2.43×1012、2.40 × 1012、4.68 × 1012、1.27 × 1012copies/mL,作为多重荧光定量RT-PCR的标准品。
2.2多重荧光定量RT-PCR体系的优化及标准曲线经优化后,确定反应体系为30µL,其中10×Neoscript-RTase/UNG Multi mix 3 µL,5 × Neoscript RT Premix Multi Buffer 6µL,HPIV1、HPIV2、HPIV3(100µmol/L)上下游引物各0.1 µL,HPIV1、HPIV2、HPIV3探针(100 µmol/L)各0.05 µL,RNase P上下游引物(50µmol/L)各0.06µL,RNase P探针(50µmol/L)各0.03 µL,模板15 µL,ddH2O 补至30 µL。反应条件:50 ℃20 min,95 ℃3 min;95 ℃15 s,54 ℃30 s,共45 个循环,每个循环退火时收集荧光信号。
将pUC57-HPIV1、pUC57-HPIV2、pUC57-HPIV3、pUC57-RNase P重组质粒标准品10 倍稀释后作为模板,经多重荧光定量RT-PCR 扩增,标准曲线方程分别为:y=-3.557x+47.153,R2=0.996 5,扩增效率(E)=91%;y=-3.385x+47.315,R2=0.995 2,E=96%;y= -3.495x+ 47.315,R2= 0.995 5,E= 97%;y=-3.306x+43.556,R2=0.993 4,E=112%。见图1。表明4 种质粒标准品在103~ 107copies/mL 范围内与Ct值呈良好的线性关系。
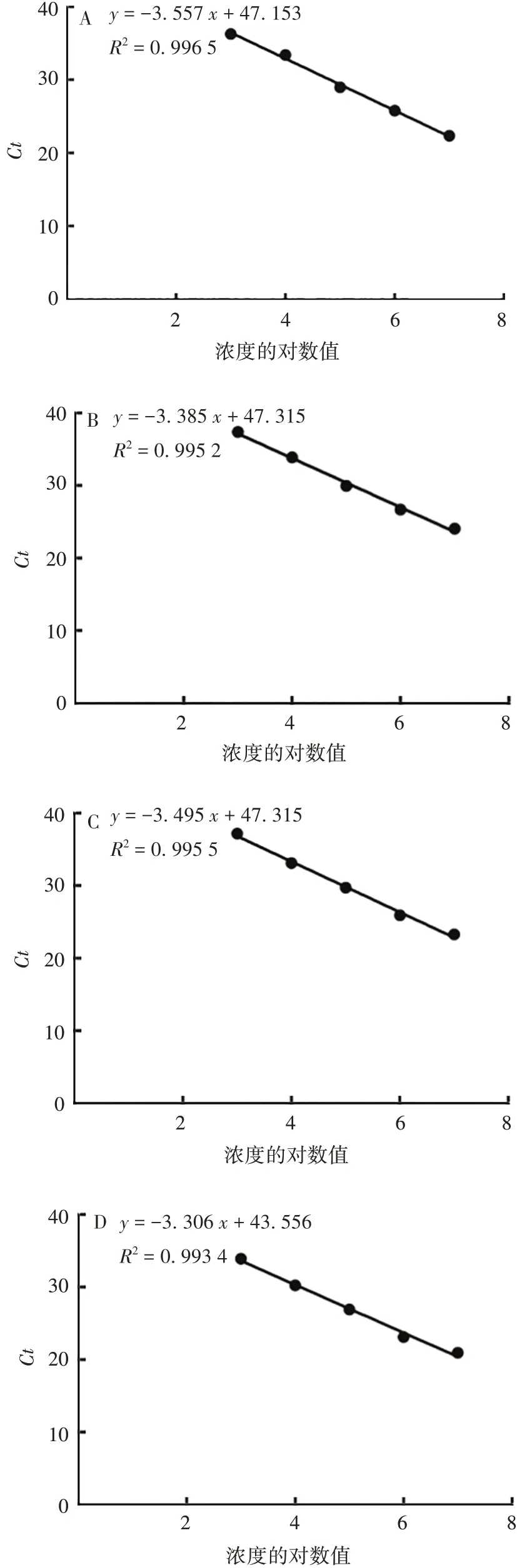
图1 pUC57-HPIV1(A)、pUC57-HPIV2(B)、pUC57-HPIV3(C)、pUC57-RNase P(D)重组质粒标准品的多重荧光定量RT-PCR标准曲线Fig.1 Standard curves of multiplex real-time RT-PCR assay for recombinant plasmid standards of pUC57-HPIV1(A),pUC57-HPIV2(B),pUC57-HPIV3(C)and pUC57-RNase P(D)
2.3方法的验证
2.3.1灵敏度 建立的多重荧光定量RT-PCR 方法对HPIV1、HPIV2 和HPIV3 的最低检测限均能达到500 copies/mL,见表2。
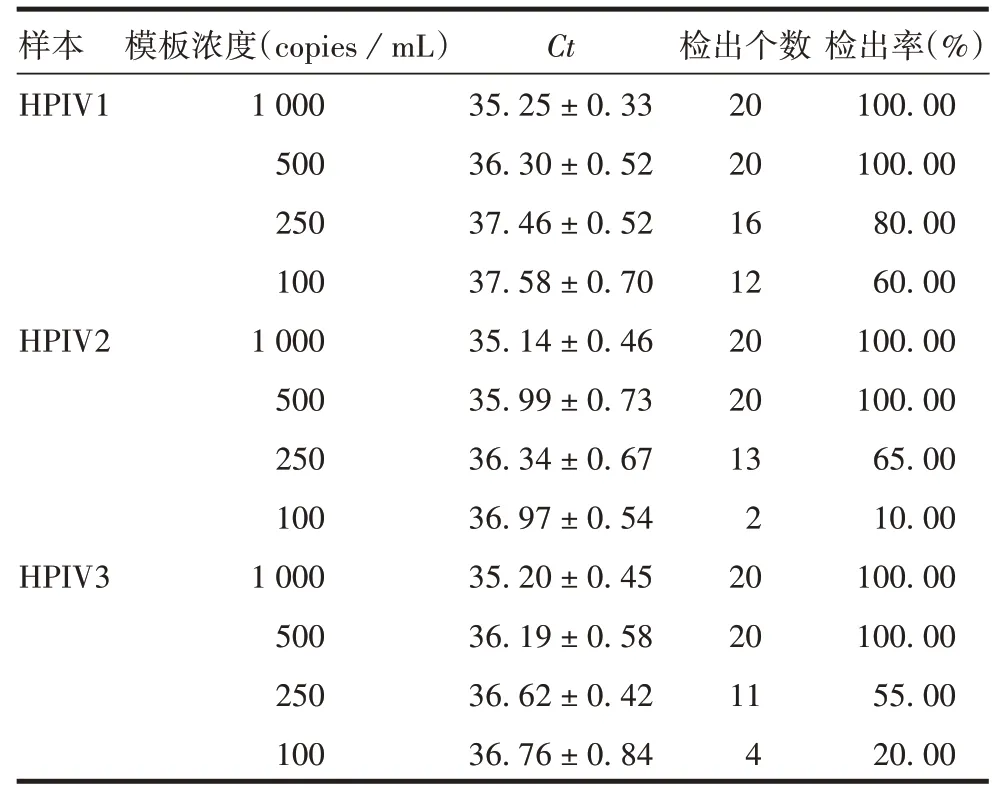
表2 灵敏度验证结果(x±SD,n=20)Tab.2 Results of sensitivity verification(x±SD,n=20)
2.3.2特异性 建立的多重荧光定量RT-PCR 方法仅对HPIV1、HPIV2、HPIV3核酸的扩增结果为阳性,见图2。表明该方法特异性较强。
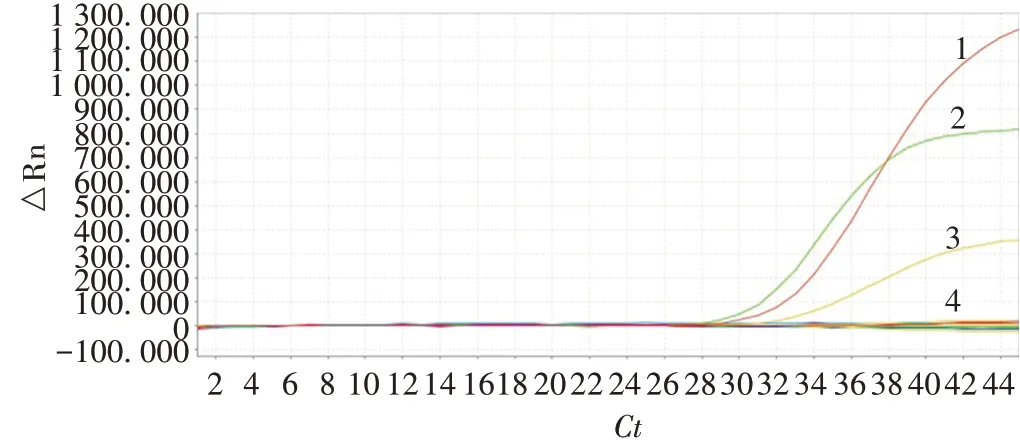
图2 方法的特异性验证Fig.2 Verification for specificity
2.3.3精密度 3 种浓度的pUC57-HPIV1、pUC57-HPIV2、pUC57-HPIV3、pUC57-RNase P重组质粒标准品混合物多重荧光定量RT-PCR 检测结果的组内和组间CV均小于3%,见表3。表明该方法精密度较好。
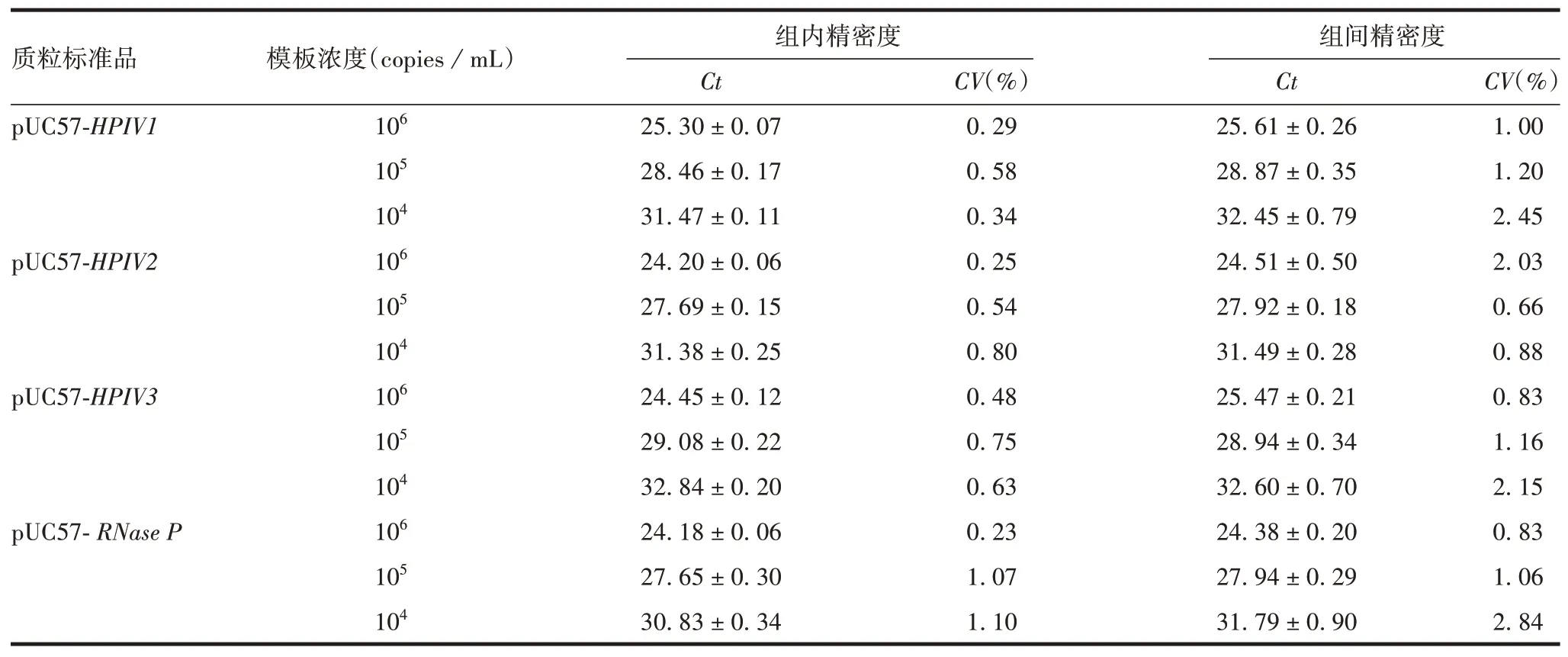
表3 精密度验证结果(x±SD,n=3)Tab.3 Results of precision verification(x±SD,n=3)
2.4方法的初步应用192份临床样本中,检出HPIV1阳性15 份,阳性率7.81%;HPIV2 阳性1 份,阳性率0.05%;HPIV3 阳性6 份,阳性率3.1%。阳性样本测序结果与本方法检测结果一致。表明建立的方法可用于临床样本的检测。
3 讨论
HPIV是导致儿童下呼吸道感染的重要病原体[16-17]。其引起的主要疾病有咽扁桃体炎、支气管炎、肺炎、喉炎、肺炎等。不同亚型的HPIV 引起的临床疾病及临床表现不同,HPIV1、HPIV2是引起急性支气管、支气管肺炎的主要亚型,表现为鼻塞、肌痛、关节痛,较少有发热[18]。HPIV3是引起咽扁桃体炎、喉炎的主要亚型,表现为咳嗽、鼻炎等,多出现发热[19-20]。流感病毒和副流感病毒感染的诊断极为相似,难以区分。因此,建立一种能够快速准确区分HPIV 亚型的诊断方法对HPIV的临床治疗具有重要意义。
对于HPIV 的检测,传统方法如病原体分离培养鉴定,存在费事费力等缺陷,难以满足临床快速诊断的要求。而免疫学检测存在窗口期且灵敏度和特异性略低[21]。荧光定量RT-PCR 作为一种快速、灵敏、特异的检测方法,在临床实验室中得到了广泛应用,但其检测项目单一,无法满足临床诊断需求。多重荧光定量RT-PCR 法可在1 个反应体系中同时检测多个目的基因,具有简便、经济、高效等优点[22]。但多重荧光定量RT-PCR体系中存在多对引物和探针,会对扩增体系造成抑制作用或降低灵敏度,需要对引物和探针组合及反应体系进行优化。PCR 反应的内质控与样本同样参与检测全过程,实施对每一份样本的监控职责[23]。RNase P 是人体各组织器官细胞中普遍存在的一种酶,对于人源性样本的RNA 检测,RNase P可作为内质控使用。
本研究通过筛选特异性引物及探针,优化反应条件,建立了一种用于检测HPIV1、HPIV2、HPIV3的多重荧光定量RT-PCR方法,该方法特异性强,与甲型流感病毒、乙型流感病毒、呼吸道合胞病毒、新型冠状病毒无交叉反应,最低检测限为500 copies/mL;3种浓度的重组质粒标准品混合物的组间和组内CV均低于3%,精密度较好。本研究建立的多重荧光定量RT-PCR 方法可用于临床呼吸道感染患者的早期筛查,与传统检测方法相比,具有高灵敏度、高分辨、快速甄别等特点,不仅可有效提高临床检测效率,也能明确感染的病原体类型,为临床快速鉴别诊断HPIV 及其精准治疗提供了诊断结果和理论依据,对防治HPIV 感染和保护公共卫生安全具有重要意义。综上所述,本研究建立了HPIV1、HPIV2 和HPIV3 多重荧光定量RT-PCR 检测方法,可用于HPIV 感染及其亚型的鉴别诊断。
