戊型肝炎疫苗效力国家参考品的制备
2023-09-23高帆卞莲莲毛群颖梁争论吴星
高帆,卞莲莲,毛群颖,梁争论,吴星
中国食品药品检定研究院国家卫生健康委员会生物技术产品检定方法及其标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室,北京102629
戊型肝炎病毒(hepatitis E virus,HEV)是一类无包膜的RNA 病毒[1],为引起戊型肝炎的病原体[1-2]。与人类相关的HEV有4个基因型,均属于同一血清型[3]。其中基因1和2型仅感染人类,基因3和4型为人畜共患病原[3-4]。世界卫生组织(World Health Organization,WHO)数据显示[4],在世界范围内每年至少有2 000万人感染HEV,其中约330 万人会出现戊肝症状,2015年戊型肝炎导致约4.4万人死亡,占病毒性肝炎死亡率的3.3%。有报道显示,自2014 年以来,南苏丹一直报告HEV 暴发,2020—2021 年共报告1 420 例疑似病例[5]。我国80年代在新疆地区暴发了戊型肝炎,导致12余万人发病,随后一直以散发为主[6]。
疫苗是控制疫情传播的有效手段[7-8]。我国厦门万泰沧海生物技术有限公司(简称厦门万泰)研制的大肠埃希菌表达的重组戊型肝炎疫苗(简称戊肝疫苗)的Ⅲ期临床试验结果显示,48 693 名受试者接种3针疫苗的保护率达100%[9],随访结果显示,接种疫苗5 年后预防戊型肝炎的保护效果仍维持较高水平(86.8%)[10]。最终于2012 年在中国获批上市[11]。另外,长春生物制品研究所有限责任公司研制的戊肝疫苗也已完成Ⅱ期临床试验;国药中生生物技术研究院有限公司(简称中生)、兰州生物制品研究所有限责任公司(简称兰州所)和智飞北京绿竹生物制药有限公司也在积极研制戊肝疫苗[12-14]。国外葛兰素史克公司以昆虫杆状病毒表达系统生产的戊肝疫苗已完成Ⅱ期临床[12-14]。
疫苗效力是疫苗质量控制的主要指标[15]。WHO戊肝疫苗指导原则要求[11],应研制并应用戊肝疫苗效力参考品对戊肝疫苗效力进行质量控制,但目前尚无WHO 国际标准品可以使用。本研究依据WHO要求,由中国食品药品检定研究院(简称中检院)牵头,联合戊肝疫苗生产和研发企业研制戊肝疫苗效力国家参考品,以保证我国已上市戊肝疫苗效力一致性,并为在研阶段的戊肝疫苗提供可靠、可比、统一的效力标准物质。
1 材料与方法
1.1候选参考品 候选参考品原料由厦门万泰提供,依据《中国药典》三部(2020 版)和《戊型肝炎疫苗制造及检定规程》(YBS01402011)制备,为以大肠埃希菌为表达系统获得的HEV ORF2 p239(368~606 aa)原液(批号:20150801F4)加入铝佐剂制备而成的戊肝疫苗半成品(批号:20151127)。原液和半成品经检定均符合规定。加入冻干保护剂后,由北京天坛生物制品股份有限公司进行分装及冻干,制备成候选国家参考品,水分为1.7%。
1.2疫苗 2批戊肝疫苗分别由厦门万泰(表达系统为大肠埃希菌,ORF2 区段为368 ~ 606 aa,HEV 1型[12])和兰州所(表达系统为大肠埃希菌,ORF2区段为368~617 aa,HEV 1型[12])制备。
1.3实验动物 SPF 级BALB/c 小鼠,雌性,6~8 周龄,购自中检院实验动物资源研究所,合格证号:11400500014037。本实验均以科研为目的对BALB/c小鼠进行养殖和使用,且按照中检院动物伦理相关规定进行[中检动(福)2016(B)008号]。
1.4主要试剂及仪器 5%乳糖、1.25%山梨醇、10%蔗糖、2%明胶、5%海藻糖和2%右旋糖苷均购自美国Sigma-Aldrich 公司;戊型肝炎抗原检测试剂盒(酶联免疫吸附法)购自北京万泰生物药业股份有限公司;戊肝疫苗效力检测试剂盒购自厦门万泰;电感耦合等离子体光谱(型号:Thermo iCAP 7400 Duo)购自美国Thermo公司。
1.5冻干保护剂的选择 候选参考品原料中分别添加不同的冻干保护剂,配方共4种:5%乳糖+1.25%山梨醇、10%蔗糖、10%蔗糖+2%明胶、5%海藻糖+2%右旋糖苷。用抗原检测试剂盒检测不同冻干保护剂制备的样品冻干前、后抗原含量。以冻干前的候选参考品原料抗原含量为基点,按下式计算各配方冻干前、后的抗原含量保留率。选取抗原保护性及赋形效果好的配方作为戊肝疫苗的冻干保护剂。
1.6均匀性检测 在分装的前、中、后3个阶段,共取28 瓶候选参考品进行装量均匀性检测;取25 瓶候选参考品,按标准操作程序(standard operating procedure,SOP)解离后,采用戊型肝炎抗原检测试剂盒(酶联免疫吸附法)进行抗原均匀性检测;取25 瓶候选参考品,采用原子光谱吸收法(电感耦合等离子体光谱)进行铝含量均匀性检测。
1.7稳定性检测
1.7.1加速稳定性 随机抽取候选参考品9瓶,每瓶间隔1 周放入37 ℃孵箱(孵育时长分别为0~8 周),8 周后检测半数有效量(median effective dose,ED50):将候选参考品用0.5 mL 灭菌注射用水复溶后,使用铝佐剂适当稀释,选取1.6、0.4、0.1、0.025 μg 共4个剂量经腹腔接种BALB/c 小鼠,10 只/组,并设铝佐剂对照组。初次免疫后28 d 摘眼球采血,2 ~8 ℃,3 000×g离心10 min,分离血清,采用戊肝疫苗效力检测试剂盒检测抗体水平,按试剂盒SOP 操作。酶标仪检测波长A450/630。Cutoff 值:阴性对照A均值< 0.05 时,按0.05 计算;阴性对照A均值≥0.05时,以实际数值计算。
1.7.2复溶稳定性 随机抽取21 瓶候选参考品,分为7 组,3 瓶/组。使用0.5 mL 无菌注射用水复溶后置于2~8 ℃,分别放置1~7 d 后同时进行抗原含量检测,并以抗原含量基点值为标准,按下式计算抗原含量保留率。
抗原含量保留率(%)=各时间点抗原含量平均值/抗原含量基点值×100%
1.8协作标定 依据WHO 指导原则[11,16]以及《中国药典》三部(2020版)的相关要求,由中检院肝炎室牵头,联合厦门万泰、中生和兰州所进行协作标定,4个协作实验室随机编号为lab1 ~ 4。中检院负责分发候选参考品和戊肝疫苗效力检测试剂盒,4个协作实验室按统一SOP 对候选参考品进行3 ~ 6 次独立试验。另外,2 家协作实验室(lab2 和lab4)各检测自制的1批戊肝疫苗。
1.10数据采集与分析全部检测原始数据汇总至中检院,由中检院按Reed-Munch 法计算ED50。候选参考品ED50检测结果小于1.0µg时为有效数据。采用Microsoft Office Excel 软件计算平均值、变异系数(coefficient of variation,CV)和95%置信区间等。
2 结果
2.1冻干保护剂的选择 试验结果显示,明胶会干扰HEV 抗原含量的检测,使抗原含量上升至216%;5%乳糖+ 1.25%山梨醇和10%蔗糖冻干后抗原含量下降较多,分别为候选标准品冻干前的55%(CV=2.9%)和83%(CV= 12.9%);5%海藻糖+ 2%右旋糖酐抗原含量保留率最高(93%),且具有良好的赋型效果。见表1。最终确定5%海藻糖+2%右旋糖酐为冻干保护剂配方。
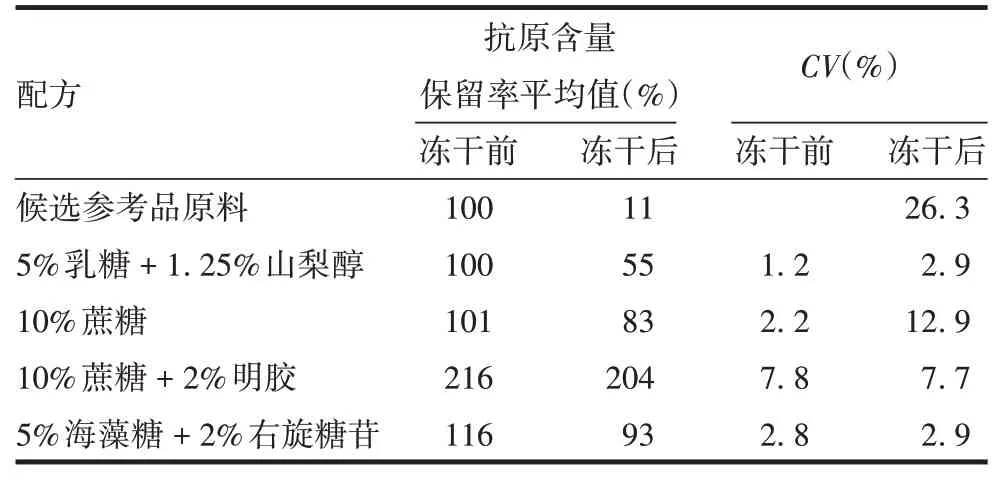
表1 不同配方冻干保护剂检测结果Tab.1 Results of lyoprotectant in different formulations
2.2候选参考品检定及关键参数检测 分装前、中、后3 个阶段的28 瓶候选参考品的装量平均值为0.531 g/瓶,分装精度为0.7%;25 瓶候选参考品的抗原平均值为7 618 YU/mL,CV为9.0%,该结果也为抗原含量基点值,用于后续复溶稳定性研究;25瓶候选参考品的铝含量平均值为5.67 mg/mL,CV为4.0%。
2.3候选参考品的稳定性
2.3.1加速稳定性 候选参考品于37 ℃条件下放置0 周的ED50为0.45µg,放置1~8 周的ED50为0.29~0.81µg,各时间点ED50均小于1.0µg,见图1。表明候选参考品具有较好的加速稳定性。
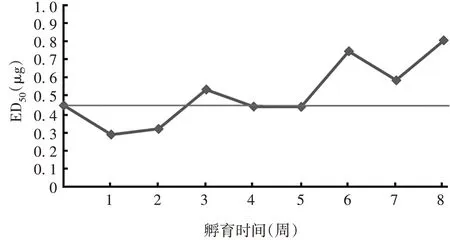
图1 候选参考品加速稳定性试验结果Fig.1 Result of accelerated stability test of candidate reference material
2.3.2复溶稳定性 候选参考品复溶后于2~8 ℃保存1~7 d,各时间点抗原含量保留率为91%~104%,见表2。提示候选参考品具有较好的复溶稳定性,可满足实验室实验操作时的短期贮存要求。

表2 复溶后2~8 ℃的稳定性结果(%,n=3)Tab.2 Stability after reconstitution and storage at 2 ~ 8 ℃(%,n=3)
2.4协作标定 共获得18个有效数据。候选标准品ED50均值为0.15µg(95%置信区间为0.12~0.18µg),实验室内CV为30.8%~64.2%,实验室间CV为32.6%,见表3。

表3 协作标定结果Tab.3 Results of collaborative calibration
2.5适用性 2 家实验室自行研制的戊肝疫苗与候选参考品平行检验均表现出良好的剂量效应关系,阳转率均随疫苗抗原含量减少而降低,下降曲线形态相近,见图2。

图2 两种戊肝疫苗与候选参考品的ED50适用性结果Fig.2 ED50 of two hepatitis E vaccines and candidate reference material in verification for suitability
3 讨论
上市后批签发疫苗与Ⅲ期临床试验用疫苗的效力一致性,是疫苗安全、有效的基础。有研究对厦门万泰生产的基因戊型肝炎疫苗(大肠埃希菌)ED50比较发现[17],Ⅲ期临床试验用5 批疫苗与2012—2016年16 批批签发疫苗的体内效力具有较好的一致性,提示上市后批签发疫苗可达到临床试验用疫苗所验证的保护效果。5 年间该疫苗的关键质控参数趋势分析结果显示[17],16 批疫苗均未发现超趋势(out of trend,OOT)情况,表明疫苗批间质量一致性较好,生产工艺及质量稳定。因此,本研究选择厦门万泰制备的1批戊肝疫苗为候选参考品原料制备国家参考品。
研究显示,戊肝疫苗(含铝佐剂)暴露于-10 ℃以下会导致抗原结构完整性和生物效力丧失[18-20]。为保证候选参考品稳定性和长期低温保存(-20 ℃)的需求,本研究选择冻干品为候选参考品剂型并对冻干保护剂配方进行筛选。结果显示,5%海藻糖+2%右旋糖酐冻干后抗原含量保留率最高,且具有良好的赋型效果,作为最优配方冻干后,候选参考品均匀性和水分含量符合质量控制要求。稳定性结果显示,候选参考品具有较好的加速稳定性和复溶稳定性。
各实验室采用统一SOP 分别对候选参考品进行小鼠ED50检测的协作标定和适用性研究。协作标定结果显示,ED50均值为0.15 µg(95%置信区间为0.12~0.18µg),实验室内CV为30.8%~64.2%,实验室间CV为32.6%。虽然按照统一SOP 实施协作标定,但仍出现较高CV,提示以动物试验为基础的效力试验存在一定检测误差,也表明单一ED50检测结果难以进行横向比较。适用性结果显示,2家实验室自行研制的戊肝疫苗与候选参考品的剂量效应关系趋势相近,提示候选参考品与现有戊肝疫苗具有相近的小鼠免疫特性。采用相对效力计算待测疫苗ED50与参考疫苗ED50的比值对疫苗进行质量控制,可减少动物试验误差[21-22]。本研究将使用候选参考品作为ED50检测时的实验质控,在未来多批次批签发中对待测样品检测结果进行相对效力计算,期望在积累足量数据的基础上,在质量控制中逐步使用相对效力替代ED50值,确保戊肝疫苗效力评价的准确性和可比性。另外,在3R 原则的指导下,WHO 及各国药品监管部门均鼓励开展体外效力替代体内效力方法的研究[15,23-25],近期戊肝疫苗抗原国家标准品已成功建立[26],规范并统一了我国戊肝疫苗抗原活性单位,结合本研究制备的戊肝疫苗效力国家参考品,为戊肝疫苗体外效力替代体内效力方法奠定了基础[24]。
