百里醌调控NLRP3 炎症小体对帕金森病模型神经炎症的抑制作用研究
2023-09-23葛淑丽董健健徐陈陈
葛淑丽,董健健,徐陈陈,程 楠
(1.安徽中医药大学研究生院,安徽 合肥 230038;2.安徽中医药大学神经病学研究所附属医院,安徽 合肥 230061)
帕金森病(Parkinson's disease, PD)是一种以黑质多巴胺能神经元死亡丢失为基本病理改变的中枢神经退行性疾病,临床上常发病于中老年人[1]。我国为人口大国,随着人口老龄化进程的日趋加重,我国帕金森病的患病率正处于急剧上升的阶段,给整个社会带来严峻的挑战[2]。PD 的发病机制复杂、涉及多种途径和机制,异常的蛋白质动力学、线 粒 体 功 能 障 碍、神 经 炎 症 等 会 促 进PD 发 展[3,4]。研究发现PD 神经炎性损伤与过度活化的小胶质细胞有密切联系[5]。激活状态下的小胶质细胞会产生炎症因子,这些促炎细胞因子可在神经炎症进程中经由受体依赖的细胞凋亡途径加重神经元的损伤[6,7]。
百里醌(thymoquinone, TQ)分离于草本植物黑种草子,并被纯化成有效活性的单体,已证实有抗肿瘤、抗炎、抗凋亡等作用[8,9]。课题组前期研究发现,TQ 能激活Nrf2 通路上调抗血红素加氧酶1蛋白的表达,减轻细胞凋亡,延缓PD 的发生[10]。但这些研究尚不能阐明TQ 对实验性PD 神经炎性损伤的具体疗效机制。该研究用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)诱导PD 小鼠模型和脂多糖(lipopolysaccharide, LPS)联合MPP+构建PD 神经炎症模型,观察TQ 对NLRP3 炎症小体的影响和SH-SY5Y 细胞损伤,研究TQ 治疗PD 神经炎性损伤的作用机制。
1 材料
1.1 动物
由杭州子源实验动物科技有限公司引进的C57BL/6 小鼠,生产许可证号:SCXK(浙)2019-0004,在SPF 级实验动物中心由专人专职负责饲养、传代繁殖。
环境温度25 ℃左右,正常光照,常规鼠类饲料喂养与自由饮水。实验所需的实验小鼠月龄在2~3 月龄。动物实验由中国科学院合肥物质科学研究院动物伦理委员会(IACUC19001)审核通过。
1.2 细胞与药物
小胶质细胞(BV-2)和人神经母细胞瘤(SH-SY5Y)细胞购自合肥苗茁生物科技有限公司;Sigma(美国圣路易斯)公司购买了TQ(纯度99%,货 号MKCC0600)、MPP+(纯 度≥98%, 货 号0000134347)、MPTP(纯 度≥98%, 货 号SLCJ8770)。
1.3 试剂
MEM 培 养 基( 美 国 Gibco 公 司,货 号2323185);F-12 培 养 基(美 国Gibco 公 司,货 号2277085);胎 牛 血 清( 美 国 Gibco,货 号2305262RP);ELISA 试剂盒(江莱生物技术股份有限公司,货号JL18442)。 NLRP3、Caspase-1 抗体(英国 Abcam 公司,货号分别为ab263899、ab1872),ASC、IL-1β 抗体(成都正能生物技术有限责任公司,货号分别为340097、511369),Caspase-3(英国 Abcam 公司,货号ab4051),Bcl-2、Bax 抗体(成都正能生物技术有限责任公司,货号分别为381702、380709)。酪氨酸羟化酶(TH)、α-突触核蛋白(α-Synuclein,α-Syn)抗体(美国CST 公司,货号分别为2792S、2642S)
1.4 实验仪器
超净台(型号SW-CJ-1F):苏州净化设备公司;CO2培养箱(型号GOLD-SIMW200IR):美国SIM公司;旷场实验视频分析系统(荷兰Noldus 公司);小动物转棒JLBehv-RRT(上海吉量软件技术有限公司);酶标仪(型号Bio Tek Epoch2):美国伯腾仪器(Biotek )有限公司;电泳仪(型号 Pow-erpac Basic):美 国 伯 乐(Bio-Rad)公 司;纯 水 机(型 号FBZ2001-UP-P):青岛富勒姆科技有限公司。
2 方法
2.1 PD 小鼠模型的构建
采用30 mg/kg-MPTP 连续5 d 皮下注射C57BL/6 小鼠建立PD 小鼠模型[11]。
2.1 分组及给药方法
将雄性C57BL/6 小鼠喂养7 d 后,随机分为对照组、对照+TQ 组、模型组、模型+TQ 组。(1)对照组C57BL/6J 小鼠予等体积生理盐水腹腔注射,每天1次,连续5 d;(2)对照+TQ 组:C57BL/6J 小鼠腹腔注射百里醌(10 mg·kg-1·d-1),持续5 d。(3)模型组:C57BL/6J 小鼠皮下注射30 mg/kg 的MPTP,持续5 d。(4)模 型+TQ 组:MPTP 给 药 前60 min,C57BL/6J 小鼠在腹腔内注射TQ (10 mg·kg-1·d-1),持续5 d。
2.2 行为学检测小鼠运动功能
(1)旷场实验:评估小鼠的自主行为。实验开始时,室内保持安静,实验小鼠的行为结果要尽量避免受到人为因素的影响。将小鼠放入观察箱中,在安静的环境下连续录像10 min,训练3 d。第4 天进行测试,记录其旷场内中央路程与中央时间及边上路程与边上时间。
(2)转棒实验:评价小鼠的四肢运动协调能力,实验前将小鼠在转棒上以5~10 r/min 的速度训练5 min,使小鼠能够在转轴上爬行。根据预实验的结果设定速度30 r/min 检测5 min。训练3 d,第4天记录小鼠在棒时间。每只小鼠进行3 次试验,每两次试验间隔1 h,取3 次成绩的平均值,记入本次试验成绩。
2.3 细胞培养及传代
在5%CO2, 37 ℃的培养箱中培养BV-2 和SH-SY5Y 细胞,细胞生长至密度约为80%传代,每2~3 天传代1 次。
2.4 细胞条件培养
根据相关文献采用细胞条件培养[12]。将BV-2细胞分为对照组、模型组、模型+TQ 组、阳性对照组MCC950[13]。对照组不做处理;模型组以0.1 μg/mL LPS[14]诱导3 h,置换含100 μmol/L MPP+的培养液继续培养8 h,建立PD 神经炎性模型。TQ 组先以含LPS 的培养基培养3 h,置换含0.25 μmol/L, 0.5 μmol/L TQ 的培养液继续培养12 h,弃培养液用含100 μmol/L MPP+的培养作用8 h。阳性对照组以含LPS 的培养液培养3 h,置换含0.1 μmol/L MCC950 的培养液培养1 h,弃培养液用含MPP+的培养液培养8 h。各组干预后用MEM/F12 完全培养液置换原培养液,作用24 h,收集各组细胞上清作用SH-SY5Y 细胞24 h。
2.5 MTT 检测MPP+和TQ 对BV-2、SH-SY5Y 细胞增殖的影响
将BV-2、SH-SY5Y 细胞分别铺板于96 孔板,密度为2×104个/孔。当细胞生长至70%时,每组加入所需培养液100 μL,作用时间结束后,每孔加入MTT 溶液20 μL(避光操作),放于CO2恒温培养箱的培养箱中培养3 h 后,每孔加入150 μL DMSO溶液作用5 min(避光操作),450 nm 吸光度OD 值用酶标仪测定。
2.6 酶联免疫吸附试验
对状态良好的BV-2 细胞进行消化收集传代,设对照组、模型组、模型+TQ 组,放于恒温培养箱中培养24 h,当细胞长至90%进行干预,正常组加MEM 培养液,模型组加入100 μmol/L MPP+,TQ组加入0.25 μmol/L、0.5 μmol/L TQ 培养液处理12 h 后加入100 μmol/L MPP+作用8 h。按照说明书进行ELISA 操作。吸光度OD(450 nm)值由酶标仪测定。
2.7 TUNEL 法检测条件培养SH-SY5Y 细胞的凋亡情况
按5×105个/mL 的密度将SH-SY5Y 细胞铺板于置有爬片的6 孔板内,分为对照组、模型组、模型+TQ 组、阳性对照组进行干预。干预结束PBS 洗涤,多聚甲醛室温固定20 min。按试剂盒说明书进行TUNEL 染色,采用Image J 软件对图像进行定量分析。
2.8 Western blot 法检测蛋白表达水平
提取小鼠中脑组织和消化收集各组细胞,加入RIPA 裂解液和PMSF 混合液,每隔10 min 在冰浴摇床上进行30 min 的裂解混合。 4 ℃, 12 000 r/min 离心30 min,取上清,加入蛋白上样缓冲液后,立即采用100 ℃水浴加热8 min, -80 ℃冰箱保存备用。电泳后将蛋白转移到NC 膜上。快速封闭液封闭25 min,加入TH、α-Syn、NLRP3、Caspase-1、ASC、IL-1β、Caspase-3、Bcl-2、Bax 一抗4℃孵育过夜(均按1∶1 000 稀释),PBST 摇床漂洗6 次,5 min/次。二抗液中放入NC 膜(1∶10 000),37 ℃温育1.5 h,PBST 摇床漂洗6 次,5 min/次。A、B 液在显影工作液中1∶1 配比,NC 膜放在显影仪器仓内曝光,通过ImageJ 软件进行图像扫描运算处理。
2.9 统计学方法
采用SPSS 23.0 软件进行统计分析,每项实验数据以均数±标准差(±s)表示,两组之间的比较采用独立样本t检验,多组之间的比较采用单因素方差分析。P<0.05 表示差异有统计学意义。
3 结果
3.1 TQ 对PD 小鼠模型行为学的影响
旷场实验结果显示:与对照组相比,模型组中央路程与中央时间减少,边上路程与边上时间增加(P<0.01);与模型组相比,模型+TQ 组中央路程与中央时间增加,边上路程与边上时间显著减少(P<0.05)。见表1。转棒结果显示:与对照组相比,模型组小鼠在棒时间明显减少(P<0.01);与模型组比较,模型+TQ 组能显著提高小鼠的在棒时间(P<0.01)。见表2。

表1 旷场实验 (n=10)Tab 1 Open field(n=10)
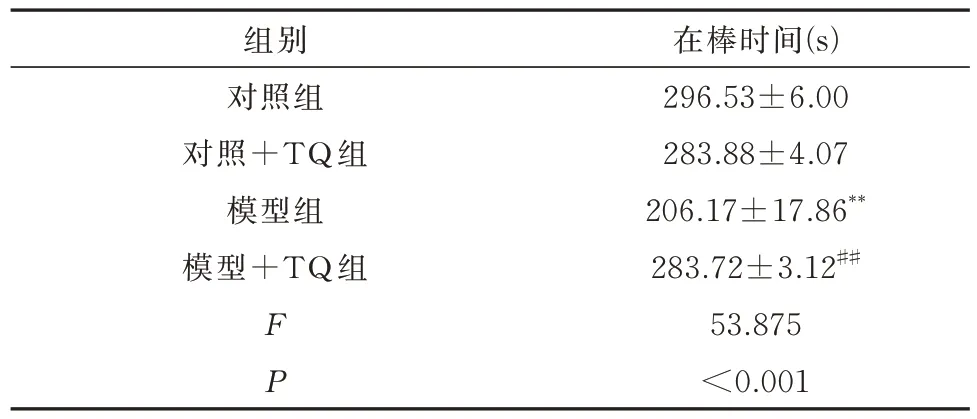
表2 转棒实验(n=10)Tab 2 Rotarod experiments(n=10)
3.2 TQ 对PD 小鼠模型多巴胺能神经元缺失的影响
观察TQ 对MPTP 诱导的DA 能神经元损伤的影响,Western Blot 检测TH、α-Syn 蛋白表达。结果显示:模型组小鼠TH 的表达水平显著降低(P<0.01),模型+TQ 组可恢复TH 的蛋白水平(P<0.01);模型组小鼠α-Syn 表达显著增加(P<0.01);而模型+TQ 组α-Syn 表达显著减少(P<0.01)。见图1、表3。

图1 小鼠中脑TH, α-synuclein 蛋白的表达(n=6)Fig 1 TH and α-synuclein protein expression in mouse midbrain (n=6)
表3 各组小鼠TH、α-synuclein 表达比较(n=6,±s)Tab 3 Comparison of TH and α-synuclein expression in mice of each group(n=6,±s)
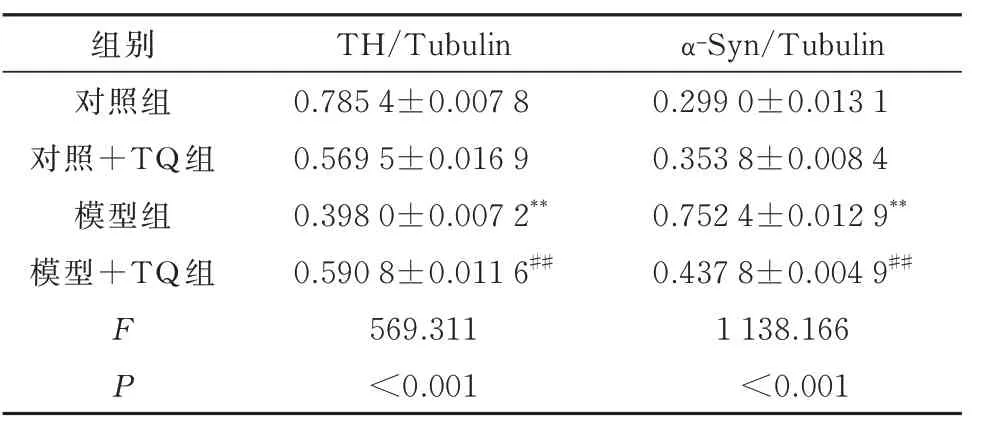
表3 各组小鼠TH、α-synuclein 表达比较(n=6,±s)Tab 3 Comparison of TH and α-synuclein expression in mice of each group(n=6,±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别对照组对照+TQ 组模型组模型+TQ 组FP TH/Tubulin 0.785 4±0.007 8 0.569 5±0.016 9 0.398 0±0.007 2**0.590 8±0.011 6##569.311<0.001 α-Syn/Tubulin 0.299 0±0.013 1 0.353 8±0.008 4 0.752 4±0.012 9**0.437 8±0.004 9##1 138.166<0.001
3.3 TQ 对PD 小鼠模型NLRP3 炎症小体相关蛋白表达的影响
结果显示,模型组小鼠NLRP3、 ASC、 Caspase1、 IL-1β 蛋白表达水平显著升高,与模型组比较,模型+TQ 组NLRP3 炎症小体蛋白表达水平显著降低(P<0.01)。见图2、表4。

图2 小鼠中脑NLRP3、ASC、caspase-1 和IL-1β 蛋白的表达(n=6)Fig 2 Protein expression of NLRP3, ASC, caspase-1 and IL-1β in mouse midbrain (n=6)
表4 小鼠中脑NLRP3、ASC、Caspase-1 和IL-1β 蛋白的表达(n=6,±s)Tab 4 Expression of NLRP3, ASC, Caspase-1 and IL-1β proteins in mouse midbrain(n=6,±s)

表4 小鼠中脑NLRP3、ASC、Caspase-1 和IL-1β 蛋白的表达(n=6,±s)Tab 4 Expression of NLRP3, ASC, Caspase-1 and IL-1β proteins in mouse midbrain(n=6,±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别对照组对照+TQ 组模型组模型+TQ 组FP NLRP3/Tubulin 0.058 2±0.000 3 0.134 1±0.004 5 0.750 9±0.021 4**0.281 6±0.006 2##2 244.538 ASC/Tubulin 0.412 6±0.011 4 0.206 2±0.000 8 1.481 8±0.056 1**0.163 6±0.012 0##1 348.206 IL-1β/Tubulin 0.296 6±0.010 9 0.135 8±0.006 7 0.821 6±0.012 9**0.114 7±0.005 8##3 572.197<0.001<0.001<0.001 Caspase-1/Tubulin 0.487 0±0.001 8 0.536 8±0.006 2 0.740 1±0.012 4**0.386 5±0.009 7##916.856<0.001
3.4 MPP+对BV-2 细胞活化的影响
未任何干预BV-2 细胞处于未活化状态,轴突清晰可见,贴壁良好。加入不同浓度MPP+后,BV-2 细胞表面突起逐渐收缩,并呈现出胞体增大、突起变短、细胞形态呈圆形的活化状态。见图3。

图3 倒置显微镜下BV-2 细胞的形态变化(×200)Fig 3 Morphological changes of BV-2 cells under an inverted microscope (×200)
3.5 MPP+诱导BV-2 细胞活化间接对SH-SY5Y细胞损伤的影响
为检测MPP+是否在激活BV-2 细胞所需的剂量下引起的SH-SY5Y 细胞损伤,观察MPP+对SH-SY5Y 细胞活力的影响。MTT 结果显示,MPP+在1~400 μmol/L 浓度范围内未引起显著的SH-SY5Y 细胞死亡(P>0.05)。当MPP+浓度为100 μmol/L 时,BV-2 细胞大量活化。见图3、表5。
表5 MPP+对BV-2 细胞和SH-SY5Y 细胞活力的影响(n=3,±s,%)Tab 5 Effect of MPP+ on the viability of BV-2 cells and SH-SY5Y cells(n=3,±s,%)

表5 MPP+对BV-2 细胞和SH-SY5Y 细胞活力的影响(n=3,±s,%)Tab 5 Effect of MPP+ on the viability of BV-2 cells and SH-SY5Y cells(n=3,±s,%)
注:与对照组比较,**P<0.01。
组别对照组模型组质量浓度(μmol/L)25 BV-2 细胞存活率98.879 0±5.028 0 100.394 0±3.745 6 SH-SY5Y 细胞存活率102.619 9±1.892 3 120.780 4±9.745 0 50 75 100 200 400 800 99.746 5±8.348 6 96.281 7±6.334 8 115.316 3±14.793 9 84.639 2±4.369 4**63.847 9±8.877 2**54.383 4±6.804 2**110.058 1±10.266 0 104.360 2±11.170 2 122.534 0±11.954 8 132.993 3±4.963 4 114.746 2±12.237 4 87.228 3±4.693 3**F P 19.668 7.185<0.001<0.001
BV-2 细胞与SH-SY5Y 细胞条件培养下,100 μmol/L MPP+可显著降低SH-SY5Y 细胞存活率(P<0.01),见表6。
表6 MPP+对条件培养SH-SY5Y 细胞活力的影响(±s,%)Tab 6 Effect of MPP+ on the viability of conditioned SH-SY5Y cells(±s,%)

表6 MPP+对条件培养SH-SY5Y 细胞活力的影响(±s,%)Tab 6 Effect of MPP+ on the viability of conditioned SH-SY5Y cells(±s,%)
注:与对照组比较,**P<0.01。
组别对照组条件培养组100 μmol MPP+细胞存活率(%)99.998 2±3.919 5 35.986 0±6.933 6**88.230 5±10.263 9 F P 61.903<0.001
然而,等量的MPP+(不经过BV-2 细胞调节)直接添加到SH-SY5Y 细胞培养液中,并未降低SH-SY5Y 细胞活性。根据MTT 结果以100 μmol/L MPP+进行后续实验。
3.6 TQ 对条件培养SH-SY5Y 细胞损伤的影响
条件培养SH-SY5Y 细胞24 h 后,结果显示,0.25 μmol/L 及0.5 μmol/L TQ 可 明 显 减 轻 条 件 培养液诱导的SH-SY5Y 细胞死亡(P<0.01)。见表7。以0.25 μmol/L 及0.5 μmol/L TQ 进 行 后 续实验。
表7 TQ 对MPP+介导的条件培养SH-SY5Y 细胞活力的影响(n=3,±s,% )Tab 7 Effect of TQ on the Activity of MPP+Mediated Conditional Culture SH-SY5Y Cells(n=3,±s,% )
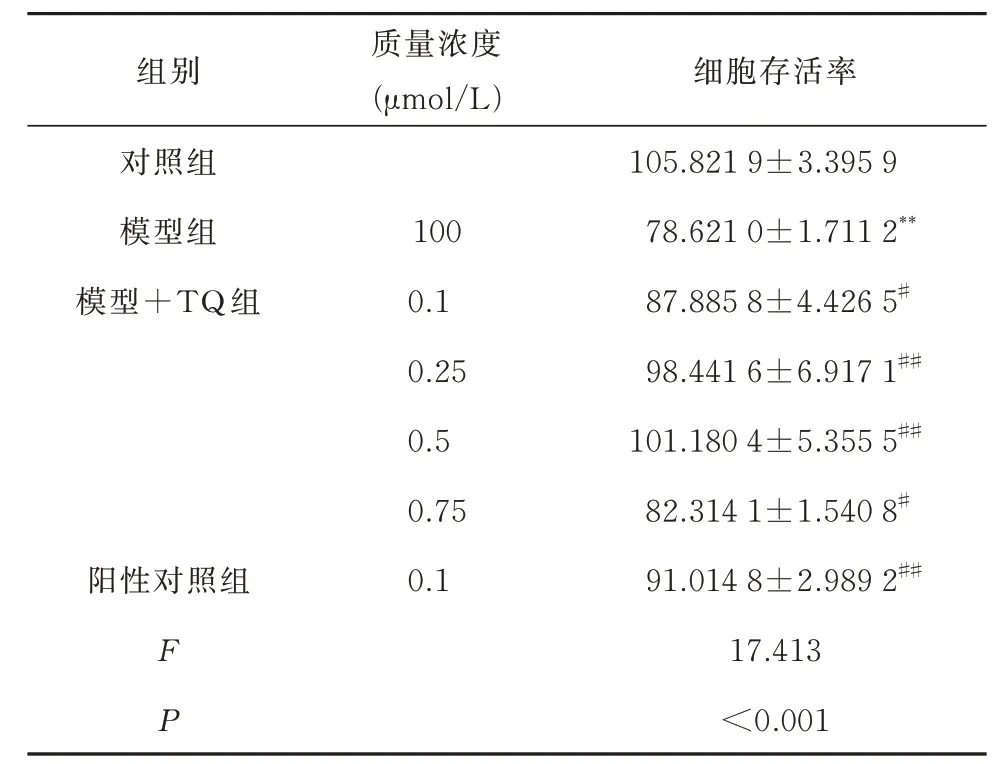
表7 TQ 对MPP+介导的条件培养SH-SY5Y 细胞活力的影响(n=3,±s,% )Tab 7 Effect of TQ on the Activity of MPP+Mediated Conditional Culture SH-SY5Y Cells(n=3,±s,% )
注:与对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 质量浓度(μmol/L)细胞存活率105.821 9±3.395 9 78.621 0±1.711 2**87.885 8±4.426 5#98.441 6±6.917 1##101.180 4±5.355 5##82.314 1±1.540 8#91.014 8±2.989 2##17.413<0.001对照组模型组模型+TQ 组阳性对照组100 0.1 0.25 0.5 0.75 0.1 F P
3.7 百里醌对条件培养SH-SY5Y细胞凋亡率的影响
结果显示,模型组凋亡细胞数量显著增多(P<0.01),而模型+TQ 组和阳性对照组凋亡阳性细胞 显著减少(P<0.01)。见图4、表8。

图4 TQ 对条件培养SH-SY5Y 细胞凋亡的抑制作用(n=3;比例尺:200 μm)Fig 4 Inhibition of TQ on apoptosis in conditioned SH-SY5Y cells (n=3;scale bar: 200 μm)
表8 TQ 对MPP+条件培养SH-SY5Y 细胞凋亡率的影响(n=3,±s,% )Tab 8 Effect of TQ on apoptosis rate of SH-SY5Y cells cultured under MPP+ conditions(n=3,±s,% )

表8 TQ 对MPP+条件培养SH-SY5Y 细胞凋亡率的影响(n=3,±s,% )Tab 8 Effect of TQ on apoptosis rate of SH-SY5Y cells cultured under MPP+ conditions(n=3,±s,% )
注:与对照组比较, **P<0.01;与模型组相比,##P<0.01。
组别 质量浓度(μmol/L)细胞凋亡率对照组模型组模型+TQ 组阳性对照组1.516 3±0.131 6 13.699 7±0.532 71**3.816 3±0.330 8##1.838 0±0.154 4##4.743 0±0.183 3##795.032<0.001 100 0.25 0.5 0.1 F P
3.8 TQ 对条件培养SH-SY5Y 细胞凋亡相关蛋白的影响
MPP+后Bcl-2/Bax 比值表达显著下调,而TQ可以促进Bcl-2/Bax 比值的表达(P<0.01)。同时,MPP+促进了凋亡关键调控蛋白Caspase-3 的表达(P<0.01)提示激活的BV-2 细胞对SH-SY5Y 细胞的损伤作用,而TQ 干预后显著抑制MPP+诱导的Caspase-3 的增加(P<0.01)。提示TQ 通过干预BV-2 细胞的激活,减轻SH-SY5Y 细胞凋亡。见图5 及表9。
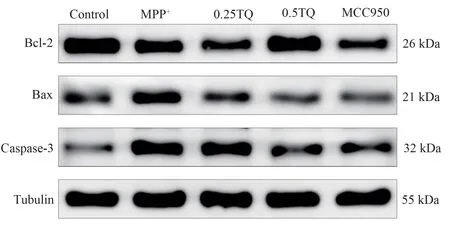
图5 各组条件培养SH-SY5Y 细胞Bcl-2、Bax、caspase-3 蛋白表达比较(n=3)Fig 5 Bcl-2, Bax, and caspase-3 protein expression in SH-SY5Y cells under conditions in each group(n=3)
表9 各组条件培养SH-SY5Y 细胞Bcl-2、Bax、Caspase-3 蛋白表达比较(n=3,±s)Tab 9 Bcl-2, Bax and Caspase-3 protein expression in SH-SY5Y cells cultured under conditions in each group(n=3,±s)

表9 各组条件培养SH-SY5Y 细胞Bcl-2、Bax、Caspase-3 蛋白表达比较(n=3,±s)Tab 9 Bcl-2, Bax and Caspase-3 protein expression in SH-SY5Y cells cultured under conditions in each group(n=3,±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别对照组模型组模型+TQ 组质量浓度(μmol/L)阳性对照组100 0.25 0.5 0.1 FP Bcl-2/Tubulin 1.184 9±0.003 0 0.694 6±0.001 9**0.614 6±0.003 1##1.123 6±0.010 5##0.661 3±0.000 2##8 450.052 Bax/Tubulin 0.472 4±0.001 2 0.807 7±0.002 8**0.511 7±0.002 2##0.506 0±0.004 5##0.499 9±0.002 8##7 017.984 Caspase3/Tubulin 0.337 1±0.003 3 0.905 5±0.002 9**0.690 0±0.004 4##0.532 3±0.006 4##0.484 5±0.003 7##7 580.833<0.001<0.001<0.001
3.9 TQ 对BV-2 细胞炎症因子分泌的影响
ELISA 结 果 显 示,100 μmol/L MPP+作 用BV-2 细 胞8 h 后,IL-1β 表 达 量 较 对 照 组 显 著 增 加(P<0.01);0.25 μmol/L 及 0.5 μmol/L TQ 预处理后,可降低IL-1β 水平。见表10。
表10 各组BV-2 细胞IL-1β 含量比较(n=3,±s)Tab 10 IL-1β content in BV-2 cells of each group(n=3,±s,pg/mL)

表10 各组BV-2 细胞IL-1β 含量比较(n=3,±s)Tab 10 IL-1β content in BV-2 cells of each group(n=3,±s,pg/mL)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别 质量浓度(μmol/L)IL-1β对照组模型组模型+TQ 组2.300 0±1.419 3 20.877 8±1.003 5**9.000 0±0.351 1##11.633 3±0.655 7##198.783<0.001 100 0.25 0.5 FP
3.10 TQ 对BV-2 细胞NLRP3 炎症小体相关蛋白表达的影响
研究结果发现,MPP+诱导BV-2 细胞NLRP3、ASC、Caspase-1、 IL-1β 炎症信号通路水平显著升高,NLRP3、 ASC、 Caspase-1、 IL-1β 炎症信号通路均在0.25 μmol/L, 0.5 μmol/L TQ 干预后得到显著的抑制(P<0.01)。见图6 及表11。

图6 各组BV-2 细胞NLRP3、ASC、caspase-1 和IL-1β 表达比较(n=3)Fig 6 NLRP3, ASC, caspase-1 and IL-1β expression in BV-2 cells of each group (n=3)
表11 各组BV-2 细胞NLRP3、ASC、Caspase-1 和IL-1β 表达比较(n=3,±s)Tab 11 NLRP3, ASC, Caspase-1 and IL-1β expression in BV-2 cells of each group(n=3,±s)

表11 各组BV-2 细胞NLRP3、ASC、Caspase-1 和IL-1β 表达比较(n=3,±s)Tab 11 NLRP3, ASC, Caspase-1 and IL-1β expression in BV-2 cells of each group(n=3,±s)
注:与对照组比较,**P<0.01;与模型组比较,##P<0.01。
组别 质量浓度(μmol/L)NLRP3/Tubulin ASC/Tubulin Caspase-1/Tubulin IL-1β/Tubulin对照组模型组模型+TQ 组阳性对照组0.879 6±0.031 1 1.606 5±0.006 8**0.892 1±0.013 1##1.132 8±0.031 5##1.195 4±0.026 5##455.846<0.001 100 0.25 0.5 0.1 F P 0.050 8±0.001 8 1.385 7±0.005 7**0.365 3±0.003 8##0.391 3±0.011 9##0.506 7±0.000 9##19 593.593<0.001 0.139 9±0.005 1 0.860 7±0.001 2**0.252 4±0.004 4##0.559 1±0.006 2##0.645 5±0.004 2##12 539.373<0.001 0.253 4±0.002 2 0.767 0±0.0 04 1**0.508 3±0.002 0##0.666 9±0.015 2##0.455 1±0.003 6##2 188.170<0.001
4 讨论
PD 与神经免疫炎症有密切联系,激活的小胶质细胞释放的炎症细胞因子TNF-α 能够与神经元上的TNF 受体结合,激活半胱氨酸天冬氨酸蛋白酶(Caspase)依赖的级联反应并伴随Toll 样受体和核苷酸结合寡聚化样受体的激活,此过程使神经炎症加重,导致神经元凋亡[15,16]。研究显示[17,18],PD 患者和PD 动物模型黑质区NLRP3 炎症小体活化,证实NLRP3 炎症小体抑制剂能显著缓解多巴胺能神经元的缺失,改善PD 小鼠运动功能障碍。研究发现PD 的发展进程中,病理性α-syn 也会引起NLRP3炎症小体的激活,导致DA 神经元损伤[19]。TQ 可通过自由基清除、增加基因转录的作用,可产生大量天然的抗氧化剂[20]。TQ 通过抑制凋亡前蛋白Caspase -3、Caspase -9 的表达,有效减轻神经元损伤[21]。TQ 还通过抑制LPS 诱导的IL-6 和诱生型一氧化氮炎症因子表现出抗炎活性[22]。
体外实验结果显示,TQ 可明显改善PD 小鼠行为障碍,降低PD 小鼠α-Syn 的水平和NLRP3 炎症小体相关蛋白的表达,促进DA 能神经元表面特征性抗体-TH 蛋白的表达。体内实验以LPS 联合MPP+刺激BV-2 细胞模拟PD 病理环境,并给予TQ 干预。Bax 作为Bcl-2 家族中常见凋亡基因,与Bcl-2 结合形成异源二聚体,调控Bcl-2 的活性,当Bax 表达增多的时候,Bax/Bcl-2 上调,整体处于促进凋亡的状态,可促进Caspase-3 的表达[23,24]。实验结果显示,在PD 模型中Bax 表达明显上调,Bcl-2 表达下调,TQ 处理可以抑制Bax 的上调,促进Bcl-2的表达。并且,TQ 也可以抑制Caspase-3 促凋亡蛋白表达水平的上调。TQ 处理后可降低炎症因子IL-1β 水平和NLRP3 炎症小体相关蛋白的表达。提示MPP+激活BV-2 细胞后炎性细胞因子大量释放,促进NLRP3 炎性小体释放进而激活Bax 凋亡蛋白,导致SH-SY5Y 细胞的凋亡。TQ 通过抑制NLRP3炎症小体激活,减轻PD 神经炎性损伤,进而保护SH-SY5Y 细胞。
综上所述,TQ 能够减轻PD 小鼠模型DA 能神经元的损伤;TQ 可减少MPP+干预引起的BV-2 细胞NLRP3 炎症小体的表达和炎症因子释放,减轻炎症反应,改善多巴胺能神经元损伤,在PD 神经炎症方面具有保护作用。
作者贡献度说明:
葛淑丽:设计实验、分析数据、撰写论文;程楠:对论文提出指导意见;董健健、徐陈陈:参与动物造模及实验指标检测。
所有作者声明不存在利益冲突关系。
